Tất cả các thuốc thử đã được sử dụng như đã nhận trừ khi có quy định khác. Tất cả các hóa chất được mua từ Sigma Aldrich ngoại trừ các hạt đếm (Hạt đếm tuyệt đối CountBright, Invitrogen). ζ-Tiềm năng được đo bằng Zetasizer NanoZS90 (Dụng cụ Malvern). Kích thước và hình thái của các hạt được SEM nghiên cứu trong kính hiển vi JEOL JSM 7800F Prime có tích hợp EDS để cung cấp phân tích nguyên tố. Kích thước hạt được xác định bằng cách đo 50 hạt độc lập. Phương pháp sắc ký lớp mỏng tức thời vô tuyến (ITLC) được phát triển trên giấy sắc ký vi sợi thủy tinh Agilent Technologies được tẩm axit silicic và được phân tích bằng máy quét TLC đếm dòng chảy Lablogic và máy dò ống nhân quang BioScan B-FC-3200 (PMT) bằng phần mềm Laura. Pha động ITLC bao gồm axit xitric 0.175 M và trinatri citrat 0.325 M trong nước trừ khi có quy định khác. Các mẫu phóng xạ được đo bằng Capintec CRC-25R (Capintec) hoặc LKB Wallac 1282 Compugamma CS (PerkinElmer) trong đó dữ liệu được thu thập bằng phần mềm EdenTerm. Các thí nghiệm tế bào học dòng chảy được thực hiện trong máy phân loại tế bào BD FACSMelody bằng Phần mềm BD FACSChorus. Hình ảnh PET/CT được thu thập bằng máy quét NanoPET/CT (Mediso), được tái tạo bằng phần mềm Nucline v.0.21 và hình ảnh được phân tích bằng phần mềm VivoQuant (phiên bản 3.5, InviCRO). Dữ liệu chế độ danh sách được lấy bằng một công cụ phần mềm MATLAB cụ thể do Mediso phát triển. Kỹ thuật chụp X quang tự động được thực hiện trên thiết bị GE Amersham Typhoon.
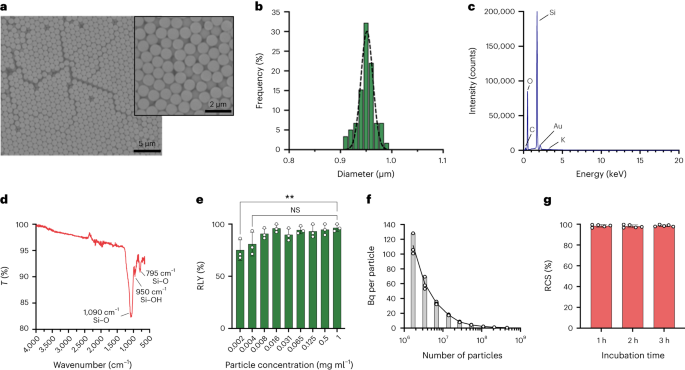
Tổng hợp các hạt silica có kích thước dưới micromet
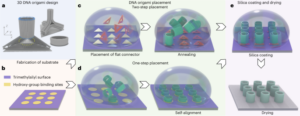
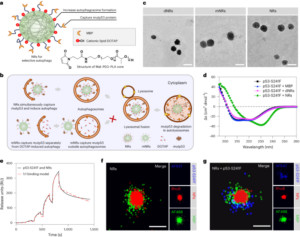
Các hạt được tổng hợp bằng phương pháp Stöber. Phương pháp này dựa trên quá trình thủy phân và ngưng tụ liên tục các alkoxit silic để tạo ra các hạt silic hình cầu, đơn phân tán.27. Tetraethyl orthosilicate (TEOS) được sử dụng làm nguồn silicon, amoniac làm chất xúc tác bazơ và kali clorua làm chất điện phân. Dung dịch TEOS trong etanol liên tục được thêm vào dung dịch chứa chất xúc tác và chất điện phân. Việc sửa đổi lượng thuốc thử ban đầu hoặc tỷ lệ bổ sung sẽ tạo ra sự khác biệt về kích thước hạt như đã báo cáo trước đây28. Ở đây, hai dung dịch đã được chuẩn bị trước khi tổng hợp các hạt: Dung dịch 1 chứa 19.0 mmol TEOS trong 33.3 ml EtOH và Dung dịch 2 chứa 0.23 mmol KCl trong 9 ml amoniac, 65 ml EtOH và 6.75 ml H2O. Để tổng hợp, Dung dịch 2 được đặt vào bình đáy tròn 250 ml được làm nóng ở 50°C trong khi khuấy ở tốc độ 300 vòng/phút trong 15 phút. Sau đó, Dung dịch 1 được thêm từng giọt vào Dung dịch 2 (tốc độ cung cấp 0.2 ml/phút-1). Sau khi thêm Dung dịch 1, các hạt thu được được tinh chế bằng cách ly tâm ở 18,300g trong 3 phút và rửa bằng EtOH XNUMX lần. Cuối cùng, SiO2 các vi hạt được làm khô trong chân không.
Ghép các hạt có kích thước dưới micromet bằng silane-PEG5k
20 mg ml-1 dung dịch silane-PEG5k (Sigma Aldrich) trong EtOH 98% được thêm vào dung dịch smSiP ở mức 5 mg ml-1 trong EtOH 98% và 2.8% amoniac. Hỗn hợp này được khuấy qua đêm ở nhiệt độ phòng và các hạt được thu hồi bằng cách ly tâm ở 18,300g trong 3 phút. Cuối cùng, các hạt được rửa ba lần bằng nước cất và sấy khô trong chân không qua đêm. Dung dịch rửa được làm đông khô qua đêm và lượng silan–PEG chưa được kết dính5k trọng số để tính hiệu suất phản ứng. 0.05 mg ml-1 giải pháp smSiP–PEG5k trong nước cất được sử dụng cho các phản ứng đánh dấu phóng xạ tiếp theo.
[68Ga]GaCl3
Gallium-68 được rửa giải dưới dạng [68Ga]GaCl3 từ Eckert và Ziegler 68Ge /68Máy tạo ga trong HCl siêu tinh khiết (4 ml, 0.1 M) được sản xuất theo yêu cầu thực hành sản xuất tốt (ABX).
Nồng độ của [68Ga]GaCl3 rửa giải bằng trao đổi cation
Nồng độ rửa giải được thực hiện bằng cách sử dụng thiết lập được mô tả trong Hình bổ sung. 1. Đầu tiên, 4 ml [68Ga]GaCl3 dịch rửa giải được nạp vào hộp mực Strata-XC 33u (Phenomenex) và dịch rửa giải bị loại bỏ. Sau đó, hộp được rửa bằng 5 ml dung dịch axeton/HCl 0.1 M (80:20) và loại bỏ dịch rửa giải. Cuối cùng, [ tập trung68Ga]GaCl3 được thu thập bằng cách thêm 700 µl dung dịch axeton/0.05 M HCl (98:2), sấy khô trong môi trường N2 dòng và được treo lại trong 50 µl dung dịch đệm HEPES 0.5 M, (pH 4.9). Radio-TLC được thực hiện ở các giai đoạn khác nhau để kiểm soát chất lượng. Giao thức này mất khoảng 20 phút mang lại hiệu suất phục hồi là 86.2 ± 8.5%.
Đánh dấu phóng xạ các hạt silica ở các nồng độ khác nhau bằng 68Ga
Các hạt silica được phân tán lại ở các nồng độ khác nhau (từ 1 đến 0.002 mg ml-1) trong dung dịch đệm HEPES 0.5 M (pH 4.9). Sau đó, 50 µl dung dịch được thêm vào ống phản ứng trước khi thêm [68Ga]GaCl3 rửa giải trong 50 µl dung dịch đệm HEPES 0.5 M (pH 4.9). Các phản ứng được tiến hành ở 90°C trong 30 phút và TLC vô tuyến được thực hiện để tính hiệu suất hóa phóng xạ.
Đo nồng độ hạt bằng phương pháp tế bào học dòng chảy
Nồng độ hạt được tính toán bằng phương pháp tế bào học dòng chảy bằng cách sử dụng hạt đếm (Hạt đếm tuyệt đối CountBright, Invitrogen) theo hướng dẫn của nhà sản xuất. Các hạt silica được treo lại ở mức 0.05 mg ml-1, siêu âm trong 10 phút và đưa qua bộ lọc có kích thước giới hạn 10 µm (Bộ lọc Ống tiêm KX, Nylon, 25 mm, 10 µm). Hạt đếm tuyệt đối CountBright được làm ấm đến nhiệt độ phòng và lắc xoáy trong 30 giây. Sau đó, 50 µl hạt được thêm vào 300 µl hạt silica và hỗn hợp này được khuấy trộn trong 30 phút để thu được dung dịch đồng nhất. Mẫu được chạy trên máy đếm tế bào dòng chảy và ngưỡng phân tán thuận (FSC) được đặt để bao gồm các hạt và hạt trên biểu đồ phân tán tuyến tính-FSC so với tuyến tính. Sau đó, điện áp của máy dò huỳnh quang được điều chỉnh cho các hạt đếm và chiến lược chọn cổng được thực hiện để cô lập các hạt silica và quần thể hạt đếm. Cuối cùng, các cổng trên các hạt và các hạt đếm tuyệt đối được rút ra và 1,000 sự kiện hạt được ghi lại cho mỗi mẫu. Sử dụng chiến lược này, số lượng hạt trong dung dịch được tính theo phương trình sau:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Hạt}},{mathrm{count}},times,{mathrm{Đếm}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} lần,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}left(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Dán nhãn phóng xạ 500 smSiP
Năm trăm smSiP đã được thêm vào 50 µl [68Ga]GaCl3 rửa giải trong dung dịch đệm HEPES 0.5 M pH 4.9. Sau đó, 5.6 µl polysorbate 80 được thêm vào và hỗn hợp này được gia nhiệt ở 90°C trong 30 phút với tốc độ 900 vòng/phút trong máy trộn nhiệt. Sau đó, quy trình tinh chế gồm nhiều bước cuối cùng được thiết kế để loại bỏ các chất keo/không phản ứng. 68Ga. Năm mươi microlit 10 mM EDTA đã được thêm vào và hỗn hợp này được ủ trong 5 phút ở nhiệt độ phòng. Sau đó, các hạt được ly tâm trong 3 phút ở tốc độ 18,300g, được huyền phù lại trong 500 µl PBS chứa 1 mM EDTA + 0.1% polysorbate 80 và lắc nhẹ trong 10 giây. Các hạt được ly tâm lại, rửa bằng dung dịch EDTA 0.1 mM + 0.1% polysorbate 80 trong PBS và lắc nhẹ trong 10 giây. Cuối cùng, các hạt được ly tâm và rửa thêm năm lần nữa bằng PBS + 0.1% polysorbate 80 và được huyền phù lại trong 500 µl PBS. Phản ứng đánh dấu phóng xạ được theo dõi bằng TLC phóng xạ trong các bước phản ứng liên tiếp để đánh giá sự hiện diện của chất keo (có thể bị nhầm lẫn với các hạt nếu không được loại bỏ đúng cách), việc đánh dấu phóng xạ của các hạt và độ tinh khiết của sản phẩm cuối cùng. RLY được tính bằng cách so sánh giữa lượng phóng xạ trong các hạt và chất nổi phía trên sau các bước rửa.
Phân đoạn
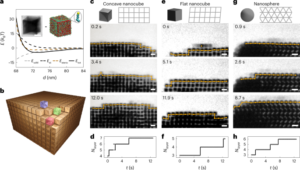
Đối với chiến lược phân đoạn, thể tích từ 0.5 µl đến 20 µl dung dịch 68Ga-smSiP ở nồng độ lý thuyết là 1 hạt µl-1 được thêm vào các ống mẫu khác nhau theo từng bước 1 µl (0.5, 1, 2, 3…) và PBS được thêm vào để nâng thể tích cuối cùng lên 50 µl. Sau đó, 37.5 µl từ ống thứ nhất được bơm vào ống mẫu thứ hai, 25 µl của ống thứ hai vào ống thứ ba và cuối cùng là 12.5 µl của ống thứ ba vào ống thứ tư. Chiến lược này cung cấp bốn ống cho mỗi mẫu với thể tích cuối cùng là 12.5 µl mỗi ống. Độ phóng xạ trong mỗi ống được đo bằng máy đếm gamma và các giá trị được tính bằng kBq bằng cách sử dụng đường cong hiệu chuẩn để so sánh và phân tích thêm. Các mẫu chứa hầu hết hoạt tính phóng xạ chỉ trong một ống được siêu âm trong 30 giây ở nhiệt độ phòng và trải qua bước phân đoạn thứ hai. Sau đó, các mẫu trong đó tất cả hoạt độ phóng xạ được tìm thấy trong một ống duy nhất (với hoạt độ không đáng kể trong ba ống còn lại) được sử dụng cho các thí nghiệm in vivo/ex vivo tiếp theo.
Chụp ảnh ảo PET/CT
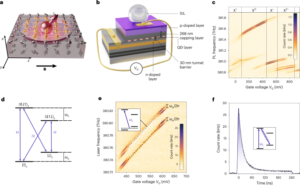
Một thí nghiệm tạo ảnh ảo đã được thực hiện với một 68Ga-smSiP. Một ống thông được sử dụng để đưa hạt vào ống mẫu để đánh giá xem liệu một hạt đơn lẻ có thể bị giữ lại trong ống thông trong quá trình sử dụng hay không. Tóm lại, ống ảo được đặt vào máy quét nanoPET/CT với phần cuối của đầu ống thông được gắn vào ống. Sau khi bắt đầu thu nhận PET, hạt được phân tán lại trong 100 µl PBS được phân phối cùng với một ống tiêm insulin gắn vào đầu ống thông. Sau đó, ống thông được rửa bằng 50 µl PBS để đảm bảo phân phối hạt vào ống ảo. Việc thu nhận PET được thực hiện trong 2 giờ sau đó là chụp CT tiêu chuẩn.
Hình ảnh PET/CT in vivo
Các nghiên cứu hình ảnh động vật đã được xem xét và thực hiện về mặt đạo đức theo Đạo luật Động vật (Quy trình khoa học) năm 1986 (ASPA) của Văn phòng Nội vụ Vương quốc Anh quản lý thí nghiệm trên động vật. Hình ảnh in vivo được tiến hành trên chuột BALB/c 8 tuần tuổi khỏe mạnh. Động vật được gây mê bằng isoflurane (2–3% oxy), được đặt ống thông và đặt trên giường máy quét trong tình trạng gây mê. Giường được làm nóng đến 37 ° C bằng luồng không khí bên trong để giữ cho động vật ở nhiệt độ cơ thể bình thường, đồng thời tốc độ hô hấp được theo dõi và duy trì ở mức 60–80 nhịp thở/phút.-1 trong suốt quá trình quét. Duy trì việc kiểm soát nhiệt độ của động vật là rất quan trọng, vì nhiệt độ giảm đột ngột có thể dẫn đến giảm vận tốc của các hạt trong máu. Một 68Ga-smSiP (n = 4) hoặc 68Ga-smSiP–PEG5k hạt (n = 2) được truyền qua ống thông trong 100 µl PBS, sau đó rửa bằng 50 µl PBS sau khi bắt đầu thu nhận PET (chế độ trùng khớp 1:5; cửa sổ thời gian trùng khớp 5 ns). PET được ghi lại trong 2 giờ và sau đó thực hiện chụp CT hình bán nguyệt. Nhiệt độ cơ thể và nhịp hô hấp của động vật được theo dõi trong toàn bộ quá trình. Hình ảnh PET/CT động được tái tạo bằng cách sử dụng tái tạo Tera-Tomo 3D (cửa sổ năng lượng 400–600 keV, chế độ trùng khớp 1:5, 20 lần lặp và 1 tập hợp con) ở kích thước voxel 0.4 × 0.4 × 0.4 mm3 và hiệu chỉnh sự suy giảm, tán xạ và phân rã. Có thể tìm thấy dữ liệu chế độ danh sách cho tất cả việc mua lại PET/PEPT cho 68Ga-smSiP tại ref. 29 va cho 68Ga-smSiP–PEG5k tại trọng tài. 30.
Theo dõi thời gian thực
Đầu tiên, dữ liệu được xuất từ máy quét ở định dạng listmode (nghĩa là định dạng có dấu thời gian và chỉ số tinh thể cho các photon trùng khớp được phát hiện). Một phép biến đổi hình học đã được áp dụng để chuyển đổi từ chỉ số tinh thể sang vị trí tính bằng đơn vị mm. Phương pháp Birmingham tính toán lặp đi lặp lại MDP từ một tập hợp con của tất cả LoR. Nó thực hiện điều này bằng cách loại bỏ các LoR nằm xa hơn một khoảng cách đã đặt so với MDP vì những LoR này có thể phát sinh từ các LoR sai, ví dụ: các LoR có thể bắt nguồn từ sự phân tán. MDP được tinh chỉnh qua mỗi lần lặp; số lần lặp được thiết lập một cách hiệu quả bởi f-hệ số và liên quan đến tổng số LoR được sử dụng để ước tính vị trí hạt cuối cùng trong tập hợp con đó (ví dụ: một f-hệ số 0.5 có nghĩa là vòng lặp sẽ kết thúc khi vẫn còn 50% LoR trong tập hợp con). Số lượng LoR được sử dụng trong một tập hợp con có thể được giảm xuống để cải thiện việc lấy mẫu theo thời gian (các tập hợp con liên tiếp theo thời gian không có sự trùng lặp) với cái giá phải trả là làm tăng độ không đảm bảo về vị trí (có thể tìm thêm chi tiết về thuật toán trong Parker et al.5) Phương pháp Birmingham được sử dụng để phân tích dữ liệu chế độ danh sách từ máy quét PET. Một cỡ mẫu thích ứng đã được sử dụng để theo dõi hạt ở chuột. Cỡ mẫu được đặt để đạt được sự cân bằng giữa lấy mẫu theo thời gian vừa đủ trong khi giảm thiểu lỗi định vị. Cỡ mẫu từ 100 đến 200 LoR đã được sử dụng trong giai đoạn đầu của quá trình quét (<60 giây kể từ khi bắt đầu quét), với f = 0.1, mang lại khoảng thời gian khoảng 1–5 giây. Ở thời gian quét> 60 giây, cỡ mẫu thay đổi trong khoảng từ 1,000 đến 2,000, mang lại khoảng thời gian từ 30 giây đến 60 giây tùy thuộc vào thí nghiệm in vivo. Số lượng số đếm được sử dụng để tính MDP (trong lần lặp cuối cùng) có thể được tìm thấy bằng cách nhân cỡ mẫu với f-giá trị hệ số Các thông số này dựa trên kinh nghiệm trước đó và được thông báo bởi các ấn phẩm trước đó1.
Tốc độ đạt được là (sqrt{{v} _{x}^{2}+{v} _{y}^{2}+{v} _{z}^{2}}) Ở đâu ({v} _{m}^{2}) là vận tốc trong x, y và z hướng.
Sự hấp thu nội tạng ex vivo
Sự hấp thu ở các cơ quan khác nhau được đánh giá bằng cách đếm gamma. Sau khi chụp ảnh PET/CT in vivo, động vật bị giết do trật khớp cổ tử cung và các cơ quan được cắt bỏ và cân để đếm lượng phóng xạ trong máy đếm gamma (LKB Wallac 1282 Compugamma CS). Dữ liệu được biểu thị bằng phần trăm liều tiêm (liều trong cơ quan/tổng liều tiêm) trên mỗi gam mô (%ID g-1).
Chụp ảnh tự động
Hoạt độ phóng xạ trong phổi được theo dõi bằng máy dò bức xạ (đầu dò EP15, Morgan) và phổi được cắt thành các phần nhỏ bằng dao mổ cho đến khi thu được một phần mô nhỏ có tín hiệu phóng xạ. Mô được đông lạnh nhanh trong isopropanol −80 ° C. Ngay sau khi đông lạnh, mô được nhúng vào môi trường có nhiệt độ cắt tối ưu và cắt trong máy điều hòa nhiệt độ thành các lát 20 µm. Mỗi lát cắt được khảo sát bằng máy dò cho đến khi tìm thấy lát cắt phóng xạ. Phần trước (bên dưới nền), lát phóng xạ và tiếp theo (bên dưới nền) được đặt trên phiến kính hiển vi Super Frost (Epredia). Phần còn lại của mô còn lại cũng ở dưới nền. Bản kính hiển vi với ba phần được phủ một lớp màng bám và đặt đối diện với tấm chụp ảnh tự động GE qua đêm. Tấm này được phân tích bằng GE Amersham Typhoon với độ phân giải 25 µm và cài đặt PMT là 4,000. Hình ảnh chụp X quang tự động được đặt chồng lên hình ảnh của mô, cho thấy một điểm phóng xạ trong lát cắt phóng xạ. Để định lượng, các chất chuẩn được chuẩn bị theo các hoạt động đã biết khác nhau và mỗi chất chuẩn được thể hiện dưới dạng 1 µl ngũ tấu trên giấy. Các vết này được ủ trong cùng một màn hình lưu trữ phốt pho, BAS-IP MS (Tiêu chuẩn đa năng) của GE khi các hạt đơn lẻ được định lượng. Hình ảnh được thu bằng Amersham Typhoon 5 với Phần mềm điều khiển phiên bản 2.0 ở chế độ lân quang với kích thước điểm ảnh 100 µm và độ nhạy 4,000. Các hình ảnh được định lượng bằng phần mềm ImageQantTL v10.0-261 bằng hộp công cụ định lượng gel. Các điểm được sửa bằng cách chọn vùng ngay trước hoặc sau điểm làm nền không đổi. Thể tích vết thu được được sử dụng để tính Bq trong hạt trên cơ sở đường cong hiệu chuẩn.
Thống kê và khả năng tái sản xuất
Để phân tích định lượng, tối thiểu ba bản sao sinh học đã được phân tích ngoại trừ dữ liệu in vivo của 68Ga-smSiP–PEG5k (n = 2). Dữ liệu được phân tích bằng phương pháp phân tích phương sai một chiều thông thường (ANOVA) với bài kiểm tra so sánh nhiều lần của Dunnett và bài kiểm tra của Sinh viên. t-Bài kiểm tra. MỘT P giá trị <0.05, XNUMX được coi là có ý nghĩa thống kê.
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- PlatoData.Network Vertical Generative Ai. Trao quyền cho chính mình. Truy cập Tại đây.
- PlatoAiStream. Thông minh Web3. Kiến thức khuếch đại. Truy cập Tại đây.
- Trung tâmESG. Than đá, công nghệ sạch, Năng lượng, Môi trường Hệ mặt trời, Quản lý chất thải. Truy cập Tại đây.
- PlatoSức khỏe. Tình báo thử nghiệm lâm sàng và công nghệ sinh học. Truy cập Tại đây.
- nguồn: https://www.nature.com/articles/s41565-023-01589-8
- :là
- :không phải
- :Ở đâu
- ][P
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Tuyệt đối
- Tùy theo
- Đạt được
- mua lại
- mua lại
- mua lại
- Hành động
- hoạt động
- hoạt động
- thích nghi
- thêm
- thêm
- Ngoài ra
- Điều chỉnh
- quản lý
- quản lý
- tiến bộ
- Sau
- sau đó
- một lần nữa
- KHÔNG KHÍ
- AL
- thuật toán
- Tất cả
- Ngoài ra
- Amoniac
- số lượng
- an
- phân tích
- phân tích
- Neo
- và
- động vật
- động vật
- áp dụng
- khoảng
- LÀ
- nảy sinh
- AS
- At
- b
- lý lịch
- Cân đối
- cơ sở
- dựa
- cơ sở
- BD
- BE
- trước
- Bắt đầu
- phía dưới
- giữa
- Birmingham
- máu
- thân hình
- một thời gian ngắn
- mang lại
- đệm
- by
- tính toán
- tính
- tính toán
- phép tính
- CAN
- thực hiện
- Chất xúc tác
- pin
- hóa chất
- lựa chọn
- Nhấp chuột
- sự trùng hợp
- sự so sánh
- so sánh
- sáng tác
- Tập trung
- tập trung
- thực hiện
- nhầm lẫn
- liên tiếp
- xem xét
- không thay đổi
- liên tục
- điều khiển
- kiểm soát
- chuyển đổi
- sửa chữa
- Phí Tổn
- có thể
- Counter
- hơn nữa
- phủ
- Pha lê
- cs
- đường cong
- Cắt
- cắt
- dữ liệu
- cung cấp
- giao
- giao hàng
- Tùy
- mô tả
- thiết kế
- chi tiết
- phát hiện
- xác định
- phát triển
- sự khác biệt
- khác nhau
- hướng
- trật khớp
- khoảng cách
- làm
- liều
- rút ra
- Rơi
- suốt trong
- năng động
- e
- E&T
- mỗi
- Đầu
- hiệu quả
- điện
- nhúng
- phát thải
- việc làm
- cuối
- năng lượng
- Kỹ Sư
- đảm bảo
- Trang thiết bị
- lỗi
- ước tính
- Ether (ETH)
- đánh giá
- đánh giá
- sự kiện
- ví dụ
- Trừ
- loại trừ
- kinh nghiệm
- thử nghiệm
- thí nghiệm
- bày tỏ
- sai
- Sung
- Phim ảnh
- lọc
- cuối cùng
- Cuối cùng
- Tên
- năm
- dòng chảy
- sau
- tiếp theo
- Trong
- định dạng
- Forward
- tìm thấy
- 4
- Thứ tư
- Freezing
- từ
- đông lạnh
- FSC
- xa hơn
- Gates
- ge
- máy phát điện
- ly
- tốt
- cai quản
- Gram
- Tăng trưởng
- khỏe mạnh
- tại đây
- Trang Chủ
- Nơi làm việc
- HTTPS
- if
- hình ảnh
- hình ảnh
- Hình ảnh
- ngay
- quan trọng
- nâng cao
- in
- bao gồm
- tăng
- ủ
- độc lập
- chỉ số
- CHỈ SỐ
- thông báo
- ngay lập tức
- hướng dẫn
- cụ
- cụ
- tích hợp
- Giao thức
- nội bộ
- trong
- IT
- sự lặp lại
- sự lặp lại
- Giữ
- nổi tiếng
- Kx
- dẫn
- Có khả năng
- LINK
- Phổi
- duy trì
- sản xuất
- sản xuất
- vật liệu
- Có thể..
- có nghĩa
- đo
- đo lường
- trung bình
- phương pháp
- phương pháp
- chuột
- micron
- Kính hiển vi
- phút
- giảm thiểu
- tối thiểu
- máy trộn
- hỗn hợp
- ML
- di động
- Chế độ
- theo dõi
- chi tiết
- Morgan
- hầu hết
- MS
- nhiều
- nhân lên
- công nghệ nano
- Thiên nhiên
- tiếp theo
- Không
- bình thường
- con số
- được
- thu được
- of
- Office
- on
- ONE
- có thể
- phản đối
- tối ưu
- or
- bình thường
- Nền tảng khác
- nếu không thì
- ra
- kết thúc
- qua đêm
- Ôxy
- Giấy
- thông số
- hạt
- thông qua
- PBS
- mỗi
- tỷ lệ phần trăm
- thực hiện
- vật nuôi
- ma
- giai đoạn
- Photon
- hình ảnh
- điểm ảnh
- đặt
- plato
- Thông tin dữ liệu Plato
- PlatoDữ liệu
- dân số
- phần
- vị trí
- định vị
- Positron
- thực hành
- chuẩn bị
- sự hiện diện
- trước
- trước đây
- Thủ tướng Chính phủ
- Trước khi
- thăm dò
- thủ tục
- quá trình
- sản xuất
- Sản phẩm
- đúng
- giao thức
- cho
- cung cấp
- cung cấp
- đã mua
- chất lượng
- định lượng
- định lượng
- số lượng, lượng
- R
- Bức xạ
- radio
- phạm vi
- Tỷ lệ
- phản ứng
- phản ứng
- thời gian thực
- nhận
- gần đây
- ghi lại
- phục hồi
- Giảm
- giảm
- tài liệu tham khảo
- tinh chế
- khu
- quy định
- quan hệ
- vẫn
- còn lại
- tẩy
- Đã loại bỏ
- nhân rộng
- Yêu cầu
- Độ phân giải
- REST của
- kết quả
- xem xét
- xem xét
- Phòng
- chạy
- s
- tương tự
- quét
- quét
- quét
- SCI
- khoa học
- Màn
- Thứ hai
- giây
- phần
- SEM
- Độ nhạy
- định
- thiết lập
- thiết lập
- hiển thị
- Sigma
- Tín hiệu
- có ý nghĩa
- Silicon
- duy nhất
- Kích thước máy
- kích thước
- Slice
- Trượt
- nhỏ
- Snap
- Phần mềm
- giải pháp
- Giải pháp
- nguồn
- riêng
- Spot
- điểm
- giai đoạn
- Tiêu chuẩn
- tiêu chuẩn
- Bắt đầu
- Bắt đầu
- quy định
- thống kê
- Bước
- Các bước
- là gắn
- Chiến lược
- dòng
- nghiên cứu
- nghiên cứu
- Học tập
- đủ
- cung cấp
- khảo sát
- tổng hợp
- mất
- kỹ thuật
- Công nghệ
- thử nghiệm
- hơn
- việc này
- Sản phẩm
- sau đó
- lý thuyết
- nhiệt
- Kia là
- Thứ ba
- điều này
- số ba
- ngưỡng
- Thông qua
- khắp
- thời gian
- thời gian
- dấu thời gian
- tip
- mô
- đến
- công cụ
- Hộp công cụ
- Tổng số:
- theo dõi
- Theo dõi
- Chuyển đổi
- bị mắc kẹt
- hai
- Uk
- Không chắc chắn
- Dưới
- Bất ngờ
- các đơn vị
- cho đến khi
- đã sử dụng
- sử dụng
- Khoảng chân không
- giá trị
- Các giá trị
- Thành phố Velo
- phiên bản
- Versus
- vivo
- điện áp
- khối lượng
- khối lượng
- voxel
- W
- là
- rửa
- Nước
- là
- khi nào
- liệu
- cái nào
- trong khi
- toàn bộ
- sẽ
- cửa sổ
- với
- ở trong
- Năng suất
- mang lại
- năng suất
- zephyrnet
- Zip