Điều trị bệnh nhân ung thư bằng chùm bức xạ điều biến không gian có thể tiêu diệt khối u đồng thời giảm thiểu thiệt hại cho các cơ quan lân cận và mô khỏe mạnh. Đó là ý tưởng đằng sau liệu pháp xạ trị chùm tia nhỏ proton (pMBRT), một kỹ thuật điều trị mới nổi sử dụng một loạt các chùm bức xạ có kích thước dưới milimet để cung cấp liều điều trị.
Các tia nhỏ bao gồm các đỉnh liều cao và vùng lõm liều thấp xen kẽ, một mô hình ít gây hại cho mô khỏe mạnh ở độ sâu nông. Ở độ sâu lớn hơn, các chùm tia này dần dần mở rộng để tạo ra sự phân bố liều lượng đồng nhất trong thể tích mục tiêu. Các nghiên cứu trên động vật nhỏ đã chỉ ra rằng pMBRT có thể giảm độc tính mô bình thường, với kiểm soát khối u tương đương hoặc vượt trội, so với liệu pháp proton thông thường.
“Liệu pháp xạ trị bằng chùm tia nhỏ proton đã cho thấy mức tăng đáng kể về chỉ số điều trị trong các nghiên cứu tiền lâm sàng,” cho biết Ramón Ortiz từ Institut Curie. “Những kết quả đầy hứa hẹn này khuyến khích việc áp dụng kỹ thuật này vào lĩnh vực lâm sàng.” Với mục đích này, Ortiz (hiện tại UC San Francisco) và các đồng nghiệp tại Institut Curie đã đánh giá lợi ích của pMBRT trong điều trị ung thư di căn, báo cáo phát hiện của họ trong Vật lý y tế.
Mô phỏng kịch bản pMBRT
Bệnh di căn chiếm tới 90% các ca tử vong liên quan đến ung thư. Di căn thường được điều trị bằng kỹ thuật xạ trị lập thể (SRT), nhưng liều lượng cần thiết để kiểm soát tại chỗ thường bị hạn chế do nguy cơ gây độc cho mô bình thường gần đó. Ví dụ, đối với di căn não, hoại tử não do bức xạ được báo cáo ở một nửa số bệnh nhân được điều trị bằng SRT.
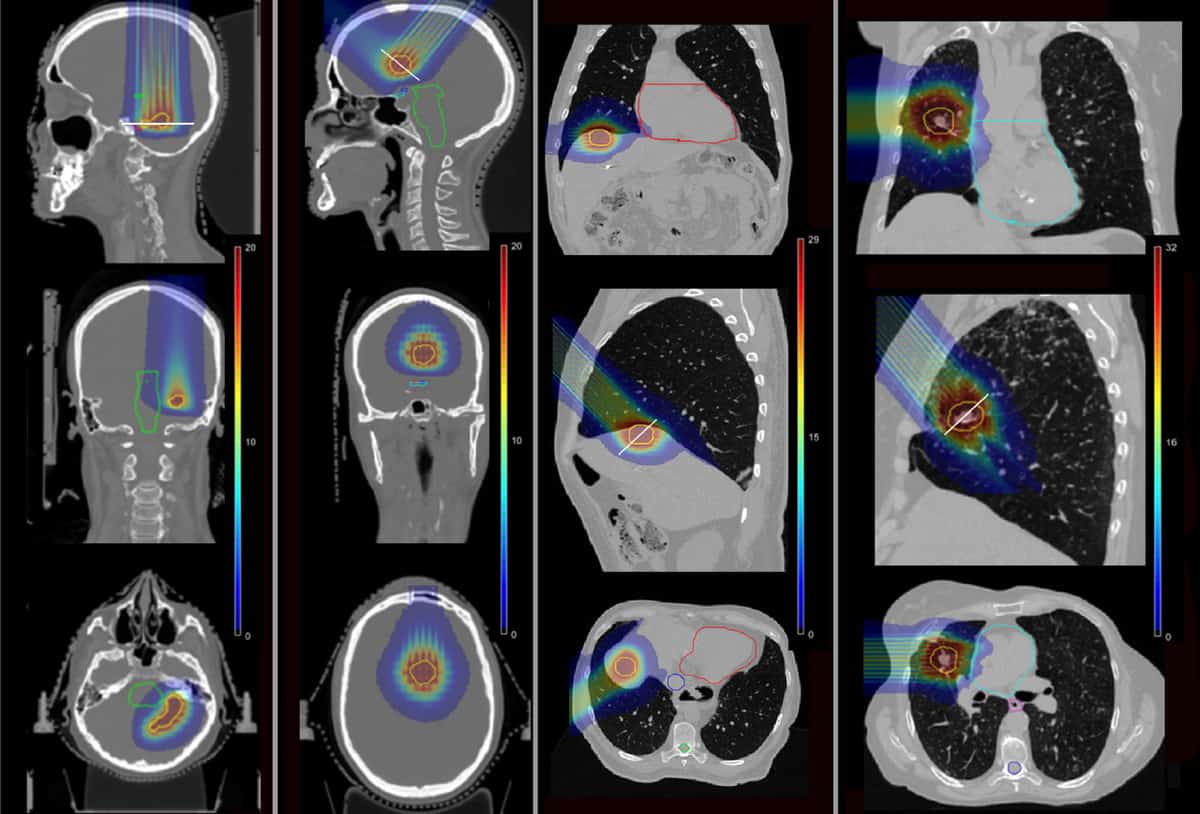
Để xác định liệu pMBRT có thể làm giảm các biến chứng như vậy hay không, nhóm đã sử dụng mô phỏng Monte Carlo để tính toán phân bố liều cho bốn bệnh nhân trước đây đã nhận SRT tại Institut Curie. Các bệnh nhân đã được điều trị các tổn thương di căn ở thùy thái dương, thùy trán, gan và phổi của não.
Các nhà nghiên cứu đã mô phỏng các kế hoạch pMBRT một phần, sử dụng một hoặc hai trường điều trị để cung cấp cùng một liều tương đương sinh học (BED) cho mục tiêu khối u theo quy định cho SRT. Họ đã lập mô hình một bộ chuẩn trực chùm tia nhỏ bằng đồng thau chứa các khe 400 μm × 5.6 cm ở các khoảng cách từ tâm đến tâm khác nhau, để tạo ra cả chùm tia nhỏ có khoảng cách hẹp và khoảng cách rộng hơn. Sau đó, họ tính toán phân bố liều cho bốn trường hợp bệnh nhân, đối với liệu pháp pMBRT, SRT và proton thông thường.
Trong các kế hoạch pMBRT có khoảng cách hẹp, tạo ra sự phân bố liều đồng đều trong thể tích mục tiêu, mức độ bao phủ khối u tương tự hoặc tốt hơn một chút so với các kế hoạch SRT. Các kế hoạch sử dụng các chùm pMBRT có khoảng cách rộng hơn, mang lại sự phân bố liều gần như đồng đều cho mục tiêu, có phạm vi bao phủ khối u thấp hơn.
Điều quan trọng là pMBRT đã giảm đáng kể liều lượng đối với các cấu trúc quan trọng so với SRT. Trong trường hợp não đầu tiên, pMBRT đã giảm BED trung bình xuống các cơ quan có nguy cơ (OAR) từ 44% (dây thần kinh thính giác bên phải) đến 100% (dây thần kinh thính giác bên trái). Trong lần điều trị não thứ hai, pMBRT đã loại bỏ hoàn toàn các OAR, bao gồm đường thị giác, thân não và giao thoa.
Trong trường hợp gan, BED trung bình đối với gan và xương sườn đã giảm lần lượt là 25% và 75%, đồng thời tránh được sự chiếu xạ của tĩnh mạch chủ trên. Và đối với trường hợp phổi, liều đối với OAR đã giảm từ 11% (xương sườn) đến 100% (động mạch phổi và phế quản). Giá trị BED trung bình đối với OAR gần như giống nhau giữa pMBRT và liệu pháp proton thông thường.
Các nhà nghiên cứu cũng điều tra các tác dụng phụ có thể có của pMBRT đối với các mô bình thường. Ví dụ, đối với hai trường hợp di căn não, họ đã tính toán liều lượng đưa đến mô não khỏe mạnh. Họ đã xem xét các giới hạn liều đối với chiếu xạ phân đoạn tiêu chuẩn, trong đó tổng liều chuẩn hóa ở 2 phân số Gy (NTD2.0) của 72 Gy dẫn đến xác suất hoại tử vô tuyến là 5% trong vòng năm năm.
Đối với tất cả các gói pMBRT, NTD thung lũng tối đa2.0 đối với bộ não khỏe mạnh (61 Gy(RBE) đối với trường hợp thùy thái dương và 47 Gy(RBE) đối với trường hợp thùy trán) vẫn ở dưới ngưỡng dung nạp liều này, trái ngược với liệu pháp proton thông thường. Đối với bệnh nhân di căn phổi và gan, liều trung bình đối với mô phổi và gan trong kế hoạch pMBRT cũng thấp hơn nhiều so với liều trung bình tối đa có thể dung nạp được.
Lợi ích lâm sàng
Các phương pháp điều trị pMBRT được xem xét trong nghiên cứu này được phân phối chỉ bằng một hoặc hai mảng chùm tia nhỏ. Việc sử dụng ít trường hơn so với phương pháp điều trị SRT (ba hoặc bốn vòng cung) đòi hỏi ít bệnh nhân phải di chuyển lại vị trí hơn, giảm thời gian điều trị một phần, cũng như giảm thể tích mô bình thường tiếp xúc với liều lượng thấp. Ngoài ra, việc cung cấp pMBRT trong một phần điều trị giúp giảm đáng kể tổng thời gian điều trị so với các kế hoạch SRT, sử dụng ba đến năm phần.

Xạ trị chùm tia nhỏ: từ photon đến hạt tích điện
Các nhà nghiên cứu chỉ ra rằng các kế hoạch pMBRT được đánh giá trong công trình này có thể được chuyển giao lâm sàng bằng cách sử dụng thiết lập đã được triển khai tại Trung tâm Trị liệu Proton Orsay cho các thử nghiệm tiền lâm sàng, với chuyển động của mục tiêu và cơ quan trong quá trình điều trị được kiểm soát như trong liệu pháp SRT và proton.
Ortiz kể Thế giới vật lý rằng Viện Curie hiện đang thảo luận về khả năng thử nghiệm lâm sàng Giai đoạn I/II. Ông giải thích: “Những điều này sẽ đánh giá mức độ nhiễm độc thần kinh và tỷ lệ kiểm soát khối u trong điều trị u nguyên bào thần kinh đệm đa dạng tái phát bằng các chùm tia nhỏ proton. “Nghiên cứu này nhằm mục đích đóng góp vào việc chuẩn bị cho những cuộc điều tra lâm sàng đó.”
- Phân phối nội dung và PR được hỗ trợ bởi SEO. Được khuếch đại ngay hôm nay.
- Platoblockchain. Web3 Metaverse Intelligence. Khuếch đại kiến thức. Truy cập Tại đây.
- nguồn: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Trợ Lý Giám Đốc
- Ngoài ra
- bất lợi
- Mục tiêu
- Tất cả
- Đã
- và
- động vật
- Mảng
- tránh
- sau
- phía dưới
- Lợi ích
- Hơn
- giữa
- Brain
- thau
- Ung thư
- trường hợp
- trường hợp
- Trung tâm
- tính phí
- Lâm sàng
- các thử nghiệm lâm sàng
- đồng nghiệp
- Cột
- thông thường
- so
- hoàn toàn
- Tính
- xem xét
- Ngược lại
- Góp phần
- điều khiển
- kiểm soát
- thông thường
- có thể
- bảo hiểm
- tạo
- quan trọng
- trường hợp tử vong
- cung cấp
- giao
- phân phối
- Độ sâu
- phá hủy
- Xác định
- thảo luận
- Bệnh
- phân phối
- Phân phối
- miền
- đột ngột
- suốt trong
- hiệu ứng
- mới nổi
- khuyến khích
- Tương đương
- đánh giá
- đánh giá
- ví dụ
- Giải thích
- tiếp xúc
- Lĩnh vực
- Tên
- phân số
- Francisco
- từ
- Thu được
- dần dần
- lớn hơn
- Một nửa
- có hại
- khỏe mạnh
- HTTPS
- ý tưởng
- hình ảnh
- thực hiện
- nâng cao
- in
- Mặt khác
- Bao gồm
- chỉ số
- thông tin
- Điều tra
- vấn đề
- chỉ một
- Dẫn
- Hạn chế
- giới hạn
- Gan
- địa phương
- Thấp
- max-width
- tối đa
- giảm thiểu
- chuyển động
- Thiên nhiên
- bình thường
- ONE
- mở
- Nền tảng khác
- nêu
- bệnh nhân
- bệnh nhân
- Họa tiết
- giai đoạn
- Photon
- lập kế hoạch
- kế hoạch
- plato
- Thông tin dữ liệu Plato
- PlatoDữ liệu
- Điểm
- khả năng
- có thể
- trước đây
- xác suất
- hứa hẹn
- Bức xạ
- Xạ trị
- Giá
- nhận
- giảm
- Giảm
- làm giảm
- giảm
- vẫn
- đáng chú ý
- Báo cáo
- cần phải
- đòi hỏi
- nhà nghiên cứu
- tương ứng
- Kết quả
- Nguy cơ
- tương tự
- San
- San Francisco
- nói
- Thứ hai
- không sâu
- thể hiện
- đáng kể
- tương tự
- nhỏ
- Tiêu chuẩn
- nghiên cứu
- Học tập
- như vậy
- cao
- Mục tiêu
- nhóm
- kỹ thuật
- nói
- Sản phẩm
- cung cấp their dịch
- Trị liệu
- điều trị
- số ba
- ngưỡng
- thumbnail
- thời gian
- mô
- đến
- khoan dung
- Tổng số:
- Dịch
- điều trị
- điều trị
- thử nghiệm
- đúng
- sử dụng
- thung lũng
- khác nhau
- khối lượng
- khối lượng
- liệu
- cái nào
- trong khi
- CHÚNG TÔI LÀ
- ở trong
- Công việc
- sẽ
- năm
- zephyrnet