NMPA publiserte det endelige dokumentet «Guideline on Medical Device Real-world Study Design and Statistical Analysis» 15. januar 2024. Utkastet ble utgitt 28. september 2023.
Retningslinjens betydning
Retningslinjen vil gjøre det lettere for utenlandske produsenter å utforske pilotprogrammet Hainan Real-world Data ytterligere.
Hainan Boao Pilot Zone tillater bruk av utenlandsk ikke-godkjent medisinsk utstyr, IVDer, medikamenter med klinisk hastestatus i Kina. Mens de kommersialiserer og selger produktene sine, kan produsenter samle inn RWD gjennom RWS i Hainan som lokale kliniske bevis i Kina for å støtte deres nasjonale NMPA-registreringsgodkjenning. Spesialprogrammet kan begrense deres markedsadgang til Kina til 4 måneder.
Hainan-regjeringen ga ut "Forskrifter om administrering av hastebruk importerte legemidler og medisinsk utstyr i Boao Lecheng International Medical Tourism Pilot Zone i Hainan Free Trade Port” den 28. mars 2023. Dokumentet sier at Det krever IKKE lokal typetesting eller betydelig bevisbyrde som nasjonal godkjenning.
Høydepunkter i retningslinjen
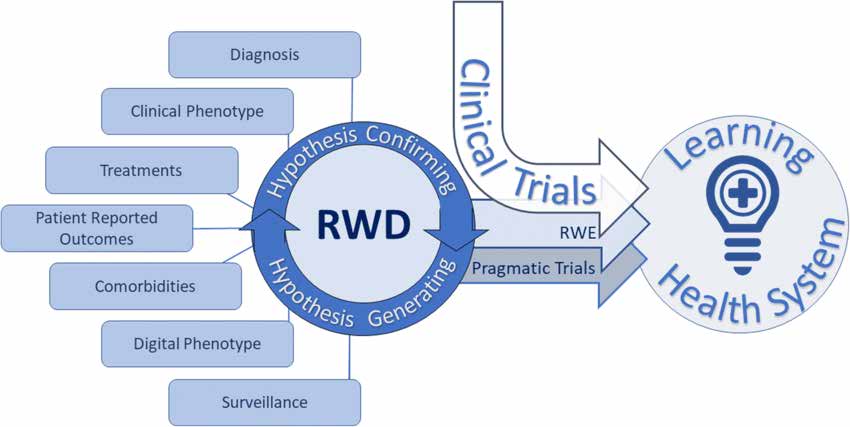
Dokumentet om studiedesign og statistisk analyse beskriver ulike typer forskning i den virkelige verden som følger:
Pragmatiske randomiserte kontrollerte studier (pRCTs) er designet for å vurdere behandlingsresultater i ekte helsevesen. De bruker randomiserings- og kontrollgrupper for å evaluere intervensjonseffektiviteten. PRCT-ene gir høykvalitets bevis fra den virkelige verden og er egnet for ulike pasientpopulasjoner og kliniske scenarier.
Observational Real-World Research inkluderer ulike studiedesign:
- Beskrivende studiedesign beskrive pasientkarakteristikker eller helsetilstander uten å utlede årsakssammenheng.
- Kohortdesign spore utfall i ulike pasientgrupper basert på enhetsbruk, med prospektive og retrospektive alternativer.
- Case-Control og avledede design sammenligne pasienter med og uten bruk av utstyr og inkludere nestede case-kontroll- og case-kohortstudier.
- Real-World Data som eksterne kontroller involvere bruk av virkelige data som en kontrollgruppe, selv om detaljerte retningslinjer mangler.
Dokumentet skisserer hensyn for utforming av virkelige forskningsprotokoller:
- Bakgrunn og mål: Definer forskningsbakgrunn, mål og sikkerhets- og effektivitetsspørsmål basert på eksisterende data.
- Mulighetsvurdering: Evaluer muligheten for å gjennomføre forskning i den virkelige verden, med tanke på datatilgjengelighet, kvalitet og forvirrende variabler.
- Velg passende forskningsdesign: Velg design basert på mål, enten det er eksperimentelt eller observasjonsmessig.
- Studer flytskjema: Lag et flytskjema som beskriver studieprosessen, inkludert pasientvalg, intervensjoner og undersøkelser.
- Definer studiepopulasjon: Definer tydelig inklusjons- og eksklusjonskriterier for studiepopulasjonen.
- Enhetseksponering: Vurder hvordan pasienter blir eksponert for enheten, med tanke på potensielle skjevheter.
- Kontrollgruppe: Bestem passende kontrollgrupper for observasjonsstudier for å balansere forvirrende variabler.
- Utfallsmål: Definer utfallsmål, inkludert deres formål, definisjon og målemetoder.
- Datainnsamling: Utvikle datainnsamlingsskjemaer og ordbøker, spesifisere datakilder, kvalitetsinformasjon og koblingsmetoder.
- Justering for konfunderende variabels: Identifiser forstyrrende variabler og inkluderer/ekskluder dem med grunner.
- Oppfølgingstid: Definer pasientoppfølgings- eller observasjonstider for å svare på forskningsspørsmål adekvat.
- Prøvestørrelse og kraftberegning: Beregn utvalgsstørrelse og statistisk styrke, med tanke på ulike faktorer.
Det understreker også viktigheten av kvalitetskontroll:
- Datakvalitet: Evaluer datakvaliteten med tanke på representativitet, fullstendighet, nøyaktighet og mer.
- Bias Risiko: Beskriv tiltak for å kontrollere skjevhetsrisiko på ulike stadier, inkludert utvalg, informasjon og forvirrende skjevhet.
- Vurdering av skjevhet: Gjenkjenne ulike typer skjevheter og vurdere deres retning og størrelse.
- Etisk gjennomgang: Sørg for at etiske vurderinger og informert samtykke er i samsvar med regelverket.
Sammenligning av to versjoner
Sammenlignet med utkastversjonen, nevner det endelige dokumentet "Fasting av konfunderende variabler som trenger modifikasjon" i delen Statistisk analyse.
I ikke-randomiserte virkelige forskningsdesign er identifisering av forvirrende variabler avgjørende for å kontrollere skjevhet. Tre kriterier brukes for å identifisere dem: en variabel har en årsakssammenheng med utfallet, er assosiert med grupperingsvariabelen (eksponering), og er ikke en mellomvariabel i årsaksbanen. En anbefalt tilnærming innebærer en rasjonell variabel seleksjonsprosess basert på faglig kunnskap og klinisk erfaring, med samarbeid med kliniske og statistiske eksperter. For usikre variabler foreslås sensitivitetsanalyse, som gir grunner og støtter data for inkludering/ekskludering. En konservativ tilnærming til valg av variabler anbefales, unngå urelaterte variabler og vurdere problemer som multikollinearitet og interaksjonseffekter, visualisert gjennom Directed Acyclic Graphs (DAGs).
Send en e-post for en engelsk kopi av retningslinjen info@ChinaMedDvice.com. Vi krever nominelle avgifter for oversettelsen.
Vis siste nytt på Hainan Real World Data-programmet.
Vis kommunikasjonsretningslinje samarbeide med regulerende myndigheter.
Se vår innspilt webinar om Hainan-politikk.
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://chinameddevice.com/real-world-study-nmpa/
- : har
- :er
- :ikke
- 15%
- 2023
- 2024
- 28
- a
- adgang
- nøyaktighet
- asyklisk
- tilstrekkelig
- administrasjon
- rådes
- tillater
- også
- an
- analyse
- og
- besvare
- tilnærming
- hensiktsmessig
- godkjenning
- ER
- AS
- vurdere
- assosiert
- At
- Myndigheter
- tilgjengelighet
- unngå
- bakgrunn
- Balansere
- basert
- BE
- Bias
- skjevheter
- byrde
- beregne
- CAN
- egenskaper
- kostnad
- Kina
- Velg
- klart
- Klinisk
- samarbeid
- samle
- samling
- COM
- overholde
- forhold
- gjennomføre
- samtykke
- konservativ
- betraktninger
- vurderer
- kontroll
- kontrolleres
- kontrollerende
- kontroller
- skape
- kriterier
- avgjørende
- dato
- datakvalitet
- definere
- definisjon
- Avledet
- beskrive
- beskriver
- utforming
- designet
- utforme
- design
- detaljert
- detaljering
- Bestem
- utvikle
- enhet
- Enheter
- forskjellig
- regissert
- retning
- diverse
- dokument
- gjør
- Utkast
- Narkotika
- effektivitet
- effekter
- emalje
- legger vekt på
- Engelsk
- sikre
- etisk
- evaluere
- bevis
- eksisterende
- erfaring
- eksperimentell
- eksperter
- utforske
- utsatt
- Eksponering
- utvendig
- legge til rette
- faktorer
- gjennomførbarhet
- avgifter
- slutt~~POS=TRUNC
- avsluttet
- etter
- Til
- skjemaer
- Gratis
- videre
- Regjeringen
- grafer
- Gruppe
- Gruppens
- retningslinjer
- Helse
- helsetjenester
- høykvalitets
- Hvordan
- HTTPS
- identifisere
- identifisering
- betydning
- in
- inkludere
- inkluderer
- Inkludert
- inkludering
- informasjon
- informert
- interaksjon
- Mellom
- internasjonalt
- intervensjon
- intervensjoner
- innebærer
- saker
- IT
- Januar
- jpg
- kunnskap
- mangler
- leder
- i likhet med
- lokal
- Produsenter
- Mars
- marked
- måling
- målinger
- medisinsk
- medisinsk enhet
- medisinsk utstyr
- nevner
- metoder
- kunne
- måneder
- mer
- nasjonal
- Trenger
- mål
- observasjon
- observasjons
- of
- on
- alternativer
- or
- vår
- Utfallet
- utfall
- skisserer
- utenlands
- banen
- pasient
- pasienter
- pilot
- plato
- Platon Data Intelligence
- PlatonData
- vær så snill
- Politikk
- befolkningen
- populasjoner
- potensiell
- makt
- prosess
- Produkter
- profesjonell
- program
- bevis
- prospektive
- protokoller
- gi
- gi
- publisert
- formål
- kvalitet
- spørsmål
- randomisert
- Rasjonell
- ekte
- virkelige verden
- grunner
- anbefales
- Registrering
- forskrifter
- regulatorer
- forholdet
- utgitt
- krever
- forskning
- Anmeldelser
- risikoer
- Sikkerhet
- sier
- scenarier
- Seksjon
- utvalg
- Å Sell
- Følsomhet
- September
- innstillinger
- signifikant
- Størrelse
- Kilder
- spesiell
- stadier
- statistisk
- status
- studier
- Studer
- egnet
- støtte
- Støtte
- vilkår
- Testing
- Det
- De
- deres
- Dem
- de
- selv om?
- tre
- Gjennom
- ganger
- til
- Turisme
- spor
- handel
- Oversettelse
- behandling
- forsøk
- to
- typen
- typer
- Usikker
- hastverk
- som haster
- bruke
- brukt
- ved hjelp av
- variabel
- ulike
- versjon
- var
- we
- om
- mens
- vil
- med
- uten
- arbeid
- verden
- zephyrnet