除非另有说明,所有试剂均按收到时的原样使用。除计数珠(CountBright 绝对计数珠,Invitrogen)外,所有化学品均购自 Sigma Aldrich。 ζ-使用 Zetasizer NanoZS90 (Malvern Instruments) 测量电势。在配备集成 EDS 的 JEOL JSM 7800F Prime 显微镜中通过 SEM 研究颗粒的尺寸和形态,以提供元素分析。通过测量 50 个独立颗粒来确定颗粒尺寸。无线电瞬时薄层色谱 (ITLC) 是在浸有硅酸的 Agilent Technologies 玻璃微纤维色谱纸上开发的,并使用 Lablogic Flow-count TLC 扫描仪和 BioScan B-FC-3200 光电倍增管 (PMT) 检测器以及 Laura 软件进行分析。除非另有说明,ITLC 流动相由 0.175 M 柠檬酸和 0.325 M 柠檬酸三钠水溶液组成。使用 Capintec CRC-25R (Capintec) 或 LKB Wallac 1282 Compugamma CS (PerkinElmer) 测量放射性样品,并使用 EdenTerm 软件收集数据。使用 BD FACSChorus 软件在 BD FACSMelody 细胞分选仪中进行流式细胞术实验。使用 NanoPET/CT 扫描仪 (Mediso) 采集 PET/CT 图像,使用 Nucline v.0.21 软件重建,并使用 VivoQuant 软件(版本 3.5,InviCRO)分析图像。 Listmode数据是通过Mediso开发的特定MATLAB软件工具获得的。放射自显影是在 GE Amersham Typhoon 仪器上进行的。
亚微米二氧化硅颗粒的合成
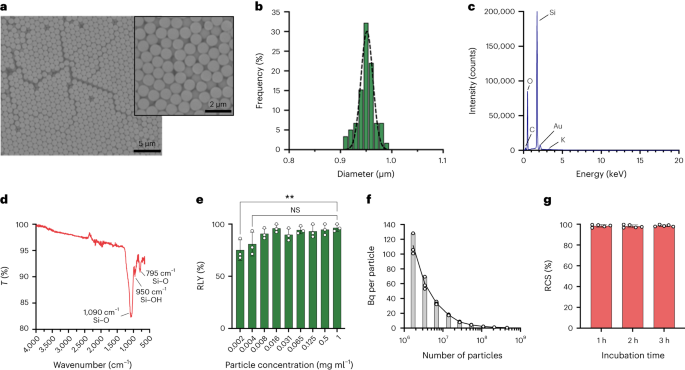
使用 Stöber 方法合成颗粒。该方法基于硅醇盐的水解和连续缩合,产生单分散的球形二氧化硅颗粒27。原硅酸四乙酯(TEOS)作为硅源,氨作为碱催化剂,氯化钾作为电解质。将TEOS的乙醇溶液连续添加到含有催化剂和电解质的溶液中。试剂起始量或添加速率的修改会导致颗粒尺寸的差异,如先前报道的那样28。这里,在合成颗粒之前制备了两种溶液:溶液 1 含有 19.0ml EtOH 中的 33.3mmol TEOS,溶液 2 含有 0.23ml 氨、9ml EtOH 和 65ml H6.75 中的 XNUMXmmol KCl2O.为了合成,将溶液2置于250ml圆底烧瓶中,在50rpm搅拌下于300℃加热15分钟。然后,将溶液1滴加到溶液2中(供给速度0.2ml分钟 - 1)。添加溶液1后,通过18,300离心纯化所得颗粒g 3分钟并用EtOH洗涤XNUMX次。最后,二氧化硅2 将微粒在真空下干燥。
用硅烷-PEG 接枝亚微米尺寸的颗粒5k
20 mg ml - 1 硅烷-PEG溶液5k (Sigma Aldrich) 的 98% EtOH 溶液以 5mg/ml 添加到 smSiP 溶液中 - 1 溶于 98% 的乙醇和 2.8% 的氨水中。将混合物在室温下搅拌过夜,并通过在18,300℃下离心回收颗粒。g 3分钟。最后,用蒸馏水洗涤颗粒XNUMX次,并真空干燥过夜。将洗涤溶液冷冻干燥过夜,并测定未连接的硅烷-PEG 的量。5k 加权计算反应产率。 A 0.05 mg ml - 1 smSiP-PEG 溶液5k 在蒸馏水中用于进一步的放射性标记反应。
[68镓]氯化镓3
Gallium-68 被洗脱为 [68镓]氯化镓3 来自埃克特和齐格勒 68锗/68超纯 HCl(4ml,0.1M)中的 Ga 发生器按照良好生产规范要求 (ABX) 制造。
[的浓度68镓]氯化镓3 阳离子交换洗脱
使用补充图1中描述的设置进行洗脱浓缩。 1。首先,4 ml的[68镓]氯化镓3 将洗脱液加载到 Strata-X-C 33u 柱(Phenomenex)上并丢弃洗脱液。然后,用5ml丙酮/0.1M HCl(80:20)溶液洗涤柱并弃去洗出液。最后,浓缩[68镓]氯化镓3 加入 700μl 丙酮/0.05M HCl (98:2) 溶液收集,在 NXNUMX 下干燥2 流并重悬于 50μl 0.5 M HEPES 缓冲液(pH 4.9)中。在不同阶段进行放射薄层色谱以进行质量控制。该方案大约需要 20 分钟,回收率为 86.2±8.5%。
不同浓度二氧化硅颗粒的放射性标记 68Ga
将二氧化硅颗粒以不同浓度(从 1 到 0.002mg ml - 1)在 0.5 M HEPES 缓冲液(pH 4.9)中。然后,将50μl溶液加入到反应管中,然后加入浓缩的[68镓]氯化镓3 在 50 μl 0.5 M HEPES 缓冲液 (pH 4.9) 中洗脱。反应在90℃下进行30分钟,并进行放射TLC以计算放射化学产率。
通过流式细胞术测量颗粒浓度
按照制造商的说明,使用计数珠(CountBright 绝对计数珠,Invitrogen)通过流式细胞术计算颗粒浓度。将二氧化硅颗粒重悬于 0.05mgml - 1,超声处理 10 分钟并通过 10μm 截止尺寸过滤器(KX 注射式过滤器,尼龙,25mm,10μm)。将 CountBright 绝对计数珠加热至室温并涡旋 30 秒。然后,将50μl珠加入到300μl二氧化硅颗粒中,并将混合物涡旋30分钟以获得均匀溶液。样品在流式细胞仪上运行,前向散射 (FSC) 阈值设置为包括线性 FSC 与线性侧散点图上的珠子和颗粒。然后,针对计数珠调整荧光检测器电压,并执行门控策略以分离二氧化硅颗粒和计数珠群体。最后,绘制颗粒上的门和绝对计数珠,并为每个样品记录 1,000 个珠事件。使用该策略,使用以下方程计算溶液中的颗粒数量:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{粒子}}{{{upmu l}}}right)=displaystylefrac{({mathrm{粒子}},{mathrm{计数}},次,{mathrm{计数}},{mathrm{珠子}},{mathrm{体积}})}{({mathrm{计数}},{mathrm{珠子}} ,{mathrm{计数}},次,{mathrm{粒子}},{mathrm{体积}})}次,{mathrm{计数}},{mathrm{珠子}},{mathrm{浓度}}左(frac {{mathrm{珠子}}}{{{upmu l}}}右)end{数组}$$
500 smSiP 的放射性标记
将 50 个 smSiP 添加到 XNUMXμl 浓缩的 [68镓]氯化镓3 在 0.5 M HEPES 缓冲液 pH 4.9 中洗脱。然后,加入5.6μl聚山梨醇酯80,并将混合物在热混合器中以90rpm在30℃下加热900分钟。之后,设计了最终的多步纯化方案以去除未反应的/胶体 68Ga.加入10微升5mM EDTA,并将混合物在室温下温育3分钟。然后,将颗粒在 18,300 下离心 XNUMX 分钟g,重悬于 500μl 含有 1 mM EDTA + 0.1% 聚山梨酯 80 的 PBS 中,轻轻涡旋 10 秒。再次离心颗粒,用0.1mM EDTA + 0.1%聚山梨酯80的PBS溶液洗涤,并轻轻涡旋10秒。最后,将颗粒离心并用PBS+0.1%聚山梨醇酯80再洗涤五次,并重悬于500μl PBS中。在连续反应步骤中通过放射性 TLC 监测放射性标记反应,以评估胶体的存在(如果未正确去除,胶体可能与颗粒混淆)、颗粒的放射性标记和最终产品的纯度。通过比较洗涤步骤后颗粒和上清液中的放射性量来计算 RLY。
分馏
对于分馏策略,体积从 0.5 μl 到 20 μl 68Ga-smSiP 理论浓度为 1 个粒子 μl - 1 以 1μl 的步长(0.5、1、2、3…)添加到不同的样品管中,并添加 PBS 使最终体积达到 50μl。然后,将第一个管中的 37.5μl 移入第二个样品管中,将第二个管中的 25μl 移入第三个管中,最后将第三个管中的 12.5μl 移入第四个管中。该策略为每个样品提供四个试管,每个试管的最终体积为 12.5 µl。在伽马计数器中测量每个管中的放射性,并使用校准曲线以 kBq 为单位计算值,以供进一步比较和分析。仅在一根管中含有大部分放射性的样品在室温下超声处理 30 秒,然后进行第二次分级步骤。然后,将在单个管中发现所有放射性的样品(其他三个管中的活性可忽略不计)用于进一步的体内/离体实验。
PET/CT 体模成像
进行了一项幻影成像实验 68Ga-smSiP。使用插管将颗粒输送到样品管中,以评估在给药过程中单个颗粒是否可以保留在插管中。简而言之,将模型管放入 nanoPET/CT 扫描仪中,并将插管尖端的末端连接到管上。开始 PET 采集后,用连接到插管起始端的胰岛素注射器输送重悬于 100μl PBS 中的颗粒。然后,用50μl PBS清洗插管以确保将颗粒输送到模型管中。 PET 采集进行 2 小时,然后进行标准 CT 扫描。
体内 PET/CT 成像
动物成像研究经过伦理审查,并按照英国内政部 1986 年动物(科学程序)法案 (ASPA) 管理动物实验的规定进行。在健康的 8 周龄 BALB/c 小鼠中进行体内成像。动物用异氟烷(氧气中 2-3%)麻醉,插管并放在麻醉下的扫描床上。通过内部气流将床加热至37°C,使动物保持正常体温,并监测呼吸频率并维持在60-80次呼吸/分钟 - 1 整个扫描过程中。保持对动物温度的控制很重要,因为温度的意外下降可能会导致血液中颗粒速度的降低。一 68Ga-smSiP(n = 4) 或 68Ga-smSiP-PEG5k 粒子(n = 2)通过插管施用100μl PBS,然后在开始PET采集后用50μl PBS洗涤(1:5符合模式;5ns符合时间窗口)。 PET记录2小时,然后进行半圆形CT扫描。整个过程中监测动物体温和呼吸频率。使用 Tera-Tomo 3D 重建(400–600 keV 能量窗口,1:5 符合模式,20 次迭代和 1 个子集)以 0.4 × 0.4 × 0.4 mm 的体素尺寸重建动态 PET/CT 图像3 并校正衰减、散射和衰减。所有 PET/PEPT 采集的列表模式数据可以在以下位置找到: 68Ga-smSiP 参考号 29 和为 68Ga-smSiP-PEG5k 在参考号。 30.
实时跟踪
首先,数据以列表模式格式(即带有检测到的重合光子的时间戳和晶体索引的格式)从扫描仪导出。应用几何变换将晶体指数转换为以毫米为单位的位置。伯明翰方法根据所有 LoR 的子集迭代计算 MDP。它通过丢弃距 MDP 超过设定距离的 LoR 来实现此目的,因为这些 LoR 可能源自错误的 LoR,例如可能源自分散的 LoR。 MDP 在每次迭代中都会得到完善;迭代次数由以下有效设置 f-因子,与 LoR 总数相关,用于估计该子集中的最终粒子位置(例如, f-因子为 0.5 意味着当子集中剩余 50% 的 LoR 时迭代循环将终止)。可以减少子集中使用的 LoR 数量以改善时间采样(子集是时间连续的,没有重叠),但代价是增加位置的不确定性(该算法的更多细节可以在 Parker 等人的论文中找到)。5) 伯明翰方法用于分析来自 PET 扫描仪的列表模式数据。使用自适应样本量来追踪小鼠体内的粒子。样本大小的设置是为了实现足够的时间采样和最小化定位误差的平衡。在扫描的早期阶段使用 100 到 200 LoR 之间的样本量(从扫描开始开始 <60 秒),其中 f = 0.1,产生大约 1–5 s 的间隔。在扫描时间 > 60 秒时,样本大小在 1,000 到 2,000 之间变化,根据体内实验,产生的时间间隔在 30 秒到 60 秒之间。用于计算 MDP(在最终迭代中)的计数数量可以通过将样本大小乘以 f-因子值。这些参数基于之前的经验并参考之前的出版物1.
速度获得为 (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) 哪里 ({v}_{m}^{2}) 是速度 x, y 和 z 方向。
离体器官摄取
通过伽玛计数评估不同器官的摄取。体内 PET/CT 成像后,通过颈脱位处死动物,切除器官并称重,在伽马计数器 (LKB Wallac 1282 Compugamma CS) 中进行放射性计数。数据表示为每克组织注射剂量的百分比(器官中的剂量/注射的总剂量)(%ID g - 1).
放射自显影
用辐射探测器(EP15探针,Morgan)追踪肺部的放射性,并用手术刀将肺部切成小切片,直到获得一小部分具有放射性信号的组织。将组织速冻在-80℃异丙醇中。冷冻后立即将组织包埋在最佳切割温度介质中,并在低温恒温器中切割成 20μm 的切片。用探测器对每个切片进行测量,直到发现放射性切片。将前一个(低于背景)、放射性和下一个(低于背景)切片放置在 Superfrost 显微镜载玻片(Epredia)上。其余组织也低于背景。将具有三个切片的显微镜载玻片用保鲜膜覆盖并与GE放射自显影板相对过夜。使用 GE Amersham Typhoon 分析板,分辨率为 25 µm,PMT 设置为 4,000。放射自显影图像叠加在组织图像上,显示放射性切片中的一个放射性点。为了进行定量,在不同的已知活性中制备标准品,并将每个标准品在纸上点样为 1 µl 五重体。将斑点在相同的存储荧光屏、来自 GE 的 BAS-IP MS(多用途标准)中孵育,同时对单个颗粒进行定量。该图像是使用 Amersham Typhoon 5 和控制软件 2.0 版在磷光体模式下采集的,像素大小为 100 µm,灵敏度为 4,000。使用凝胶定量工具箱通过软件 ImageQantTL v10.0-261 对图像进行定量。通过选择紧邻该点之前或之后的区域作为恒定背景来校正该点。所得点的体积用于根据校准曲线计算颗粒中的 Bq。
统计和再现性
对于定量分析,至少分析了三个生物重复,不包括体内数据 68Ga-smSiP-PEG5k (n = 2)。数据通过普通单因素方差分析 (ANOVA) 以及 Dunnett 多重比较检验和 Student 检验进行分析 t-测试。 A P 值<0.05被认为具有统计显着性。
- :是
- :不是
- :在哪里
- ][p
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- 绝对
- 按照
- 后天
- 获得
- 收购
- 法案
- 活动
- 活动
- 自适应
- 添加
- 添加
- 增加
- 调整
- 管理
- 管理
- 进步
- 后
- 之后
- 再次
- 加拿大航空
- AL
- 算法
- 所有类型
- 还
- 氨
- 量
- an
- 分析
- 分析
- 锚
- 和
- 动物
- 动物
- 应用的
- 约
- 保健
- 出现
- AS
- At
- b
- 背景
- 当前余额
- 基地
- 基于
- 基础
- BD
- BE
- before
- 开始
- 如下。
- 之间
- 伯明翰
- 血液
- 身体
- 简要地
- 带来
- 缓冲
- by
- 计算
- 计算
- 计算
- 计算
- CAN
- 进行
- 催化剂
- 细胞
- 化学制品
- 选择
- 点击
- 巧合
- 对照
- 比较
- 由
- 集中
- 浓度
- 进行
- 困惑
- 连续
- 考虑
- 常数
- 一直
- 控制
- 受控
- 兑换
- 更正
- 价格
- 可以
- Counter
- 计数
- 覆盖
- 水晶
- cs
- 曲线
- 切
- 切割
- data
- 交付
- 提升
- 交货
- 根据
- 描述
- 设计
- 详情
- 检测
- 决心
- 发达
- 差异
- 不同
- 方向
- 错位
- 距离
- 不
- 剂量
- 画
- 下降
- ,我们将参加
- 动态
- e
- Ë&T
- 每
- 早
- 只
- 电解质
- 嵌入式
- 发射
- 就业
- 结束
- 能源
- 工程师
- 确保
- 设备
- 故障
- 评估
- 醚(ETH)
- 评估
- 评估
- 事件
- 例子
- 除
- 排除
- 体验
- 实验
- 实验
- 表示
- false
- 无花果
- 电影
- 过滤
- 最后
- 终于
- (名字)
- 五
- 流
- 其次
- 以下
- 针对
- 格式
- 向前
- 发现
- 四
- 第四
- 冷冻保存
- 止
- 冻结
- FSC
- 进一步
- 盖茨
- ge
- 发电机
- 玻璃
- 非常好
- 治理
- 克
- 事业发展
- 健康
- 相关信息
- 主页
- 在家办公
- HTTPS
- if
- 图片
- 图片
- 同步成像
- 立即
- 重要
- 改善
- in
- 包括
- 增加
- 孵化
- 独立
- 指数
- 指数
- 通知
- 即食类
- 说明
- 仪器
- 文书
- 集成
- 接口
- 内部
- 成
- IT
- 迭代
- 迭代
- 保持
- 已知
- Kx
- 铅
- 容易
- 友情链接
- 肺
- 维持
- 制成的
- 制造业
- 材料
- 可能..
- 手段
- 测量
- 测量
- 中等
- 方法
- 方法
- 小鼠
- 微米
- 显微镜
- 分钟
- 最小化
- 最低限度
- 混频器
- 混合物
- ML
- 联络号码
- 时尚
- 监控
- 更多
- 摩根
- 最先进的
- MS
- 多
- 倍增
- 纳米技术
- 自然
- 下页
- 没有
- 正常
- 数
- 获得
- 获得
- of
- 办公
- on
- 一
- 仅由
- 反对
- 最佳
- or
- 普通
- 其他名称
- 除此以外
- 输出
- 超过
- 过夜
- 氧
- 纸类
- 参数
- 粒子
- 通过
- PBS
- 为
- 百分比
- 执行
- 宠物
- 模体
- 相
- 光子
- 图片
- 像素
- 放置
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 人群
- 一部分
- 位置
- 定位
- 正电子
- 在练习上
- 准备
- 存在
- 以前
- 先前
- 总理
- 先
- 探测器
- 程序
- 过程
- 生产
- 产品
- 正确
- 协议
- 提供
- 提供
- 优
- 购买
- 质量
- 量化
- 量
- 数量
- R
- 辐射
- 广播电台
- 范围
- 率
- 反应
- 反应
- 实时的
- 收到
- 最近
- 记录
- 恢复
- 减少
- 减少
- 参考
- 精
- 地区
- 法规
- 涉及
- 留
- 其余
- 去掉
- 去除
- 重复
- 岗位要求
- 分辨率
- REST的
- 导致
- 检讨
- 审查
- Room
- 运行
- s
- 同
- 浏览
- 扫描
- 扫描
- SCI
- .
- 屏风
- 其次
- 秒
- 部分
- SEM
- 灵敏度
- 集
- 设置
- 格局
- 显示
- 西格玛
- 信号
- 显著
- 硅
- 单
- 尺寸
- 尺寸
- 切片
- 滑
- 小
- 捕捉
- 软件
- 方案,
- 解决方案
- 来源
- 具体的
- Spot
- 斑点
- 实习
- 标准
- 标准
- 开始
- 开始
- 说
- 统计学
- 步
- 步骤
- 存储
- 策略
- 流
- 研究
- 研究
- 留学
- 足够
- 供应
- 调查
- 合成
- 需要
- 技术
- 技术
- test
- 比
- 这
- 然后
- 理论
- 热
- 博曼
- 第三
- Free Introduction
- 三
- 门槛
- 通过
- 始终
- 次
- 时
- 时间戳
- 类型
- 组织
- 至
- 工具
- 工具箱
- 合计
- 跟踪时
- 跟踪
- 转型
- 被困
- 二
- Uk
- 不确定
- 下
- 意外
- 单位
- 直到
- 用过的
- 运用
- 真空
- 折扣值
- 价值观
- 速度
- 版本
- 与
- 体内
- 电压
- 体积
- 卷
- 体素
- W
- 是
- 洗涤
- 水
- 为
- ,尤其是
- 是否
- 这
- 而
- 全
- 将
- 窗口
- 中
- 产量
- 产生
- 生产
- 和风网
- 压缩