Усі реагенти були використані в тому вигляді, в якому вони були отримані, якщо не вказано інше. Усі хімічні речовини були придбані у Sigma Aldrich, за винятком рахункових кульок (CountBright Absolute Counting Beads, Invitrogen). ζ-Потенціал вимірювали за допомогою Zetasizer NanoZS90 (Malvern Instruments). Розмір і морфологію частинок вивчали за допомогою SEM в мікроскопі JEOL JSM 7800F Prime з вбудованим EDS для забезпечення елементного аналізу. Розмір частинок визначали шляхом вимірювання 50 незалежних частинок. Радіомиттєва тонкошарова хроматографія (ITLC) була розроблена на папері Agilent Technologies для скляної мікроволокнистої хроматографії, просоченому кремнієвою кислотою, і проаналізована за допомогою сканера Lablogic Flow-count TLC і фотодетектора BioScan B-FC-3200 (ФЕУ) з використанням програмного забезпечення Laura. Рухома фаза ITLC складалася з 0.175 М лимонної кислоти та 0.325 М тринатрійцитрату у воді, якщо не зазначено інше. Радіоактивні зразки вимірювали за допомогою Capintec CRC-25R (Capintec) або LKB Wallac 1282 Compugamma CS (PerkinElmer), дані для яких збирали за допомогою програмного забезпечення EdenTerm. Експерименти з проточною цитометрією проводили в сортувальнику клітин BD FACSMelody за допомогою програмного забезпечення BD FACSChorus. Зображення ПЕТ/КТ отримували за допомогою сканера NanoPET/CT (Mediso), реконструювали за допомогою програмного забезпечення Nucline v.0.21, а зображення аналізували за допомогою програмного забезпечення VivoQuant (версія 3.5, InviCRO). Дані Listmode були отримані спеціальним програмним інструментом MATLAB, розробленим Mediso. Авторадіографію проводили на приладі GE Amersham Typhoon.
Синтез частинок кремнезему субмікрометрового розміру
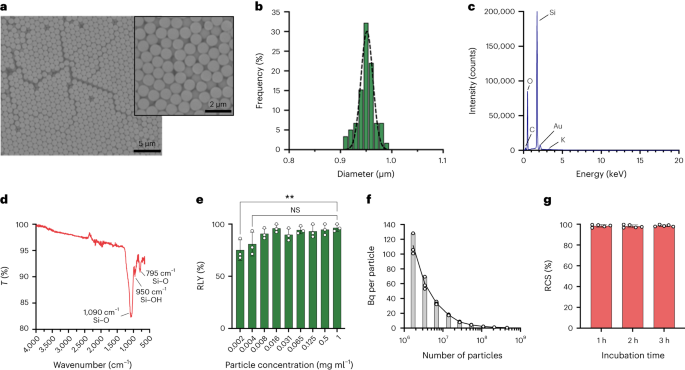
Частинки були синтезовані методом Штебера. Цей метод заснований на гідролізі та послідовній конденсації алкоксидів кремнію для отримання монодисперсних сферичних частинок кремнезему.27. Тетраетилортосилікат (TEOS) використовувався як джерело кремнію, аміак як основний каталізатор і хлорид калію як електроліт. До розчину, що містить каталізатор і електроліт, безперервно додавали розчин ТЕОС в етанолі. Модифікація початкової кількості реагенту або швидкості додавання забезпечує різницю в розмірі частинок, як повідомлялося раніше28. Тут перед синтезом частинок було приготовано два розчини: розчин 1, що містить 19.0 ммоль TEOS у 33.3 мл EtOH, і розчин 2, що містить 0.23 ммоль KCl у 9 мл аміаку, 65 мл EtOH та 6.75 мл H.2O. Для синтезу Розчин 2 поміщали в круглодонну колбу на 250 мл, нагріту при 50 °C при перемішуванні при 300 об/хв протягом 15 хв. Потім розчин 1 додавали по краплях до розчину 2 (швидкість подачі 0.2 мл хв-1). Після додавання розчину 1 отримані частинки очищали центрифугуванням при 18,300g протягом 3 хв і промивають EtOH п'ять разів. Нарешті, SiO2 мікрочастинки сушили під вакуумом.
Прищеплення частинок субмікрометрового розміру силаном-ПЕГ5k
А 20 мг мл-1 розчин силану–ПЕГ5k (Sigma Aldrich) в EtOH 98% додавали до розчину smSiP при 5 мг мл-1 в EtOH 98% і 2.8% аміаку. Суміш перемішували протягом ночі при кімнатній температурі, і частинки відновлювали центрифугуванням при 18,300°С.g протягом 3 хв. Нарешті, частинки тричі промивали дистильованою водою і сушили під вакуумом протягом ночі. Промивні розчини сушили заморожуванням протягом ночі, а кількість незв’язаного силану-ПЕГ5k зважений для розрахунку виходу реакції. А 0.05 мг мл-1 розчин smSiP–PEG5k у дистильованій воді використовували для подальших реакцій радіомічення.
[68Ga]GaCl3
Галій-68 елюювався як [68Ga]GaCl3 від Екерта і Ціглера 68Ge/68Генератор Ga у надчистій HCl (4 мл, 0.1 М), виготовлений відповідно до вимог належної виробничої практики (ABX).
Концентрація [68Ga]GaCl3 елюція катіонним обміном
Концентрацію елюювання проводили за допомогою установки, описаної на Додатковій рис. 1. Спочатку 4 мл [68Ga]GaCl3 елюент завантажували на картридж Strata-XC 33u (Phenomenex), а елюат викидали. Потім картридж промивали 5 мл розчину ацетон/0.1 М HCl (80:20) і елюат відкидали. Нарешті, концентрований [68Ga]GaCl3 збирали шляхом додавання 700 мкл розчину ацетон/0.05 М HCl (98:2), сушили під N.2 потоку та ресуспендують у 50 мкл 0.5 М буфера HEPES (pH 4.9). Радіо-ТСХ проводили на різних етапах для контролю якості. Протокол займає приблизно 20 хвилин, що забезпечує вихід 86.2 ± 8.5%.
Радіоактивне мічення частинок кремнезему при різних концентраціях с 68Ga
Частинки кремнезему ресуспендували в різних концентраціях (від 1 до 0.002 мг мл-1) в 0.5 М буфері HEPES (pH 4.9). Потім 50 мкл розчину додавали в реакційну пробірку перед додаванням концентрованої [68Ga]GaCl3 елюювання в 50 мкл 0.5 М буфера HEPES (pH 4.9). Реакції проводили при 90 °C протягом 30 хвилин, і для розрахунку радіохімічного виходу проводили радіо-ТСХ.
Вимірювання концентрації частинок методом проточної цитометрії
Концентрації частинок розраховували за допомогою проточної цитометрії з використанням лічильних кульок (CountBright Absolute Counting Beads, Invitrogen) відповідно до інструкцій виробника. Частинки кремнезему ресуспендували при 0.05 мг мл-1, обробили ультразвуком протягом 10 хвилин і пропустили через фільтр з роздільною здатністю 10 мкм (шприцевий фільтр KX, нейлон, 25 мм, 10 мкм). Гранули CountBright Absolute Counting Beads нагрівали до кімнатної температури та перемішували протягом 30 секунд. Потім 50 мкл кульок додавали до 300 мкл частинок кремнезему і суміш перемішували протягом 30 хв для отримання однорідного розчину. Зразок перевіряли на проточному цитометрі, а поріг прямого розсіювання (FSC) встановлювали для включення кульок і частинок на графіку лінійного FSC проти лінійного розсіювання. Після цього напругу флуоресцентного детектора регулювали для лічильних кульок і застосовували стратегію стробування для ізоляції частинок кремнезему та популяції лічильних кульок. Нарешті, на частинках і кульках абсолютного підрахунку були намальовані ворота, і для кожного зразка було зареєстровано 1,000 подій кульок. Використовуючи цю стратегію, кількість частинок у розчині було розраховано за допомогою наступного рівняння:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Частинки}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} times,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}left(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Радіоактивне мічення 500 smSiP
50 smSiP додавали до XNUMX мкл концентрованого [68Ga]GaCl3 елюювання в 0.5 М буфері HEPES рН 4.9. Потім додавали 5.6 мкл полісорбату 80 і суміш нагрівали при 90 °C протягом 30 хвилин при 900 об/хв у термозмішувачі. Після цього був розроблений остаточний багатоетапний протокол очищення для видалення непрореагованих/колоїдних 68Ga. Додавали 10 мікролітрів 5 мМ EDTA і суміш інкубували 3 хвилин при кімнатній температурі. Потім частинки центрифугували протягом 18,300 хв при XNUMXg, ресуспендують у 500 мкл PBS, що містить 1 мМ EDTA + 0.1% полісорбату 80, і обережно перемішують протягом 10 с. Частинки знову центрифугували, промивали розчином 0.1 мМ EDTA + 0.1% полісорбату 80 у PBS і обережно перемішували протягом 10 с. Нарешті, частинки центрифугували і промивали ще п'ять разів PBS + 0.1% полісорбат 80 і ресуспендували в 500 мкл PBS. Реакцію радіомічення контролювали за допомогою радіо-ТСХ під час послідовних етапів реакції, щоб оцінити наявність колоїдів (які можна сплутати з частинками, якщо їх не видалити належним чином), радіомічення частинок і чистоту кінцевого продукту. RLY розраховували шляхом порівняння кількості радіоактивності в частинках і супернатантах після етапів промивання.
Фракціонування
Для стратегії фракціонування об’єми від 0.5 мкл до 20 мкл 68Ga-smSiP при теоретичній концентрації 1 мкл частинки-1 додавали в різні пробірки для зразків із кроком по 1 мкл (0.5, 1, 2, 3…) і додавали PBS, щоб довести кінцевий об’єм до 50 мкл. Потім 37.5 мкл з першої пробірки піпеткою перенесли в другу пробірку зі зразком, 25 мкл з другої пробірки в третю пробірку і, нарешті, 12.5 мкл з третьої пробірки в четверту пробірку. Ця стратегія забезпечує чотири пробірки на зразок із кінцевим об’ємом 12.5 мкл на пробірку. Радіоактивність у кожній пробірці вимірювали гамма-лічильником, а значення обчислювали в кБк за допомогою калібрувальної кривої для подальшого порівняння та аналізу. Зразки, що містять більшу частину радіоактивності лише в одній пробірці, обробляли ультразвуком протягом 30 секунд при кімнатній температурі та піддавали другому етапу фракціонування. Потім зразки, в яких виявлено всю радіоактивність в одній пробірці (з незначною активністю в інших трьох пробірках), використовували для подальших експериментів in vivo/ex vivo.
ПЕТ/КТ фантомне зображення
З одним було проведено експеримент із зображенням фантома 68Ga-smSiP. Для доставки частинок у пробірку для зразків використовували канюлю, щоб оцінити, чи може одна частинка залишитися в пастці в трубці канюлі під час введення. Коротко кажучи, фантомну трубку помістили в наноПЕТ/КТ-сканер із кінцем наконечника канюлі, прикріпленим до трубки. Після початку отримання PET частинки, ресуспендовані в 100 мкл PBS, доставляли за допомогою інсулінового шприца, прикріпленого до початку канюлі. Потім канюлю промивали 50 мкл PBS, щоб забезпечити доставку частинок у фантомну трубку. Отримання ПЕТ проводилося протягом 2 годин з подальшим стандартним КТ.
ПЕТ/КТ зображення in vivo
Дослідження зображень на тваринах були етично перевірені та проведені відповідно до Закону про тварин (наукові процедури) 1986 року (ASPA) Міністерства внутрішніх справ Великобританії, що регулює експерименти на тваринах. Візуалізацію in vivo проводили на здорових 8-тижневих мишах BALB/c. Тварин анестезували ізофлураном (2–3% у кисні), канюлювали та поміщали на ліжко сканера під анестезією. Ліжко нагрівали до 37 °C за допомогою внутрішнього потоку повітря, щоб підтримувати нормальну температуру тіла тварини, і частоту дихання контролювали та підтримували на рівні 60–80 вдихів за хвилину.-1 протягом усього сканування. Важливо контролювати температуру тварини, оскільки несподіване зниження температури може призвести до зниження швидкості частинок у крові. Один 68Ga-smSiP (n = 4) або 68Ga-smSiP–PEG5k частинка (n = 2) вводили через канюлю в 100 мкл PBS з подальшим промиванням 50 мкл PBS після початку отримання PET (режим збігу 1:5; вікно часу збігу 5 нс). ПЕТ записували протягом 2 год, а потім проводили напівкруглу КТ. Температуру тіла тварин і частоту дихання контролювали протягом усього процесу. Динамічні зображення ПЕТ/КТ були реконструйовані за допомогою реконструкції Tera-Tomo 3D (енергетичне вікно 400–600 кеВ, режим збігу 1:5, 20 ітерацій та 1 піднабір) із розміром вокселя 0.4 × 0.4 × 0.4 мм3 з поправкою на затухання, розсіювання та загасання. Можна знайти дані в режимі списку для всіх отримань PET/PEPT 68Ga-smSiP за посиланням. 29 і для 68Ga-smSiP–PEG5k за посиланням 30.
Відстеження в реальному часі
Спочатку дані були експортовані зі сканера у форматі listmode (тобто у форматі з міткою часу та кристалічним індексом для виявлених фотонів збігу). Геометричне перетворення було застосовано для перетворення індексів кристала в одиниці вимірювання положення в мм. Бірмінгемський метод ітеративно обчислює MDP з підмножини всіх LoR. Це робиться шляхом відкидання LoR, які знаходяться далі, ніж задана відстань від MDP, оскільки вони, ймовірно, виникнуть через помилкові LoR, наприклад, LoR, які можуть походити від розкиду. MDP уточнюється з кожною ітерацією; кількість ітерацій фактично встановлюється f-фактор і відноситься до загальної кількості LoR, які використовуються для оцінки кінцевого положення частинки в цій підмножині (наприклад, f-фактор 0.5 означає, що ітераційний цикл завершиться, коли залишиться 50% LoR у підмножині). Кількість LoR, що використовується в підмножині, можна зменшити, щоб покращити часову вибірку (підмножини є послідовними за часом без перекриття) ціною збільшення невизначеності в позиції (додаткову інформацію про алгоритм можна знайти в Parker et al.5) Бірмінгемський метод використовувався для аналізу даних у режимі списку з ПЕТ-сканера. Для відстеження частинок у мишей використовували адаптивний розмір вибірки. Розмір вибірки було встановлено для досягнення балансу достатньої часової вибірки при мінімізації помилок позиціонування. Розмір вибірки від 100 до 200 LoR використовувався на ранніх етапах сканування (<60 с від початку сканування), з f = 0.1, що дає приблизно 1–5 с інтервали. За часів сканування > 60 с розміри зразків змінювалися між 1,000 і 2,000, що дало часові інтервали від 30 до 60 с залежно від експерименту in vivo. Кількість підрахунків, використаних для обчислення MDP (на останній ітерації), можна знайти, помноживши розмір вибірки на f- значення фактора. Ці параметри були засновані на попередньому досвіді та на основі попередніх публікацій1.
Швидкість була отримана як (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) де ({v}_{m}^{2}) є швидкістю в x, y та z напрямки.
Поглинання органом ex vivo
Поглинання в різних органах оцінювали за допомогою гамма-підрахунку. Після PET/CT візуалізації in vivo тварин вбивали через вивих шийки матки, а органи вирізали та зважували для підрахунку радіоактивності в гамма-лічильнику (LKB Wallac 1282 Compugamma CS). Дані були виражені у відсотках введеної дози (доза в органі/загальна введена доза) на грам тканини (% ID g-1).
Авторадіографія
Радіоактивність у легенях відстежували за допомогою радіаційного детектора (зонд EP15, Morgan), і легені розрізали скальпелем на невеликі ділянки до отримання невеликої частини тканини з радіоактивним сигналом. Тканина була швидко заморожена в ізопропанолі при -80 °C. Одразу після заморожування тканину помістили в середовище з оптимальною температурою різання та нарізали в кріостаті на шматочки 20 мкм. Кожен зріз досліджувався детектором, доки не було знайдено радіоактивний зріз. Попередній (нижче фону), радіоактивний і наступний (нижче фону) зрізи помістили на предметне скло мікроскопа Superfrost (Epredia). Решта тканини, що залишилася, також була нижче фону. Предметне скло мікроскопа з трьома секціями накривали харчовою плівкою та виставляли на ніч на авторадіографічній пластині GE. Планшет аналізували за допомогою GE Amersham Typhoon з роздільною здатністю 25 мкм і налаштуванням PMT 4,000. Авторадіографічне зображення накладалося на зображення тканини, показуючи одну пляму радіоактивності в радіоактивному зрізі. Для кількісного визначення стандарти були підготовлені в різних відомих активностях, і кожен був позначений як 1 мкл квінтет на папері. Плями інкубували в тому самому накопичувальному люмінофорному екрані, BAS-IP MS (багатоцільовий стандарт) від GE, як кількісне визначення окремих частинок. Зображення було отримано за допомогою Amersham Typhoon 5 із програмним забезпеченням керування версії 2.0 у режимі люмінофора з розміром пікселя 100 мкм і чутливістю 4,000. Зображення кількісно оцінювали за допомогою програмного забезпечення ImageQantTL v10.0-261 з використанням інструментарію кількісного визначення гелю. Плями були виправлені шляхом вибору області безпосередньо перед або після плями як постійного фону. Отриманий об'єм плями використовувався для розрахунку Бк у частинці на основі калібрувальної кривої.
Статистика і відтворюваність
Для кількісного аналізу було проаналізовано мінімум три біологічні повтори, за винятком даних in vivo 68Ga-smSiP–PEG5k (n = 2). Дані були проаналізовані за допомогою звичайного одностороннього дисперсійного аналізу (ANOVA) з тестом множинних порівнянь Даннетта та Стьюдента. t-тест. А P значення <0.05 вважалося статистично значущим.
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://www.nature.com/articles/s41565-023-01589-8
- :є
- : ні
- :де
- ][стор
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- абсолют
- відповідно
- Achieve
- придбаний
- придбання
- поглинань
- Діяти
- діяльності
- діяльність
- адаптивний
- доданий
- додати
- доповнення
- Відрегульований
- вводити
- адміністрація
- аванси
- після
- потім
- знову
- AIR
- AL
- алгоритм
- ВСІ
- Також
- Аміак
- кількість
- an
- аналіз
- аналіз
- Якір
- та
- тварина
- тварини
- прикладної
- приблизно
- ЕСТЬ
- виникати
- AS
- At
- b
- фон
- Balance
- база
- заснований
- основа
- BD
- BE
- перед тим
- початок
- нижче
- між
- Бірмінгем
- кров
- тіло
- коротко
- приносити
- буфера
- by
- обчислювати
- розрахований
- обчислює
- розрахунок
- CAN
- carried
- Каталізатор
- осередок
- хімікалії
- Вибираючи
- клацання
- збіг
- порівняння
- порівняння
- складається
- Концентрований
- концентрація
- проводиться
- спутаний
- поспіль
- вважається
- постійна
- постійно
- контроль
- контроль
- конвертувати
- виправлений
- Коштувати
- може
- Counter
- підрахунок
- покритий
- кристал
- cs
- крива
- Вирізати
- різання
- дані
- доставляти
- поставляється
- доставка
- Залежно
- описаний
- призначений
- деталі
- виявлено
- певний
- розвиненою
- Відмінності
- різний
- напрямки
- вивих
- відстань
- робить
- доза
- звертається
- Падіння
- під час
- динамічний
- e
- E&T
- кожен
- Рано
- фактично
- електроліт
- вбудований
- випромінювання
- працевлаштований
- кінець
- енергія
- Машинобудування
- забезпечувати
- обладнання
- помилки
- оцінити
- Ефір (ETH)
- оцінювати
- оцінюється
- Події
- приклад
- Крім
- виключення
- досвід
- експеримент
- Експерименти
- виражений
- false
- Фіга
- Фільм
- фільтрувати
- остаточний
- в кінці кінців
- Перший
- п'ять
- потік
- потім
- після
- для
- формат
- Вперед
- знайдений
- чотири
- Четвертий
- заморожування
- від
- заморожені
- FSC
- далі
- Гейтс
- ge
- generator
- скло
- добре
- управління
- Грам
- Зростання
- здоровий
- тут
- Головна
- Міністерство внутрішніх справ
- HTTPS
- if
- зображення
- зображень
- Зображеннями
- негайно
- важливо
- удосконалювати
- in
- включати
- зростаючий
- інкубований
- незалежний
- індекс
- індекси
- повідомив
- мить
- інструкції
- інструмент
- інструменти
- інтегрований
- інтерфейс
- внутрішній
- в
- IT
- ітерація
- ітерації
- тримати
- відомий
- Kx
- вести
- Ймовірно
- LINK
- Легкі
- збереження
- вироблено
- виробництво
- матеріал
- Може..
- засоби
- виміряний
- вимір
- середа
- метод
- методика
- мишей
- micron
- Мікроскоп
- хвилин
- мінімізація
- мінімальний
- змішувач
- суміш
- ML
- Mobile
- режим
- контрольований
- більше
- Morgan
- найбільш
- MS
- множинний
- множення
- нанотехнології
- природа
- наступний
- немає
- нормальний
- номер
- отримувати
- отриманий
- of
- Office
- on
- ONE
- тільки
- протистояли
- оптимальний
- or
- звичайний
- Інше
- інакше
- з
- над
- за ніч
- Кисень
- Папір
- параметри
- частинка
- Пройшов
- PBS
- для
- відсоток
- виконується
- домашню тварину
- фантом
- фаза
- Фотони
- картина
- піксель
- розміщений
- plato
- Інформація про дані Платона
- PlatoData
- популяції
- частина
- положення
- позиціонування
- Позитрон
- практика
- підготовлений
- наявність
- попередній
- раніше
- Prime
- попередній
- зонд
- Процедури
- процес
- виробляти
- Product
- правильно
- протокол
- забезпечувати
- забезпечує
- забезпечення
- придбано
- якість
- кількісна оцінка
- кількісний
- кількість
- R
- Випромінювання
- радіо
- діапазон
- ставка
- реакція
- реакції
- реального часу
- отримано
- останній
- записаний
- відновлення
- Знижений
- скорочення
- посилання
- рафінований
- регіон
- правила
- стосується
- залишатися
- решті
- видаляти
- Вилучено
- тиражує
- Вимога
- дозвіл
- REST
- в результаті
- огляд
- відгуки
- Кімната
- прогін
- s
- то ж
- сканування
- сканування
- сканування
- SCI
- науковий
- Екран
- другий
- seconds
- розділам
- SEM
- Чутливість
- комплект
- установка
- установка
- показ
- Сигма
- Сигнал
- значний
- Кремній
- один
- Розмір
- розміри
- Скибочка
- Ковзати
- невеликий
- хватка
- Софтвер
- рішення
- Рішення
- Source
- конкретний
- Spot
- плями
- етапи
- standard
- стандартів
- старт
- Починаючи
- заявив,
- статистично
- Крок
- заходи
- зберігання
- Стратегія
- потік
- навчався
- Дослідження
- вивчення
- достатній
- поставка
- опитаних
- синтез
- приймає
- техніка
- Технології
- тест
- ніж
- Що
- Команда
- потім
- теоретичний
- теплової
- Ці
- третій
- це
- три
- поріг
- через
- по всьому
- час
- times
- відмітка часу
- чайові
- тканину
- до
- інструмент
- Інструменти
- Усього:
- трек
- Відстеження
- Перетворення
- в пастці
- два
- Uk
- Невизначеність
- при
- Unexpected
- одиниць
- до
- використовуваний
- використання
- Вакуум
- значення
- Цінності
- VeloCity
- версія
- Проти
- природних умовах
- Напруга
- обсяг
- Обсяги
- Воксель
- W
- було
- мийка
- вода
- були
- коли
- Чи
- який
- в той час як
- всі
- волі
- вікно
- з
- в
- вихід
- дали
- поступаючись
- зефірнет
- Zip