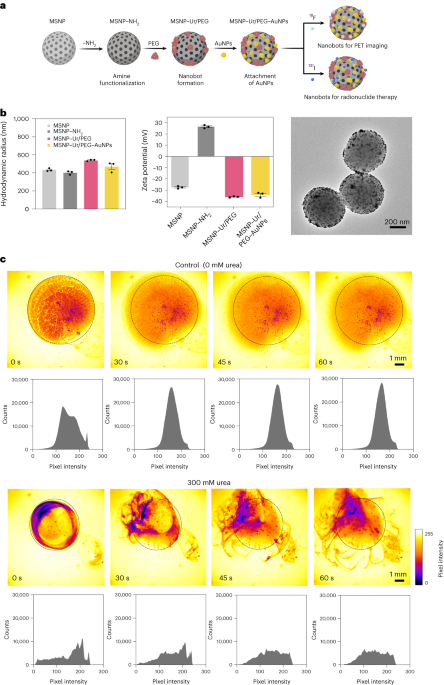
Синтез наноботів
Наноботів готували, як описано раніше33. Коротше кажучи, MSNP були синтезовані за допомогою модифікованого методу Штебера41, реагуючи з триетаноламіном (35 г), надчистою водою (20 мл) і гексадецилтриметиламоній бромідом (CTAB; 570 мг) при 95 °C протягом 30 хв при перемішуванні. Потім по краплях додавали тетраетилортосилікат (1.5 мл); суміш залишали реагувати протягом 2 год при 95 °C, а отримані MSNP збирали центрифугуванням і промивали в етанолі (тричі, 2,500g, 5 хв). Щоб видалити шаблон CTAB, MSNP поміщали під зворотний холодильник у кислий метанол (1.8 мл HCl, 30 мл метанолу) протягом 24 годин. Потім MSNP збирали центрифугуванням і тричі промивали в етанолі (2,500g, 5 хв) перед включенням модифікації аміну шляхом додавання APTES (6 мкл на мг MSNP) до MSNP (1 мг мл-1) у 70% етанольному розчині при 70 °C, інтенсивно перемішуючи протягом 1 год. MSNPs-NH2 збирали та промивали тричі в етанолі та тричі у воді центрифугуванням (тричі, 1,150g, 5 хв). MSNPs-NH2 ресуспендували в PBS у концентрації 1 мг мл-1 і загальним об’ємом 900 мкл, і активували глутаровим альдегідом (100 мкл) протягом 2.5 год при кімнатній температурі. Активований MSNPs-NH2 збирали та тричі промивали в PBS шляхом центрифугування (1,150g, 5 хв), ресуспендують у розчині уреази (3 мг мл-1) та гетеробифункціональний ПЕГ (1 мкг ПЕГ на мг 5 кДа HS-MSNPs-NH2) в PBS і реагували протягом 24 годин при кімнатній температурі. Отримані наноботи потім збирали та тричі промивали в PBS шляхом центрифугування (1,150g, 5 хв) перед тим, як ресуспендувати їх у дисперсії AuNP, приготовленої, як описано раніше51, залишаючи їх реагувати протягом 10 хв, і ретельно промиваючи центрифугуванням (тричі, 1,150g, 5 хв).
Гідродинамічний розподіл розмірів і заряд поверхні MSNPs, MSNPs-NH2, наноботів і наноботів, декорованих AuNP, визначали за допомогою системи динамічного розсіювання світла Wyatt Mobius і Malvern Zetasizer відповідно. У всіх випадках концентрація становила 20 мкг мл-1 і час отримання 5 s, використовуючи три прогони на експеримент. Було проведено три вимірювання для кожного типу частинок.
Синтез MSNP FITC
Готували суміш FITC (2 мг), етанолу (5 мл) і APTES (400 мкл) і перемішували протягом 30 хв. Потім дотримувалися описаного раніше протоколу для синтезу MSNP, за винятком того, що ми додавали тетраетилортосилікат (1.25 мл) по краплях у поєднанні з сумішшю FITC–APTES (250 мкл). Етапи функціоналізації для отримання FITC-мічених наноботів були такими, як зазначено вище.
Синтез AuNPs
AuNP були синтезовані за допомогою описаного методу33. Коротше кажучи, всі матеріали були очищені свіжоприготованою царською горілкою, ретельно промиті водою та висушені на повітрі. Згодом 1 мМ AuCl4 розчин нагрівали до точки кипіння при перемішуванні в круглодонній колбі, інтегрованій у систему дефлегмації. Після цього додавали 10 мл розчину цитрату натрію (30.8 мМ) і розчин кип’ятили протягом 20 хв, що призвело до червоного забарвлення. Потім розчину давали охолонути до кімнатної температури при перемішуванні протягом 1 год. Отримані AuNP зберігали в темряві, а характеристику проводили за допомогою трансмісійної електронної мікроскопії.
Ферментативна активність
Ферментативна активність наноботів, 18F-наноботів і 131I-nanobots вимірювали за допомогою фенолового червоного. Для цього 2 мкл наноботів (1 мг мл-1) додавали до 96-лункового планшета та змішували з 200 мкл різних розчинів сечовини (0, 50, 100, 200 мМ) у 1.1 мМ феноловому червоному. Поглинання при 560 нм вимірювали протягом часу при 37 °C.
Динаміка руху нанороботів за допомогою оптичної мікроскопії
Оптичні відео наноботів були отримані за допомогою мікроскопа Leica Thunder у поєднанні з високошвидкісною ПЗЗ-камерою Hamamatsu та об’єктивом × 1.25. Для цього наноботів центрифугували та ресуспендували в 50 мкл PBS (кінцева концентрація 20 мг мл-1). Потім чашку Петрі заповнювали 3 мл PBS або 300 мМ розчину сечовини (в PBS) і спостерігали під мікроскопом. 5 мкл краплі з наноботами (20 мг мл-1) потім додавали в наповнену рідиною чашку Петрі та записували відео зі швидкістю 25 кадрів на секунду. Розподіл інтенсивності пікселів відео в ROI аналізували з інтервалом 15 секунд за допомогою програмного забезпечення ImageJ.
Радіологічне мічення наноботів [18F]F-PyTFP
Синтез [18F]F-PyTFP
[18F]F-PyTFP був синтезований у модулі Neptis xSeed (оптимізоване радіохімічне застосування) згідно з раніше повідомленим методом33.
Синтез 18F-мічені наноботи
Наноботів позначили [18F]F-PyTFP, на основі попередньо встановленої процедури з незначними модифікаціями33. Коротше кажучи, 200 мкл розчину нанобота (1 мг мл-1) центрифугували (10 хв, 13,853g), ресуспендують у 10 мкл PBS (1 мМ, pH 8) та інкубують з 4 мкл [18F]F-PyTFP в ацетонітрилі (приблизно 37 MBq) протягом 35 хв при кімнатній температурі. Після інкубації реакційну суміш розбавляли водою (200 мкл) і очищали центрифугуванням (5 хв, 13,853g). Отриманий осад потім тричі промивали водою перед вимірюванням у калібраторі дози (CPCRC-25R, Capintec). Радіохімічний вихід розраховувався як співвідношення між кількістю радіоактивності, присутньої в наноботах після промивання, та початковою кількістю радіоактивності. Радіохімічна чистота після очищення становила ≥99%, як визначено за допомогою радіотонкошарової хроматографії (радіо-ТСХ) з використанням хроматографічного паперу iTLC-SG (Agilent Technologies) і дихлорметану та метанолу (2:1) як нерухомої та рухомої фаз відповідно. Пластини ТШХ аналізували за допомогою пристрою для зчитування ТШХ (MiniGITA, Raytest).
Стабільність 18F-наноботи
Стабільність 18Наноботів, мічених F, визначали з використанням таких середовищ: (1) 300 мМ сечовина, (2) вода та (3) сеча тварин із пухлиною. 18F-мічені наноботи (10 мкл) інкубували з відповідним розчином (100 мкл) протягом 1 год при кімнатній температурі. Потім наноботів і супернатант відокремлювали центрифугуванням і збирали, а радіоактивність вимірювали в калібраторі дози (CPCRC-25R).
Радіомічення наноботів с 131I
Радіоіодування уреазних наноботів проводили шляхом інкубації наноботів з ін’єкційним [131I]NaI розчин (925 MBq мл-1; GE HealthCare). Коротше кажучи, 400 мкл розчину нанобота уреази (1 мг мл-1) центрифугували (13,853 XNUMXg, 5 хв), ресуспендують у 100 мкл PBS (10 мМ, pH 7.4) та інкубують з 25 мкл або 185 мкл ін’єкційного [131I]NaI (приблизно 42.55 або 277.5 MBq, відповідно) протягом 30 хв, залежно від бажаної кінцевої активності. Після інкубації реакційну суміш очищали центрифугуванням (13,853g, 5 хв). Отриманий осад тричі промивали водою (100 мкл). Радіоактивність у супернатанті та осаді визначали за допомогою калібратора дози (CPCRC-25R), і обидві фракції аналізували за допомогою радіо-ТШХ, як для 18F-наноботи.
Розробка моделі тварин
Мишей утримували та обробляли відповідно до Директиви Європейської Ради 2010/63/UE та внутрішніх інструкцій. Усі експериментальні процедури були схвалені комітетом з етики CIC biomaGUNE та місцевими органами влади (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Аналіз зображень (як ПЕТ, так і МРТ) був сліпий щодо групового розподілу тварин.
Ортотопічна мишача модель раку сечового міхура була створена шляхом внутрішньоміхурового введення клітин MB49 (клітинна лінія мишачої карциноми сечового міхура) самкам мишей C57BL/6JRj (віком 8 тижнів, Janvier). Для експериментів, спрямованих на визначення накопичення пухлини (чотири групи; деталі нижче), шість тварин були інокуловані на групу, як визначено за допомогою прецизійного аналізу, з такими припущеннями: необхідна точність, 20%; очікуване s.d., ±20%; впевненість 95%; втрати тварин, 20%. Для експериментів з терапевтичною ефективністю (шість груп; деталі нижче) у кожну групу було включено десять тварин, розраховане за допомогою одностороннього методу Стьюдента t-тест, різниця між двома незалежними середніми, з такими припущеннями: нульова гіпотеза, лікування не впливає на ріст пухлини; α, 0.05; 1 − β0.95; s.d., ±50%; очікувані відмінності між групами, 50%; втрати тварин, 20%. Оскільки з експлуатаційних міркувань експеримент проводився двома партіями, в обидві партії була включена одна контрольна група (табл. 2), а потім усіх тварин об’єднали. Для встановлення пухлини мишей анестезували шляхом інгаляції 3% ізофлурану в чистому O2 і підтримується 1.0–1.5 % ізофлурану в 100 % O2. Потім спорожнили сечовий міхур і спричинили хімічні ураження уротелію внутрішньоміхуровим введенням 50 мкл полі-l-лізину (Sigma-Aldrich) через катетер калібру 24 протягом 15 хв. Згодом сечовий міхур знову спорожнили, і клітини MB49 (105 клітини) у DMEM з високим вмістом глюкози (100 мкл) закапували протягом 1 год перед видаленням катетера та спорожненням сечового міхура за допомогою масажу живота. Під час експериментів за мишами спостерігали та зважували для моніторингу здоров’я та добробуту. Кінцеву точку для людини застосовували, якщо втрата ваги перевищувала 20% або на основі клінічних симптомів відповідно до критеріїв відповідального ветеринара.
Відстеження розміру пухлини
Дослідження МРТ проводили через 7 і 14 днів після індукції пухлини за допомогою сканера 7 T Bruker BioSpec USR 70/30 (Bruker BioSpin), оснащеного градієнтною вставкою BGA-12S 440 mT m-1 і резонатор 112/086 QSN (T12053V3) для радіочаст.14 трансмісія та поверхнева котушка мозку щура (T11205V3) для радіочастотного прийому (обидві працюють на частоті 300 МГц). Тварин анестезували ізофлураном (4% для індукції та 1.5% для підтримки в 50% O2/50% N2 суміші) і помістили на підставку, сумісну з МР. Температуру тіла та частоту дихання постійно контролювали за допомогою МР-сумісного пристрою моніторингу (модель 1030 SA, Small Animal Instruments), підключеного до системи нагрівання повітря для дрібних гризунів для підтримки температури тіла. Після отримання еталонних зображень дифузійно-зважена послідовність візуалізації на основі спін-луни була використана для зображення пухлин, використовуючи такі параметри: час відлуння (TE) = 22.3 мс, час повторення (TR) = 2,500 мс, n = 2 середніх, одне зображення A0 (базальне зображення з b = 0 с мм-2) та одне зображення DW, отримане за допомогою дифузійних градієнтів у напрямку (1, 0, 0) із тривалістю градієнта δ = 4.5 мс і градієнтне розділення Δ = 10.6 мс, даючи b = 650 с мм-2, 16 × 16 мм2 поле зору, розмір матриці зображення 160 × 160 точок, 20 послідовних зрізів товщиною 0.5 мм (без розриву, отримано в режимі чергування) і смуга пропускання 192.9 Гц на піксель. Для візуалізації пухлин зображення були оброблені за допомогою програмного забезпечення ImageJ, розділивши зображення, отримані за допомогою градієнта дифузії (b = 650 с мм-2) тими, хто придбав без (b = 0 с мм-2), а також застосування тривимірного фільтра Гауса (σx = σy = σz = 0.7) до результату. Пухлини окреслювали вручну, щоб визначити їх об'єм.
Біорозподіл in vivo
На 15 день після індукції пухлини мишей рандомізували на чотири групи для отримання однорідного середнього розподілу об’єму пухлини між групами. ПЕТ-КТ (сканери MOLECUBES β та X-CUBE) були отримані через 3 год після внутрішньоміхурового введення 100 мкл 18F-BSA (групи 1 і 2) або 18F-уреаза (групи 3 і 4) наноботи в концентрації 200 мкг мл-1, використовуючи воду (групи 1 і 3) або 300 мМ сечовини у воді (групи 2 і 4) як носій (табл. 1). Для отримання зображення тварин індукували анестезією (5% ізофлурану в чистому кисні) і клали в положення лежачи перед тим, як масажувати область живота для евакуації сечового міхура. Відразу після цього відповідний 18F-мічені наноботи (18F-BSA/18F-уреаза у воді/сечовині) вводили в сечовий міхур через катетер калібру 24 та інкубували протягом 1 год, перш ніж видалити катетер, спорожнити сечовий міхур і залишити мишей відновлюватися після анестезії. на t = 3 год після введення тварин повторно анестезували та отримували 10 хвилинні статичні ПЕТ-зображення всього тіла, а потім КТ. ПЕТ-зображення були реконструйовані з використанням алгоритму реконструкції максимізації очікування впорядкованої підмножини 3D з випадковими поправками, поправками на розсіювання та послаблення. Зображення ПЕТ-КТ тієї самої миші були спільно зареєстровані та проаналізовані за допомогою інструменту обробки зображень PMOD. Графіки залежності концентрації радіоактивності від часу були отримані шляхом створення цікавого об’єму у верхній частині сечового міхура за допомогою тривимірного контурного інструменту та вимірювання активності (з поправкою на розпад) у кілобекерелях на орган. Результати були скориговані шляхом застосування коефіцієнта калібрування, а потім нормалізовані за об’ємом пухлини, отриманим за допомогою МРТ.
Дослідження ex vivo
Гістопатологічні аналізи
Після завершення всіх зображень вибрані сечові міхури (n = 3 на групу) від пухлинних і здорових тварин вилучали в асептичних умовах і негайно фіксували в 4% формальдегіді. Потім сечові міхури занурювали в парафін перед тим, як взяти зрізи 2–3 мкм для фарбування гематоксиліном-еозином. Репрезентативні зображення були отримані з усіх умов для гістопатологічного дослідження.
ІСП-МС аналіз
Вимірювання проводили на Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) у поєднанні з автосамплером ASX-560 (CETAC Tech). Після завершення всіх візуалізацій тварин вбили та відібрали сечовий міхур (n = 2 на групу; чотири групи), зібрані та розщеплені в 1 мл HNO3:HCl (суміш 4:1). Дисперсію кип'ятили до повного розчинення органів. Потім розчин охолоджували до кімнатної температури та аналізували за допомогою ICP-MS для визначення концентрації Au в кожному зразку, перетворюючи результати у відсотки введеної дози на грам тканини (%ID g).-1).
Імуногістохімія та конфокальна мікроскопія
Для імуногістохімічного аналізу тварини з пухлинами отримували наноботів, мічених FITC, у воді або 300 мМ сечовини (n = 4 на групу), як описано вище, для досліджень ПЕТ-КТ. Крім того, тварини з пухлинами без наноботів служили контрольною групою (n = 2). У всіх випадках сечові міхури збирали, заморожували та нарізали на ділянки 10 мкм, які негайно фіксували в 10% формальдегіді протягом 15 хв, промивали 10 мМ PBS і потім інкубували в 50 мМ NH4Cl у PBS протягом 5 хв перед повторним промиванням PBS. Пермеабілізацію проводили сумішшю метанол:ацетон (1:1) протягом 5 хв при кімнатній температурі та 0.1% тритону в PBS протягом 5 хв. Після промивання PBS зразки насичували розчином 5% BSA–0.5% Tween у PBS протягом 15 хвилин при кімнатній температурі та інкубували протягом 1 години при кімнатній температурі з мишачим анти-FITC (1:100, Abcam) у 5% BSA –0.5% Твін. Зрізи тричі промивали 10 мМ PBS протягом 5 хв та інкубували протягом 30 хв при кімнатній температурі з вторинним антитілом Alex Fluor 647 ослячий антимишачий IgG (Molecular Probes, Life Technologies, 1:1,000) у 5% BSA–0.5% Tween у PBS, знову промивають у PBS (3 × 5 хв) і монтують за допомогою набору ProLong antifade з 4,6-діамідіно-2-феніліндолом (DAPI; Molecular Probes, Life Technologies). Зображення були отримані за допомогою конфокального мікроскопа Leica STELLARIS 5 (Науковий парк UPV/EHU) з однаковими налаштуваннями для всіх секцій: збільшення ×10 із зображенням плитки та зшиванням (зазвичай поле зору 4 × 5). Лазерна лінія та вікна виявлення становили 405 нм і 440–503 нм для DAPI, 489 нм і 494–602 нм для білого лазера FITC і 653 нм і 660–836 нм для білого лазера Alexa647.
Оптичне очищення
Після перфузії 4% параформальдегідом і PBS зразки сечового міхура були видалені та додатково зафіксовані в 4% параформальдегіді протягом ночі при 4 °C, потім поміщені в 5 мл шприц з 0.8% агарозою з низькою температурою плавлення, щоб утворити циліндричний блок і дозволити легко монтаж в кварцову кювету. Весь блок поступово дегідратували за допомогою метанолу:Н2O при 4 °C (30%:70% протягом 1 год., 50%:50% протягом 1 год., 70%:30% протягом 1 год., 100%:0% протягом 1 год., потім 100% метанол протягом ночі і знову протягом 4 h) і, нарешті, занурюють у бензиловий спирт–бензилбензоат (BABB) як розчин для узгодження показника заломлення для візуалізації. Для порівняння in vitro зелених наноботів FITC з комерційними червоними частинками ми використовували червоні флуоресцентні наночастинки кремнезему DiagNano (Creative Diagnostics) діаметром 1 мкм, стійкі до очищення BABB.
Автофлуоресценція та поляризована sLS візуалізація
Зображення світлового аркуша було виконано на MacroSPIM, спеціальній системі для чистого зображення всього органу, розробленій в IRB Barcelona44,45. Коротше кажучи, зразки вкладаються в агарозний блок, очищаються разом із зразком і знімаються всередині кварцової кювети. Автофлуоресцентне зображення використовувало лазери з довжиною хвилі 488, 561 або 638 нм, які забезпечували освітлення через 50 мм ахроматичну дублетну циліндричну лінзу (ACY254-050-A, Thorlabs). Щоб зменшити смугасті артефакти, світловий аркуш повертається за допомогою резонансного сканера SC-10 (EOPC) уздовж телескопа 4f із ахроматичними дублетними лінзами G322288322 100 mm (QI Optic Photonics). Автофлуоресценцію тканин збирають через смугові або довгопрохідні флуоресцентні фільтри та записують камерою ORCA Flash v2 (Hamamatsu Photonics). Зображення проводили зі збільшенням × 9.6 із збільшенням × 8, об’єктивом × 2 і трубчастим об’єктивом × 0.6. Світловий лист був сплющений по полю зору, що дало 5–6 мкм аксіальної роздільної здатності. Тривимірне зображення було зроблено з кроком 3 мкм. Зображення всього сечового міхура було виконано в 2.5 × 2 або 3 × 3 XY плитки, залежно від розміру органу.
Зображення sLS було досягнуто шляхом видалення флуоресцентного фільтра або використання будь-якого фільтра, що пропускає лазер. Обертання світлового аркуша зменшує спекл-шум лазера, що призводить до часового усереднення лазерної когерентності, як показано раніше52. Орієнтація лінійної поляризації світлового листа при освітленні контролювалася обертанням напівхвильової пластини (AHWP05M-600, Thorlabs) перед поворотним сканером. Виявлений сигнал був відібраний у поляризації за допомогою обертового лінійного поляризатора (LPVISC100, Thorlabs) перед колесом фільтра під час виявлення, вносячи >50% втрати інтенсивності при виявленні флуоресценції. У той час як розподіл сигналу sLS загалом змінюється залежно від орієнтації поляризатора, на сигнал автофлуоресценції тканини не впливає обертання поляризатора. sLS дає просторову роздільну здатність 2.4 ± 0.3 мкм у BABB, що можна порівняти з роздільною здатністю у флуоресцентному зображенні світлового листа (підтверджено підгонкою функції Гауса до XY відповідь зображення окремої частинки, додаткова рис. 8л–м) і близька до теоретичної роздільної здатності в повітрі (1.53 мкм із числовою апертурою (NA) = 0.2 при максимальному макрозбільшенні ×8).
Обробка зображень і 3D аналіз
Обробку зображень, сегментацію та аналіз наборів даних світлових аркушів було виконано за допомогою ImageJ/Fiji, тоді як рис. 3 та 4 були створені за допомогою Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) і додаткове відео 3 було створено за допомогою Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Мозаїчні набори даних світлових аркушів були зшиті за допомогою MosaicExplorerJ53. 3D-сегментація тканини сечового міхура була виконана за допомогою спеціальних макросів ImageJ/Fiji для напівавтоматизованої 3D-анотації великих об’ємів у віртуальному режимі. Коротше кажучи, перший сценарій, «Macro1», завантажує стеки 3D-зображень, дозволяє користувачеві анотувати досліджувані ділянки в кількох площинах і автоматично інтерполює досліджувані області для створення та експорту 3D-масків. ROI малювалися через кожні 15 площин (кожні 37.5 мкм), щоб забезпечити якісну безперервність сегментації, зводячи анотації до прийнятного мінімуму. Другий сценарій, «Macro2», виконує математичні або логічні операції, площина за площиною, не завантажуючи цілі стеки в пам’ять, або між 3D-масками, або між 3D-маскою та вихідними даними, зберігаючи результат як новий стек. Усі маски були створені шляхом анотування автофлуоресцентних зображень.
Поверхневі шари як пухлини, так і здорової тканини (рис. 3) були окреслені за допомогою палички Фіджі та інструментів ласо на порожнині сечового міхура в масці. Викликаючи цю першу ітерацію BC1, наступні запуски Macro1 автоматично розширюють цей 3D-контур на певну кількість пікселів, щоб отримати нові ітерації маски, BC2, BC3 тощо, зі збільшенням розширень. Перший шар, що містить як пухлину, так і здорову тканину, маску L1, отримуємо шляхом віднімання маски BC1 від BC2 тощо, утворюючи L2 і L3 як концентричні шари. Об’єм пухлини, найближчий до порожнини, було отримано шляхом коментування пухлини за допомогою інструментів палички та ласо для створення маски T1, тоді як 3D-шар здорового уротелію виявлявся окремо в масці U1. Віднімання U1 від L1 дає поверхневий шар пухлини і так далі: L2 − U1, L3 − U1. І навпаки, перший шар уротелію виходить шляхом віднімання T1 від L1. Усі шари на рис. 3 було визначено, що вони мають товщину 33 мкм.
Той самий набір макросів і процедур (інструмент палички ImageJ, цифрова ерозія 500 мкм тощо) використовувався для окреслення та сегментації внутрішньої частини тканини сечового міхура, а потім оцінки внутрішнього об’єму тканини сечового міхура (рис. 4, подробиці див. вище). Гістограми інтенсивності розсіяного сигналу були створені на Фіджі шляхом поєднання розсіяного сигналу та маски.
використання RNT 131Я-наноботи
Між 8 і 15 днями після імплантації пухлини тварин розділили на шість груп (групи 1–6), намагаючись досягти однакового середнього об’єму пухлини в групах (табл. 2). Для експериментів тваринам індукували анестезію (5% ізофлурану в чистому O2) і лежачи на спині, перш ніж спорожнити сечовий міхур, масажуючи область живота. Відразу після цього 100 мкл відповідної обробки в концентрації 400 мкг мл-1 (Таблиця 2) було введено в сечовий міхур за допомогою катетера 24 калібру. Лікування та носій (вода або сечовина) залишалися в сечовому міхурі протягом 1 год перед видаленням катетера. Сечовий міхур знову спорожнили за допомогою масажу живота, а мишей відновили після анестезії в їхніх клітках, замінивши тирсу клітини тварин через 24 години після обробки для видалення радіоактивного забруднення.
Терапевтична ефективність визначається за допомогою МРТ
Два дослідження МРТ проводили на кожній миші: (1) між 7 і 14 днями після інокуляції пухлини, щоб рандомізувати тварин серед груп і виміряти початкові (попередні) об’єми пухлини; (2) між 16 і 21 днями після інокуляції пухлини (після лікування) для оцінки терапевтичної ефективності. МРТ проводили за допомогою сканерів 7 T Bruker BioSpec і 11.7 T Bruker BioSpec (обидва з програмним забезпеченням ParaVision 7), залежно від наявності. Це не вплинуло на результати, оскільки зовнішнє поле не є критичним для анатомічного зображення14. Експерименти із зображенням проводилися з використанням тих самих параметрів зображення та обробки, як описано вище (Відстеження розміру пухлини). У випадку сканера 11.7 T налаштування складалися з котушки на поверхні серця миші для прийому та об’ємної котушки для передачі. Обсяги пухлини в кожному зрізі визначали з об’ємів пухлини, намальованих вручну.
Статистичний аналіз
У дослідженнях ПЕТ візуалізації відсоток введеної дози (% ID) та введеної дози на об’єм пухлини (% ID см-3) порівнювали за допомогою одностороннього дисперсійного аналізу. Відмінності між групами були визначені за допомогою тесту множинних порівнянь Тьюкі. НТВ у розділі РНТ отримано від a t-тест непарних значень. Розповсюдження даних вважалося нормальним, але це не було офіційно перевірено. Статистичний аналіз проводився за допомогою GraphPad Prism v.8.
Підсумок звітності
Більш детальна інформація про розробку досліджень доступна в Короткий звіт про портфоліо природи пов'язана з цією статтею.
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://www.nature.com/articles/s41565-023-01577-y
- :є
- : ні
- ][стор
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- МЕНЮ
- вище
- відповідно
- накопичення
- Achieve
- досягнутий
- придбаний
- придбання
- придбання
- через
- активоване
- активний
- діяльність
- доданий
- додати
- Додатково
- адміністрація
- впливати
- після
- потім
- знову
- спрямований
- AIR
- AL
- Alex
- алгоритм
- ВСІ
- дозволено
- по
- Альцгеймера
- серед
- кількість
- амілоїд
- an
- аналізи
- аналіз
- Якір
- та
- тварина
- тварини
- антитіла
- будь-який
- застосування
- прикладної
- Застосування
- відповідний
- затверджений
- вода
- ЕСТЬ
- ПЛОЩА
- стаття
- AS
- передбачається
- припущення
- At
- Влада
- автоматично
- наявність
- доступний
- середній
- усереднення
- b
- BABB
- ширина смуги
- основа
- BE
- перед тим
- поведінка
- буття
- нижче
- між
- Блокувати
- тіло
- варений
- обидва
- Brain
- тягар
- але
- by
- садки
- розрахований
- покликання
- кімната
- рак
- випадок
- випадків
- CCD
- осередок
- Клітини
- Зміни
- заряд
- хімічний
- Очищення
- клацання
- Клінічний
- близько
- котушка
- поєднання
- об'єднання
- комерційний
- комітет
- порівнянний
- порівняний
- порівняння
- повністю
- завершення
- концентрація
- стан
- Умови
- проводиться
- довіра
- Підтверджено
- поспіль
- безперервність
- постійно
- контроль
- контроль
- навпаки
- Прохолодно
- виправлений
- Виправлення
- Відповідний
- Рада
- з'єднаний
- покриття
- створювати
- створений
- створення
- Креатив
- Критерії
- критичний
- КТ сканує
- виготовлений на замовлення
- Вирізати
- темно
- дані
- набори даних
- день
- Днів
- de
- певний
- надання
- Залежно
- описаний
- дизайн
- бажаний
- деталі
- виявлено
- Виявлення
- Визначати
- певний
- визначення
- розвиненою
- пристрій
- діагностика
- DID
- різниця
- Відмінності
- різний
- радіомовлення
- цифровий
- розведений
- напрям
- Захворювання
- блюдо
- розсіювання
- розподіл
- Розподілу
- розділений
- do
- робить
- зроблений
- доза
- звертається
- Падіння
- тривалість
- динамічний
- динаміка
- e
- E&T
- кожен
- легко
- нудьгувати
- ефективність
- або
- вбудований
- включіть
- дозволяє
- Кінцева точка
- підвищена
- Весь
- ферментативні
- обладнаний
- встановлений
- установа
- оцінити
- Ефір (ETH)
- етика
- Європейська
- оцінювати
- Кожен
- експертиза
- перевищений
- Крім
- очікування
- очікуваний
- експеримент
- експериментальний
- Експерименти
- пояснені
- експорт
- зовнішній
- фасилітувати
- фактор
- жінка
- поле
- Фіга
- Рисунок
- заповнений
- фільтрувати
- Фільтри
- остаточний
- в кінці кінців
- Перший
- пристосування
- фіксованою
- спалах
- потім
- після
- для
- форма
- формальдегід
- Формально
- вперед
- чотири
- від
- заморожені
- функція
- далі
- розрив
- ge
- GE Healthcare
- Загальне
- породжувати
- генерується
- дає
- добре
- градієнти
- Грам
- зелений
- Group
- Групи
- Зростання
- керівні вказівки
- Мати
- he
- здоров'я
- охорона здоров'я
- здоровий
- Серце
- HTTPS
- хуан
- людина
- icap
- ID
- однаковий
- if
- зображення
- аналіз зображення
- зображень
- Зображеннями
- негайно
- занурений
- поліпшується
- in
- включені
- включення
- зростаючий
- інкубований
- Інкубація
- ІНКУБАЦІЯ
- незалежний
- індекс
- індукційний
- інформація
- початковий
- внутрішній
- всередині
- інструменти
- інтегрований
- інтерактивний
- інтерес
- внутрішній
- в
- введення
- ітерація
- ітерації
- ЙОГО
- КДА
- зберігання
- комплект
- l2
- великий
- лазер
- лазери
- шар
- шарів
- догляд
- залишити
- об'єктив
- лінзи
- життя
- світло
- Лінія
- LINK
- пов'язаний
- погрузка
- вантажі
- місцевий
- від
- Macro
- макроси
- підтримувати
- обслуговування
- вручну
- маска
- маски
- узгодження
- матеріал
- Матеріали
- математичний
- Матриця
- максимальний
- засоби
- вимір
- виміряний
- вимірювання
- вимір
- Медіа
- пам'ять
- меринос
- Метанол
- методика
- мишей
- Мікроскоп
- Мікроскопія
- хвилин
- мінімальний
- незначний
- змішаний
- суміш
- ML
- Mobile
- режим
- модель
- Моделі
- модифікований
- Модулі
- молекулярний
- контрольований
- моніторинг
- рух
- миша
- МРТ
- MS
- MT
- множинний
- нанотехнології
- природа
- мереж
- Нейтральний
- Нові
- немає
- шум
- нормальний
- мета
- спостерігається
- отримувати
- отриманий
- of
- Старий
- on
- ONE
- операційний
- оперативний
- операції
- оптимізований
- or
- Orca
- оригінал
- над
- за ніч
- Оксфорд
- Кисень
- Папір
- параметри
- Парк
- частина
- частинка
- PBS
- Кілочок
- проникнення
- для
- виконується
- виступає
- домашню тварину
- Петрі
- фаз
- Стрижень
- піксель
- розміщений
- літак
- Літаки
- plato
- Інформація про дані Платона
- PlatoData
- точка
- точок
- портфель
- положення
- розташовані
- Точність
- підготовлений
- представити
- раніше
- процедура
- Процедури
- обробка
- поступово
- протокол
- Qi
- кількісний
- радіо
- випадковий
- Рандомізований
- ЩУР
- ставка
- співвідношення
- Реагувати
- реакція
- читач
- розумний
- Причини
- отримано
- прийом
- записаний
- Відновлювати
- червоний
- зменшити
- Знижений
- знижує
- посилання
- регіон
- залишився
- залишається
- видаляти
- Вилучено
- видалення
- Повідомляється
- Звітність
- представник
- вимагається
- дослідження
- стійкий
- дозвіл
- відповідно
- відповідь
- результат
- в результаті
- результати
- робот
- Кімната
- пробіжки
- s
- SA
- то ж
- економія
- сканування
- розсіяний
- SCI
- науковий
- сценарій
- другий
- вторинний
- розділ
- розділам
- побачити
- сегмент
- сегментація
- обраний
- Послідовність
- служив
- налаштування
- кілька
- лист
- показаний
- Сигнал
- Розподіл сигналу
- аналогічний
- з
- один
- SIX
- Розмір
- Скибочка
- невеликий
- So
- натрій
- Софтвер
- рішення
- Рішення
- просторовий
- Стабільність
- стек
- Стеки
- статистичний
- starris
- заходи
- зберігати
- полоса
- студент
- Дослідження
- наступні
- Згодом
- набір
- поверхню
- Симптоми
- синтез
- система
- T
- T1
- таблиця
- взяття
- технології
- Технології
- телескоп
- шаблон
- десять
- тест
- перевірений
- Що
- Команда
- їх
- Їх
- потім
- теоретичний
- Лікувальний
- терапія
- це
- ретельно
- ті
- три
- тривимірний
- через
- по всьому
- час
- times
- тканину
- до
- разом
- інструмент
- інструменти
- Усього:
- до
- до
- перетворення
- лікування
- Triton
- намагається
- пухлини
- два
- тип
- типово
- неушкоджений
- при
- до
- на
- використовуваний
- користувач
- використання
- Цінності
- автомобіль
- Проти
- через
- Відео
- Відео
- вид
- Віртуальний
- візуалізувати
- природних умовах
- обсяг
- Обсяги
- об'ємна
- ходунки
- паличка
- було
- мийка
- вода
- we
- тижня
- вага
- Добробут
- були
- Колесо
- який
- в той час як
- білий
- windows
- з
- в
- без
- X
- вихід
- поступаючись
- врожайність
- зефірнет
- зум