Nanobot syntese
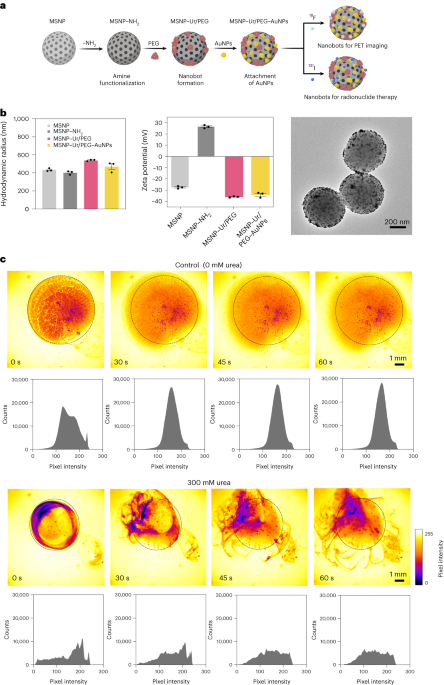
Nanoboter ble utarbeidet som tidligere beskrevet33. Kort fortalt ble MSNP-er syntetisert ved hjelp av en modifisert Stöber-metode41, reagerer trietanolamin (35 g), ultrarent vann (20 ml) og heksadecyltrimetylammoniumbromid (CTAB; 570 mg) ved 95 °C i 30 min under omrøring. Tetraetylortosilikat (1.5 ml) ble deretter tilsatt dråpevis; blandingen fikk reagere i 2 timer ved 95 °C og de resulterende MSNP-ene ble samlet ved sentrifugering og vasket i etanol (tre ganger, 2,500g5 min). For å fjerne CTAB-malen ble MSNP-er plassert under tilbakeløp i sur metanol (1.8 ml HCl, 30 ml metanol) i 24 timer. Deretter ble MSNP-er samlet ved sentrifugering og vasket tre ganger i etanol (2,500g, 5 min) før inkorporering av aminmodifikasjon ved å tilsette APTES (6 µl per mg MSNP) til MSNPs (1 mg ml-1) i en 70 % etanolisk løsning ved 70°C, under kraftig omrøring i 1 time. MSNPs-NH2 ble samlet og vasket tre ganger i etanol og tre ganger i vann ved sentrifugering (tre ganger, 1,150g5 min). MSNPs-NH2 ble resuspendert i PBS ved en konsentrasjon på 1 mg ml-1 og totalt volum på 900 µl, og aktivert med glutaraldehyd (100 µl) i 2.5 t ved romtemperatur. De aktiverte MSNP-NH2 ble samlet og vasket i PBS tre ganger ved sentrifugering (1,150g, 5 min), resuspendert i en løsning av urease (3 mg ml-1) og heterobifunksjonell PEG (1 μg PEG per mg 5 kDa HS-MSNPs-NH2) i PBS, og reagerte i 24 timer ved romtemperatur. De resulterende nanobotene ble deretter samlet og vasket tre ganger i PBS ved sentrifugering (1,150g, 5 min) før de resuspenderes i en dispersjon av AuNPs, tilberedt som tidligere beskrevet51, lar dem reagere i 10 minutter, og grundig vask ved sentrifugering (tre ganger, 1,150g5 min).
Hydrodynamisk størrelsesfordeling og overflateladning av MSNP-ene, MSNP-NH2, ble nanoboter og AuNP-dekorerte nanoboter bestemt ved bruk av henholdsvis et Wyatt Mobius dynamisk lysspredningssystem og en Malvern Zetasizer. I alle tilfeller var konsentrasjonen 20 µg ml-1 og innhentingstid 5 s, ved bruk av tre kjøringer per eksperiment. Tre målinger per partikkeltype ble utført.
Syntese av FITC MSNPs
En blanding av FITC (2 mg), etanol (5 ml) og APTES (400 µl) ble fremstilt og omrørt i 30 min. Deretter ble den tidligere beskrevne protokollen for MSNP-syntese fulgt, bortsett fra at vi tilsatte tetraetylortosilikat (1.25 ml) dråpevis i kombinasjon med FITC-APTES-blandingen (250 µl). Funksjonaliseringstrinnene for å få FITC-merkede nanoboter var som nevnt ovenfor.
Syntese av AuNP-er
AuNP-er ble syntetisert ved hjelp av en rapportert metode33. Kort oppsummert ble alle materialer renset med nylaget aqua regia, skylt grundig med vann og lufttørket. Deretter ble en 1 mM AuCl4 løsningen ble oppvarmet til kokepunktet under omrøring i en rundbunnet kolbe integrert i et tilbakeløpssystem. Etter dette ble 10 ml natriumsitratløsning (30.8 mM) tilsatt, og løsningen ble kokt i 20 minutter, noe som resulterte i en rød farge. Løsningen fikk deretter avkjøles til romtemperatur under omrøring i 1 time. De resulterende AuNP-ene ble lagret i mørket og karakterisering ble utført ved bruk av transmisjonselektronmikroskopi.
Enzymatisk aktivitet
Enzymatisk aktivitet av nanoboter, 18F-nanoboter og 131I-nanobots ble målt ved bruk av fenolrødt. For å gjøre det, 2 µl nanobots (1 mg ml-1) ble tilsatt til en 96-brønners plate og blandet med 200 µl forskjellige urealøsninger (0, 50, 100, 200 mM) i 1.1 mM fenolrødt. Absorbans ved 560 nm ble målt over tid ved 37 °C.
Nanobot bevegelsesdynamikk gjennom optisk mikroskopi
Optiske videoer av nanoboter ble skaffet ved hjelp av et Leica Thunder-mikroskop, kombinert med et Hamamatsu høyhastighets CCD-kamera og et ×1.25 objektiv. For dette ble nanobotene sentrifugert og resuspendert i 50 µl PBS (endelig konsentrasjon på 20 mg ml-1). Deretter ble en petriskål fylt med 3 ml av enten PBS eller en 300 mM løsning av urea (i PBS) og observert under mikroskop. En 5 µl dråpe med nanoboter (20 mg ml-1) ble deretter lagt til den væskefylte petriskålen og videoer ble tatt opp med 25 bilder per sekund. Videopikselintensitetsfordelinger i ROI-er ble analysert med 15 s intervaller ved bruk av ImageJ-programvare.
Radiomerking av nanoboter med [18F]F-PyTFP
Syntese av [18F]F-PyTFP
[18F]F-PyTFP ble syntetisert i en Neptis xSeed-modul (Optimized Radiochemical Applications), etter en tidligere rapportert metode33.
Syntese av 18F-merkede nanoboter
Nanoboter ble merket med [18F]F-PyTFP, på grunnlag av en tidligere etablert prosedyre med mindre modifikasjoner33. Kort fortalt, 200 µl nanobot-løsning (1 mg ml-1) ble sentrifugert (10 min, 13,853g), resuspendert i 10 µl PBS (1 mM, pH 8), og inkubert med 4 µl [18F]F-PyTFP i acetonitril (ca. 37 MBq) i 35 min ved romtemperatur. Etter inkubering ble reaksjonsblandingen fortynnet med vann (200 µl) og renset ved sentrifugering (5 min, 13,853g). Den resulterende pelleten ble deretter skylt tre ganger med vann før den ble målt i en dosekalibrator (CPCRC-25R, Capintec). Radiokjemisk utbytte ble beregnet som forholdet mellom mengden radioaktivitet tilstede i nanobotene etter vask og den opprinnelige mengden radioaktivitet. Radiokjemisk renhet etter rensing var ≥99 %, bestemt ved radiotynnsjiktskromatografi (radio-TLC) ved bruk av iTLC-SG kromatografipapir (Agilent Technologies) og diklormetan og metanol (2:1) som henholdsvis stasjonære og mobile faser. TLC-plater ble analysert ved bruk av en TLC-leser (MiniGITA, Raytest).
Stabilitet av 18F-nanoboter
Stabiliteten til 18F-merkede nanoboter ble bestemt ved bruk av følgende medier: (1) 300 mM urea, (2) vann og (3) urin fra tumorbærende dyr. 18F-merkede nanoboter (10 µl) ble inkubert med den tilsvarende løsningen (100 µl) i 1 t ved romtemperatur. Deretter ble nanoboter og supernatant separert ved sentrifugering og samlet, og radioaktivitet målt i en dosekalibrator (CPCRC-25R).
Radiomerking av nanoboter med 131I
Radiojodering av urease nanoboter ble utført ved å inkubere nanoboter med injiserbare [131I]NaI-løsning (925 MBq ml-1; GE HealthCare). Kort fortalt, 400 µl urease nanobot-løsning (1 mg ml-1) ble sentrifugert (13,853g, 5 min), resuspendert i 100 µl PBS (10 mM, pH 7.4) og inkubert med 25 µl eller 185 µl injiserbar [131I]NaI (henholdsvis ca. 42.55 eller 277.5 MBq) i 30 min, avhengig av ønsket sluttaktivitet. Etter inkubering ble reaksjonsblandingen renset ved sentrifugering (13,853g5 min). Det resulterende bunnfallet ble vasket tre ganger med vann (100 µl). Radioaktivitet i supernatanten og bunnfallet ble bestemt ved bruk av en dosekalibrator (CPCRC-25R), og begge fraksjonene ble analysert med radio-TLC, som for 18F-nanoboter.
Utvikling av dyremodeller
Mus ble vedlikeholdt og håndtert i samsvar med EU-rådets direktiv 2010/63/UE og interne retningslinjer. Alle eksperimentelle prosedyrer ble godkjent av CIC biomaGUNE etikkkomité og lokale myndigheter (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Bildeanalyse (både PET og MR) ble blindet mot gruppefordeling av dyrene.
Den ortotopiske murine modellen av blærekreft ble generert ved intravesikal administrering av MB49-celler (murin karsinomblærecellelinje) til C57BL/6JRj hunnmus (8 uker gamle, Janvier). For eksperimenter rettet mot å bestemme tumorakkumulering (fire grupper; detaljer nedenfor), ble seks dyr inokulert per gruppe, bestemt ved bruk av presisjonsanalyse, med følgende antakelser: nødvendig presisjon, 20 %; forventet s.d., ±20%; selvtillit, 95 %; tap av dyr, 20 %. For eksperimenter med terapeutisk effekt (seks grupper; detaljer nedenfor), ble ti dyr inkludert per gruppe, beregnet ved bruk av en ensidig student t-test, forskjell mellom to uavhengige middel, med følgende antakelser: nullhypotese, behandling påvirker ikke tumorvekst; α0.05; 1 - β0.95; s.d., ±50%; forventede forskjeller mellom grupper, 50 %; tap av dyr, 20 %. Siden eksperimentet ble utført i to batcher av operasjonelle årsaker, ble en kontrollgruppe inkludert i begge batcher (tabell 2), og deretter ble alle dyr samlet. For tumoretablering ble mus bedøvet ved inhalering av 3% isofluran i ren O2 og opprettholdes av 1.0–1.5 % isofluran i 100 % O2. Deretter ble blæren tømt, og kjemiske lesjoner indusert på urothelium ved intravesisk instilling av 50 µl poly-l-lysin (Sigma-Aldrich) gjennom et 24-gauge kateter i 15 min. Deretter ble blæren tømt igjen og MB49-celler (105 celler) i høyglukose-DMEM (100 µl) ble instillert i 1 t før kateteret ble fjernet og blæren tømt via magemassasje. Gjennom forsøkene ble mus overvåket og veid for helse- og velferdsovervåking. Et menneskelig endepunkt ble brukt hvis vekttap oversteg 20 % eller på grunnlag av kliniske symptomer, i henhold til kriteriene til ansvarlig veterinær.
Sporing av svulststørrelse
MR-studier ble utført 7 og 14 dager etter tumorinduksjon, ved bruk av en 7 T Bruker BioSpec USR 70/30 skanner (Bruker BioSpin) utstyrt med en BGA-12S gradientinnsats på 440 mT m-1 og en 112/086 QSN-resonator (T12053V3) for radiofrekvens14 overføring, og en rottehjerneoverflatespole (T11205V3) for RF-mottak (begge opererer ved 300 MHz). Dyrene ble bedøvet med isofluran (4 % for induksjon og 1.5 % for vedlikehold i en 50 % O2/50 % N2 blanding) og plassert på en MR-kompatibel vugge. Kroppstemperatur og respirasjonsfrekvens ble kontinuerlig overvåket ved bruk av en MR-kompatibel overvåkingsenhet (modell 1030 SA, Small Animal Instruments), koblet til et luftvarmesystem med små gnagere for å opprettholde kroppstemperaturen. Etter å ha anskaffet referansebilder, ble en spinn-ekkobasert diffusjonsvektet bildesekvens brukt til å avbilde svulster ved å bruke følgende parametere: ekkotid (TE) = 22.3 ms, repetisjonstid (TR) = 2,500 ms, n = 2 gjennomsnitt, ett A0-bilde (basalbilde med b = 0 s mm-2) og ett DW-bilde hentet ved bruk av diffusjonsgradienter i (1, 0, 0) retning med en gradientvarighet δ = 4.5 ms og en gradientseparasjon Δ = 10.6 ms, gir b = 650 s mm-2, en 16 × 16 mm2 synsfelt, bildematrisestørrelse på 160 × 160 punkter, 20 påfølgende skiver med 0.5 mm tykkelse (ingen gap, innhentet i interleaved-modus) og en båndbredde på 192.9 Hz per piksel. For å visualisere svulster ble bilder etterbehandlet med ImageJ-programvare, og delte bilder tatt med en diffusjonsgradient (b = 650 s mm-2) av de ervervet uten (b = 0 s mm-2), og bruke et 3D Gaussisk filter (σx = σy = σz = 0.7) til resultatet. Tumorer ble avgrenset manuelt for å bestemme volumet deres.
In vivo biodistribusjon
På dag 15 etter tumorinduksjon ble mus randomisert i fire grupper for å oppnå homogene gjennomsnittlige tumorvolumfordelinger blant grupper. PET-CT-skanninger (MOLECUBES β- og X-CUBE-skannere) ble tatt 3 timer etter intravesikal administrering av 100 µl av 18F-BSA (gruppe 1 og 2) eller 18F-urease (gruppe 3 og 4) nanoboter i en konsentrasjon på 200 µg ml-1, ved bruk av enten vann (gruppe 1 og 3) eller 300 mM urea i vann (gruppe 2 og 4) som bærer (tabell 1). For bildeopptak ble dyrene indusert med anestesi (5 % isofluran i rent oksygen) og plassert i ryggleie før de masserte mageregionen for blæreevakuering. Umiddelbart etterpå, den tilsvarende 18F-merkede nanoboter (18F-BSA/18F-urease i vann/urea) ble instillert i blæren gjennom et 24-gauge kateter og inkubert i 1 time, før kateteret ble fjernet, blæren ble tømt og musene lot seg komme seg etter anestesi. På t = 3 t etter administrering ble dyrene bedøvet på nytt og 10 min statiske PET-bilder av hele kroppen tatt, etterfulgt av CT-skanninger. PET-bilder ble rekonstruert ved å bruke den 3D-ordnede delsettforventningsmaksimeringsrekonstruksjonsalgoritmen med tilfeldige, sprednings- og dempningskorrigeringer. PET-CT-bilder av samme mus ble samregistrert og analysert ved bruk av PMOD-bildebehandlingsverktøyet. Plott av konsentrasjon av radioaktivitet versus tid ble oppnådd ved å lage et volum av interesse på den øvre blæreregionen ved å bruke et 3D-konturverktøy og måle aktivitet (forfallskorrigert) i kilobecquerel per organ. Resultatene ble korrigert ved å bruke en kalibreringsfaktor og deretter normalisert ved MR-avledet tumorvolum.
Ex vivo studier
Histopatologiske analyser
Etter å ha fullført all bildebehandling, valgte blærer (n = 3 per gruppe) fra tumorbærende og friske dyr ble fjernet under aseptiske forhold og umiddelbart fiksert i 4 % formaldehyd. Deretter ble blærer innebygd i parafin før man tok 2–3 µm seksjoner for hematoxylin–eosinfarging. Representative bilder ble hentet fra alle forhold for histopatologisk undersøkelse.
ICP-MS analyse
Målinger ble utført på en Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) kombinert med en ASX-560 autosampler (CETAC Tech). Etter å ha fullført all bildebehandling, ble dyrene drept, og utvalgte blærer (n = 2 per gruppe; fire grupper) samlet og fordøyd i 1 ml HNO3:HCl (4:1 blanding). Dispersjonen ble kokt inntil organene var fullstendig oppløst. Deretter ble løsningen avkjølt til romtemperatur og analysert ved bruk av ICP-MS for å bestemme konsentrasjonen av Au i hver prøve, og transformerte resultatene til prosenter av injisert dose per gram vev (%ID g-1).
Immunhistokjemi og konfokal mikroskopi avbildning
For immunhistokjemianalyser mottok tumorbærende dyr FITC-merkede nanoboter i vann eller 300 mM urea (n = 4 per gruppe), som beskrevet ovenfor, for PET-CT-studier. I tillegg fungerte svulstbærende dyr uten nanoboter som en kontrollgruppe (n = 2). I alle tilfeller ble blærer samlet, frosset og kuttet i 10 µm seksjoner som umiddelbart ble fiksert i 10 % formaldehyd i 15 min, vasket med 10 mM PBS og deretter inkubert i 50 mM NH4Cl i PBS i 5 minutter før du skyller igjen med PBS. Permeabilisering ble utført med metanol:aceton (1:1) i 5 minutter ved romtemperatur og 0.1 % Triton i PBS i 5 minutter. Etter vask av PBS ble prøvene mettet med en løsning av 5 % BSA–0.5 % Tween i PBS i 15 minutter ved romtemperatur og inkubert i 1 time ved romtemperatur med muse-anti-FITC (1:100, Abcam) i 5 % BSA –0.5 % Tween. Seksjoner ble vasket tre ganger med 10 mM PBS i 5 minutter og inkubert i 30 minutter ved romtemperatur med sekundært antistoff Alex Fluor 647 esel anti-mus IgG (Molecular Probes, Life Technologies, 1:1,000) i 5 % BSA–0.5 % Tween i PBS, vasket igjen i PBS (3 × 5 min) og montert med et ProLong antifade-sett med 4,6-diamidino-2-phenylindole (DAPI; Molecular Probes, Life Technologies). Bildene ble tatt med et Leica STELLARIS 5 konfokalmikroskop (UPV/EHU Scientific Park) med identiske innstillinger for alle seksjoner: ×10 forstørrelse med flisavbildning og søm (vanligvis 4 × 5 synsfelt). Laserlinje og deteksjonsvinduer var 405 nm og 440–503 nm for DAPI, 489 nm og 494–602 nm for FITC hvit laser og 653 nm og 660–836 nm for Alexa647 hvit laser.
Optisk clearing
Etter perfusjon med 4 % paraformaldehyd og PBS, ble blæreprøver fjernet og videre fiksert i 4 % paraformaldehyd over natten ved 4 °C, deretter innebygd i en 5 ml sprøyte med 0.8 % lavsmeltende agarose for å danne en sylindrisk blokk og muliggjøre enkel montering i kvartskyvetten. Hele blokken ble gradvis dehydrert ved bruk av metanol:H2O ved 4 °C (30 %:70 % i 1 t, 50 %:50 % i 1 t, 70 %:30 % i 1 t, 100 %:0 % i 1 t, deretter 100 % metanol over natten og igjen i 4 t) og til slutt nedsenket i benzylalkohol-benzylbenzoat (BABB) som løsning for brytningsindekstilpasning for bildebehandling. For in vitro sammenligninger av grønne FITC nanobots med kommersielle røde partikler, brukte vi DiagNano (Creative Diagnostics) røde fluorescerende silika nanopartikler, 1 µm diameter, motstandsdyktig mot BABB clearing.
Autofluorescens og polarisert sLS-avbildning
Light-sheet-avbildning ble utført på MacroSPIM, et tilpasset system for klarert helorganavbildning utviklet ved IRB Barcelona44,45. Kort fortalt er prøver innebygd i en agaroseblokk, renset sammen med prøven og avbildet inne i en kvartskyvette. Autofluorescensavbildning brukte lasere ved 488, 561 eller 638 nm som leverer belysning gjennom en 50 mm akromatisk dublett sylindrisk linse (ACY254-050-A, Thorlabs). For å redusere stripeartefakter dreies lysarket med en resonansskanner SC-10 (EOPC) langs et 4f-teleskop med G322288322 100 mm akromatiske dublettlinser (QI Optic Photonics). Vevsautofluorescens samles opp gjennom bånd- eller langpassfluorescensfiltre og tas opp med et ORCA Flash v2-kamera (Hamamatsu Photonics). Bildebehandling ble utført ved ×9.6 med en ×8 zoom, ×2 linse og ×0.6 rørlinse. Lysarket ble flatet ut over synsfeltet, og ga 5–6 µm aksial oppløsning. 3D-avbildning ble utført i trinn på 2.5 µm. Helblæren ble utført i 2 × 3 eller 3 × 4 XY fliser, avhengig av orgelstørrelse.
sLS-avbildning ble oppnådd ved å fjerne fluorescensfilteret eller bruke et hvilket som helst filter som overfører laseren. Svingning av lysark reduserte laserflekkstøy, noe som resulterer i tidsmessig gjennomsnitt av laserkoherens som vist tidligere52. Orienteringen av lineær lysarkpolarisering i belysning ble kontrollert ved å rotere en halvbølgeplate (AHWP05M-600, Thorlabs) før pivotskanneren. Det detekterte signalet ble valgt i polarisering ved bruk av en roterende lineær polarisator (LPVISC100, Thorlabs) før filterhjulet i deteksjon, og introduserte >50 % intensitetstap i fluorescensdeteksjon. Mens sLS-signalfordeling generelt endres med polarisatorens orientering, forblir vevsautofluorescenssignalet upåvirket av polarisatorens rotasjon. sLS gir en romlig oppløsning på 2.4 ± 0.3 µm i BABB, som er sammenlignbar med oppløsningen i fluorescenslysarkavbildning (bekreftet ved å tilpasse en gaussisk funksjon til XY bilderespons av en enkelt partikkel, tilleggsfig. 8 l–m) og nær den teoretiske oppløsningen i luft (1.53 µm med numerisk blenderåpning (NA) = 0.2 ved maksimal makrozoom ×8).
Bildebehandling og 3D-analyse
Bildebehandling, segmentering og analyse av lysark-datasett ble gjort med ImageJ/Fiji, mens fig. 3 og 4 ble generert med Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) og tilleggsvideo 3 ble generert med Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Flislagte lysarkdatasett ble sydd med MosaicExplorerJ53. Blærevev 3D-segmentering ble utført ved å bruke tilpassede ImageJ/Fiji-makroer for halvautomatisk 3D-annotering av store volumer i virtuell modus. Kort fortalt, et første skript, 'Macro1', laster 3D-bildestabler, muliggjør brukerkommentarer av ROI-er i flere plan og interpolerer automatisk ROI-ene for å generere og eksportere 3D-masker. ROI-er ble tegnet hvert 15. plan (hver 37.5 µm) for å lette god segmenteringskontinuitet samtidig som merknadene ble holdt på et rimelig minimum. Et andre skript, 'Macro2', utfører de matematiske eller boolske operasjonene, plan for plan uten å laste hele stablene inn i minnet, enten mellom 3D-masker eller mellom en 3D-maske og de originale dataene, og lagrer resultatet som en ny stabel. Alle masker ble generert ved å kommentere autofluorescensbilder.
Både svulst- og sunt vevsoverflatelag (fig. 3) ble avgrenset med Fijis tryllestav og lassoverktøy på blærehulen i en maske. Ved å kalle denne første iterasjonen BC1, utvider påfølgende kjøringer av Macro1 denne 3D-konturen automatisk med en definert pikselmengde for å gi nye maskeiterasjoner, BC2, BC3 og så videre, med økende utvidelser. Det første laget som inneholder både svulst og sunt vev, maske L1, oppnås ved å trekke maske BC1 fra BC2 og så videre, og gir L2 og L3 som konsentriske lag. Svulstvolumet nærmest hulrommet ble oppnådd ved å kommentere svulsten med stav og lassoverktøy for å lage en maske T1, mens det sunne 3D-urothelium-laget ble oppdaget separat i maske U1. Å trekke U1 fra L1 gir overflatelaget til svulsten, og så videre: L2 − U1, L3 − U1. Motsatt oppnås det første laget av urotelet ved å trekke T1 fra L1. Alle lag i fig. 3 ble definert til å ha 33 µm tykkelse.
Den samme pakken med makroer og prosedyrer (ImageJ stavverktøy, digital erosjon på 500 µm og så videre) ble brukt til å avgrense og segmentere den indre delen av blærevevet og deretter estimere blærens indre vevsvolum (fig. 4, se ovenfor for detaljer). Histogrammer av den spredte signalintensiteten ble laget i Fiji ved å kombinere det spredte signalet og masken.
RNT bruker 131Jeg-nanoboter
Mellom dag 8 og 15 etter tumorimplantasjon ble dyrene delt inn i seks grupper (gruppe 1–6), og forsøkte å oppnå lignende gjennomsnittlige tumorvolum på tvers av grupper (tabell 2). For eksperimentene ble dyr indusert med anestesi (5% isofluran i ren O2) og posisjonert liggende før du tømmer blæren ved å massere mageregionen. Umiddelbart etterpå, 100 µl av passende behandling i en konsentrasjon på 400 µg ml-1 (Bord 2) ble instillert i blæren ved hjelp av et 24-gauge kateter. Behandling og vehikel (vann eller urea) ble værende i blæren i 1 time før kateteret ble fjernet. Blæren ble tømt igjen ved abdominal massasje, og mus kom seg etter anestesi i burene, og erstattet sagflis fra dyrebur 24 timer etter behandling for å fjerne radioaktiv forurensning.
Terapeutisk effekt bestemt ved MR
To MR-studier ble utført på hver mus: (1) mellom dag 7 og 14 etter tumorinokulering for å randomisere dyr blant grupper og måle initiale (forbehandlings) tumorvolumer; (2) mellom dag 16 og 21 etter tumorinokulering (etterbehandling) for å evaluere terapeutisk effekt. MR ble utført ved bruk av 7 T Bruker BioSpec og 11.7 T Bruker BioSpec-skannere (begge med ParaVision 7-programvare), avhengig av tilgjengelighet. Dette påvirket ikke resultatene siden det eksterne feltet ikke er kritisk for anatomisk avbildning14. Bildeeksperimenter ble utført ved å bruke de samme avbildningsparametrene og behandlingen som forklart ovenfor (Sporing av svulststørrelse). I tilfellet med 11.7 T-skanneren besto oppsettet av en musehjerteoverflatespole for mottak og en volumetrisk spole for overføring. Tumorvolumer i hver skive ble bestemt fra manuelt tegnede volumer av interesse som dekker tumorområdet.
Statistisk analyse
I PET-avbildningsstudier, prosentandeler av injisert dose (% ID) og injisert dose per tumorvolum (% ID cm-3) ble sammenlignet med enveis ANOVA. Forskjeller mellom grupper ble bestemt ved å bruke Tukeys test for flere sammenligninger. NTV i RNT-seksjonen ble hentet fra en t-test av uparrede verdier. Datadistribusjon ble antatt å være normal, men dette ble ikke formelt testet. Statistiske analyser ble utført med GraphPad Prism v.8.
Rapporteringssammendrag
Mer informasjon om forskningsdesign er tilgjengelig i Sammendrag av naturporteføljerapportering knyttet til denne artikkelen.
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://www.nature.com/articles/s41565-023-01577-y
- :er
- :ikke
- ][s
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- Om oss
- ovenfor
- samsvar
- akkumulering
- Oppnå
- oppnådd
- ervervet
- anskaffe
- oppkjøp
- tvers
- aktivert
- aktiv
- aktivitet
- la til
- legge
- I tillegg
- administrasjon
- påvirke
- Etter
- etterpå
- en gang til
- sikte
- AIR
- AL
- alex
- algoritme
- Alle
- tillatt
- langs
- Alzheimers
- blant
- beløp
- amyloid
- an
- analyser
- analyse
- Anchor
- og
- dyr
- dyr
- antistoff
- noen
- søknader
- anvendt
- påføring
- hensiktsmessig
- godkjent
- aqua
- ER
- AREA
- Artikkel
- AS
- antatt
- antagelser
- At
- Myndigheter
- automatisk
- tilgjengelighet
- tilgjengelig
- gjennomsnittlig
- gjennomsnitt
- b
- BABB
- Båndbredde
- basis
- BE
- før du
- atferd
- være
- under
- mellom
- Blokker
- kroppen
- kokt
- både
- Brain
- byrde
- men
- by
- merder
- beregnet
- ringer
- rom
- Kreft
- saken
- saker
- CCD
- celle
- Celler
- Endringer
- kostnad
- kjemisk
- Clearing
- klikk
- Klinisk
- Lukke
- spole
- kombinasjon
- kombinere
- kommersiell
- Utvalget
- sammenlign
- sammenlignet
- sammenligninger
- helt
- fullført
- konsentrasjon
- tilstand
- forhold
- gjennomført
- selvtillit
- BEKREFTET
- påfølgende
- kontinuitet
- kontinuerlig
- kontroll
- kontrolleres
- omvendt
- Kul
- Korrigert
- Korreksjoner
- Tilsvarende
- Råd
- kombinert
- dekker
- skape
- opprettet
- Opprette
- Kreativ
- kriterier
- kritisk
- CT-skanninger
- skikk
- Kutt
- mørk
- dato
- datasett
- dag
- Dager
- de
- definert
- levere
- avhengig
- beskrevet
- utforming
- ønsket
- detaljer
- oppdaget
- Gjenkjenning
- Bestem
- bestemmes
- bestemme
- utviklet
- enhet
- diagnostikk
- gJORDE
- forskjell
- forskjeller
- forskjellig
- kringkasting
- digitalt
- fortynnet
- retning
- sykdom
- parabolen
- Dispersion
- distribusjon
- Distribusjoner
- Divided
- do
- gjør
- gjort
- dose
- trukket
- Drop
- varighet
- dynamisk
- dynamikk
- e
- E&T
- hver enkelt
- lett
- savner
- effekten
- enten
- innebygd
- muliggjøre
- muliggjør
- Endpoint
- forbedret
- Hele
- enzymatisk
- utstyrt
- etablert
- etablering
- anslag
- Eter (ETH)
- etikk
- europeisk
- evaluere
- Hver
- undersøkelse
- skredet
- Unntatt
- forventning
- forventet
- eksperiment
- eksperimentell
- eksperimenter
- forklarte
- eksportere
- utvendig
- legge til rette
- faktor
- hunn
- felt
- Fiken
- Figur
- fylt
- filtrere
- filtre
- slutt~~POS=TRUNC
- Endelig
- Først
- fitting
- fikset
- Blitz
- fulgt
- etter
- Til
- skjema
- formaldehyd
- Formelt
- videre
- fire
- fra
- frossen
- funksjon
- videre
- mellomrom
- ge
- GE Healthcare
- general
- generere
- generert
- Giving
- god
- gradienter
- Gram
- Grønn
- Gruppe
- Gruppens
- Vekst
- retningslinjer
- Ha
- he
- Helse
- helsetjenester
- sunt
- Hjerte
- HTTPS
- Huang
- menneskelig
- ICAP
- ID
- identiske
- if
- bilde
- bildeanalyse
- bilder
- Imaging
- umiddelbart
- nedsenket
- forbedrer
- in
- inkludert
- innlemme
- økende
- inkubert
- Inkuberer
- INKUBASJON
- uavhengig
- indeks
- induksjon
- informasjon
- innledende
- indre
- innsiden
- instrumenter
- integrert
- interaktiv
- interesse
- intern
- inn
- innføre
- køyring
- gjentakelser
- DET ER
- KDA utvidelse
- holde
- kit
- l2
- stor
- laser
- lasere
- lag
- lag
- forlater
- venstre
- Lens
- objektiver
- Life
- lett
- linje
- LINK
- knyttet
- lasting
- laster
- lokal
- tap
- Makro
- makroer
- vedlikeholde
- vedlikehold
- manuelt
- maske
- masker
- matchende
- materiale
- materialer
- matematiske
- Matrix
- maksimal
- midler
- måle
- målte
- målinger
- måling
- Media
- Minne
- merino
- metanol
- metoder
- mus
- Mikroskop
- mikros~~POS=TRUNC
- minutter
- minimum
- mindre
- blandet
- blanding
- ML
- Mobil
- Mote
- modell
- modeller
- modifisert
- moduler
- molekyl~~POS=TRUNC
- overvåket
- overvåking
- bevegelse
- mus
- MR
- MS
- MT
- flere
- nanoteknologi
- Natur
- nettverk
- Nøytral
- Ny
- Nei.
- Bråk
- normal
- Målet
- observerte
- få
- innhentet
- of
- Gammel
- on
- ONE
- drift
- operasjonell
- Drift
- optimalisert
- or
- Orca
- original
- enn
- over natten
- Oxford
- Oksygen
- Papir
- parametere
- Park
- del
- partikkel~~POS=TRUNC
- PBS
- Peg
- penetration
- for
- utført
- utfører
- kjæledyr
- Petri
- faser
- Pivot
- pixel
- plasseres
- fly
- Planes
- plato
- Platon Data Intelligence
- PlatonData
- Point
- poeng
- portefølje
- posisjon
- posisjonert
- Precision
- forberedt
- presentere
- tidligere
- prosedyren
- prosedyrer
- prosessering
- gradvis
- protokollen
- Qi
- kvantitativ
- radio
- tilfeldig
- randomisert
- ROTTE
- Sats
- ratio
- Reager
- reaksjon
- Reader
- rimelig
- grunner
- mottatt
- mottak
- registrert
- Gjenopprette
- Rød
- redusere
- Redusert
- reduserer
- referanse
- region
- forble
- forblir
- fjerne
- fjernet
- fjerne
- rapportert
- Rapportering
- representant
- påkrevd
- forskning
- motstandsdyktig
- oppløsning
- henholdsvis
- svar
- resultere
- resulterende
- Resultater
- robot
- rom
- går
- s
- SA
- samme
- besparende
- skanner
- spredt
- SCI
- vitenskapelig
- script
- Sekund
- sekundær
- Seksjon
- seksjoner
- se
- segmentet
- segmentering
- valgt
- Sequence
- servert
- innstillinger
- flere
- ark
- vist
- Signal
- Signalfordeling
- lignende
- siden
- enkelt
- SIX
- Størrelse
- Slice
- liten
- So
- natrium
- Software
- løsning
- Solutions
- romlig
- Stabilitet
- stable
- Stabler
- statistisk
- starris
- Steps
- lagret
- stripe
- Student
- studier
- senere
- I ettertid
- suite
- overflaten
- Symptomer
- syntese
- system
- T
- T1
- bord
- ta
- tech
- Technologies
- teleskop
- mal
- ti
- test
- testet
- Det
- De
- deres
- Dem
- deretter
- teoretiske
- Terapeutisk
- terapi
- denne
- grundig
- De
- tre
- tredimensjonal
- Gjennom
- hele
- tid
- ganger
- vev
- til
- sammen
- verktøy
- verktøy
- Totalt
- mot
- mot
- transformere
- behandling
- Triton
- prøver
- tumorer
- to
- typen
- typisk
- upåvirket
- etter
- til
- upon
- brukt
- Bruker
- ved hjelp av
- Verdier
- kjøretøy
- Versus
- av
- video
- videoer
- Se
- virtuelle
- visualisere
- vivo
- volum
- volumer
- volumet
- rullator
- tryllestav
- var
- vasking
- Vann
- we
- uker
- vekt
- Velferd
- var
- Hjul
- hvilken
- mens
- hvit
- vinduer
- med
- innenfor
- uten
- X
- Utbytte
- givende
- rentene
- zephyrnet
- zoom