16. januar 2024
(Nanowerk Nyheter) En viktig kjemisk reaksjon - der bevegelsen av protoner mellom overflaten av en elektrode og en elektrolytt driver en elektrisk strøm - er et kritisk trinn i mange energiteknologier, inkludert brenselceller og elektrolysatorene som brukes til å produsere hydrogengass. For første gang har MIT-kjemikere kartlagt i detalj hvordan disse protonkoblede elektronoverføringene skjer på en elektrodeoverflate. Resultatene deres kan hjelpe forskere med å designe mer effektive brenselceller, batterier eller andre energiteknologier. "Vår fremskritt i denne artikkelen var å studere og forstå hvordan disse elektronene og protonene kobles sammen på et overflatested, noe som er relevant for katalytiske reaksjoner som er viktige i sammenheng med energikonverteringsenheter eller katalytiske reaksjoner," sier Yogesh Surendranath, en professor i kjemi og kjemiteknikk ved MIT og seniorforfatter av studien. Blant funnene deres var forskerne i stand til å spore nøyaktig hvordan endringer i pH i elektrolyttløsningen som omgir en elektrode, påvirker hastigheten på protonbevegelse og elektronstrøm inne i elektroden. MIT graduate student Noah Lewis er hovedforfatter av papiret, som vises i dag i Naturkjemi ("Et mekanistisk rammeverk på molekylært nivå for grensesnittprotonkoblet elektronoverføringskinetikk"). Ryan Bisbey, en tidligere MIT postdoc; Karl Westendorff, en MIT-student; og Alexander Soudackov, en forsker ved Yale University, er også forfattere av artikkelen.
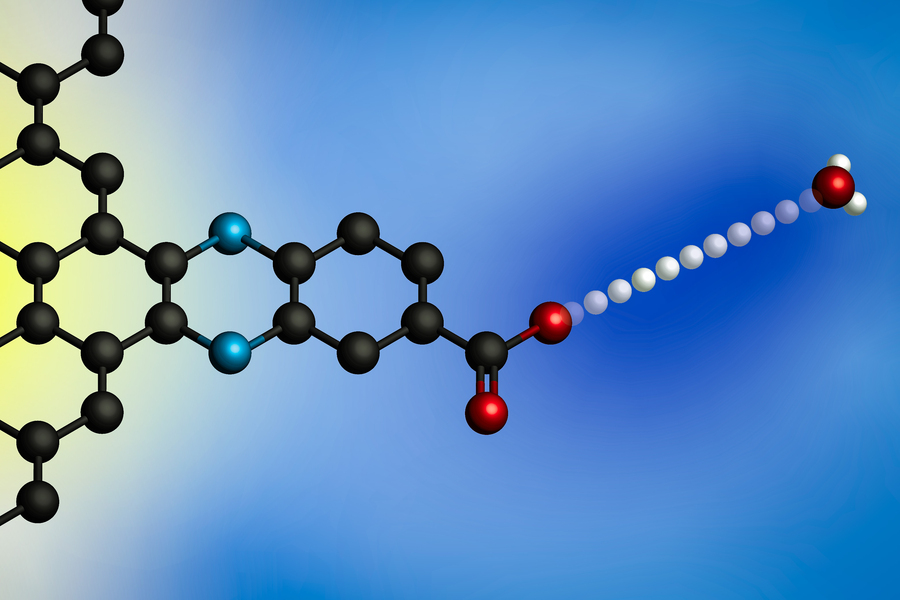 Påføring av et elektrisk potensial fører til at et proton overføres fra et hydroniumion (til høyre) til overflaten til en elektrode. Ved å bruke elektroder med molekylært definerte protonbindingssteder utviklet MIT-forskere en generell modell for disse grensesnittprotonkoblede elektronoverføringsreaksjonene. (Bilde: Med tillatelse fra forskerne)
Påføring av et elektrisk potensial fører til at et proton overføres fra et hydroniumion (til høyre) til overflaten til en elektrode. Ved å bruke elektroder med molekylært definerte protonbindingssteder utviklet MIT-forskere en generell modell for disse grensesnittprotonkoblede elektronoverføringsreaksjonene. (Bilde: Med tillatelse fra forskerne)
 Påføring av et elektrisk potensial fører til at et proton overføres fra et hydroniumion (til høyre) til overflaten til en elektrode. Ved å bruke elektroder med molekylært definerte protonbindingssteder utviklet MIT-forskere en generell modell for disse grensesnittprotonkoblede elektronoverføringsreaksjonene. (Bilde: Med tillatelse fra forskerne)
Påføring av et elektrisk potensial fører til at et proton overføres fra et hydroniumion (til høyre) til overflaten til en elektrode. Ved å bruke elektroder med molekylært definerte protonbindingssteder utviklet MIT-forskere en generell modell for disse grensesnittprotonkoblede elektronoverføringsreaksjonene. (Bilde: Med tillatelse fra forskerne)
Passerende protoner
Protonkoblet elektronoverføring skjer når et molekyl, ofte vann eller en syre, overfører et proton til et annet molekyl eller til en elektrodeoverflate, noe som stimulerer protonakseptoren til også å ta opp et elektron. Denne typen reaksjon har blitt utnyttet for mange energiapplikasjoner. "Disse protonkoblede elektronoverføringsreaksjonene er allestedsnærværende. De er ofte nøkkeltrinn i katalytiske mekanismer, og er spesielt viktige for energikonverteringsprosesser som hydrogengenerering eller brenselcellekatalyse, sier Surendranath. I en hydrogengenererende elektrolysator brukes denne tilnærmingen til å fjerne protoner fra vann og tilføre elektroner til protonene for å danne hydrogengass. I en brenselcelle genereres elektrisitet når protoner og elektroner fjernes fra hydrogengass og tilsettes oksygen for å danne vann. Protonkoblet elektronoverføring er vanlig i mange andre typer kjemiske reaksjoner, for eksempel karbondioksidreduksjon (konvertering av karbondioksid til kjemisk brensel ved å tilsette elektroner og protoner). Forskere har lært mye om hvordan disse reaksjonene oppstår når protonakseptorene er molekyler, fordi de nøyaktig kan kontrollere strukturen til hvert molekyl og observere hvordan elektroner og protoner passerer mellom dem. Imidlertid, når protonkoblet elektronoverføring skjer på overflaten av en elektrode, er prosessen mye vanskeligere å studere fordi elektrodeoverflater vanligvis er svært heterogene, med mange forskjellige steder som et proton potensielt kan binde seg til. For å overvinne hindringen utviklet MIT-teamet en måte å designe elektrodeoverflater på som gir dem mye mer presis kontroll over sammensetningen av elektrodeoverflaten. Elektrodene deres består av ark av grafen med organiske, ringholdige forbindelser festet til overflaten. I enden av hvert av disse organiske molekylene er et negativt ladet oksygenion som kan akseptere protoner fra den omkringliggende løsningen, noe som får et elektron til å strømme fra kretsen inn i den grafittiske overflaten. "Vi kan lage en elektrode som ikke består av et bredt mangfold av steder, men er en enhetlig rekke av en enkelt type veldig veldefinerte steder som hver kan binde et proton med samme affinitet," sier Surendranath. "Siden vi har disse veldig veldefinerte nettstedene, var det dette tillot oss å gjøre virkelig å nøste opp kinetikken til disse prosessene." Ved å bruke dette systemet var forskerne i stand til å måle strømmen av elektrisk strøm til elektrodene, noe som gjorde det mulig for dem å beregne hastigheten for protonoverføring til oksygenionet ved overflaten ved likevekt - tilstanden når frekvensen av protondonasjon til overflaten og protonoverføring tilbake til løsning fra overflaten er like. De fant at pH-verdien til den omkringliggende løsningen har en betydelig effekt på denne hastigheten: De høyeste verdiene fant sted i de ekstreme endene av pH-skalaen - pH 0, den sureste, og pH 14, den mest grunnleggende. For å forklare disse resultatene utviklet forskerne en modell basert på to mulige reaksjoner som kan oppstå ved elektroden. 3O+), som er i høy konsentrasjon i sterkt sure løsninger, leverer protoner til overflaten av oksygenioner og genererer vann. I den andre leverer vann protoner til overflaten oksygenioner, og genererer hydroksidioner (OH-), som er i høy konsentrasjon i sterkt basiske løsninger. Hastigheten ved pH 0 er imidlertid omtrent fire ganger raskere enn hastigheten ved pH 14, delvis fordi hydronium gir fra seg protoner med en raskere hastighet enn vann.En reaksjon å revurdere
Forskerne oppdaget også, til sin overraskelse, at de to reaksjonene har like hastigheter, ikke ved nøytral pH 7, der hydronium- og hydroksydkonsentrasjoner er like, men ved pH 10, hvor konsentrasjonen av hydroksydioner er 1 million ganger den for hydronium. Modellen antyder at dette er fordi foroverreaksjonen som involverer protondonasjon fra hydronium eller vann bidrar mer til den totale hastigheten enn bakoverreaksjonen som involverer protonfjerning med vann eller hydroksyd. Eksisterende modeller for hvordan disse reaksjonene oppstår ved elektrodeoverflater antar at forover- og bakreaksjonene bidrar like mye til den totale hastigheten, så de nye funnene tyder på at disse modellene kanskje må revurderes, sier forskerne. "Det er standardantakelsen, at forover- og bakreaksjonene bidrar like mye til reaksjonshastigheten," sier Surendranath. "Funnet vårt er virkelig øyeåpnende fordi det betyr at antagelsen som folk bruker for å analysere alt fra brenselcellekatalyse til hydrogenutvikling kan være noe vi må se på nytt." Forskerne bruker nå sitt eksperimentelle oppsett for å studere hvordan tilsetning av forskjellige typer ioner til elektrolyttløsningen som omgir elektroden kan øke eller redusere hastigheten på protonkoblet elektronstrøm. "Med systemet vårt vet vi at nettstedene våre er konstante og ikke påvirker hverandre, så vi kan lese ut hva endringen i løsningen gjør med reaksjonen på overflaten," sier Lewis.- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://www.nanowerk.com/news2/green/newsid=64425.php
- : har
- :er
- :ikke
- :hvor
- $OPP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- I stand
- Om oss
- Aksepterer
- legge til
- la til
- legge
- avansere
- påvirke
- påvirker
- Alexander
- tillatt
- også
- blant
- an
- analysere
- og
- En annen
- vises
- søknader
- påføring
- tilnærming
- ER
- Array
- AS
- anta
- forutsetningen
- At
- forfatter
- forfattere
- tilbake
- basert
- grunnleggende
- batterier
- BE
- fordi
- vært
- mellom
- binde
- bindende
- men
- by
- beregne
- CAN
- karbon
- karbondioksid
- årsaker
- celle
- Celler
- sentrum
- endring
- Endringer
- ladet
- kjemisk
- kjemi
- kjemikere
- Felles
- sammensetning
- konsentrasjon
- konstant
- kontekst
- bidra
- bidrar
- kontroll
- Konvertering
- kunne
- Par
- skape
- kritisk
- Gjeldende
- Dato
- avtale
- Misligholde
- definert
- leverer
- leverer
- utforming
- detalj
- utviklet
- Enheter
- forskjellig
- vanskelig
- oppdaget
- Mangfold
- do
- ikke
- gjør
- donasjon
- ned
- stasjoner
- hver enkelt
- effekt
- effektiv
- Elektrisk
- elektrisitet
- elektrolytt
- elektroner
- slutt
- slutter
- energi
- Ingeniørarbeid
- lik
- like
- Equilibrium
- Eter (ETH)
- alt
- evolusjon
- nøyaktig
- eksempel
- eksisterende
- eksperimentell
- Forklar
- ekstrem
- raskere
- finne
- funn
- Først
- første gang
- flyten
- Til
- skjema
- Tidligere
- Forward
- funnet
- fire
- Rammeverk
- fra
- Brensel
- brenselsceller
- brensel
- GAS
- general
- generert
- genererer
- generasjonen
- gir
- oppgradere
- graphene
- flott
- skje
- utnyttet
- Ha
- Hjerte
- hjelpe
- Høy
- høyest
- Hvordan
- Men
- HTTPS
- hydrogen
- bilde
- viktig
- in
- Inkludert
- inn
- involverer
- IT
- jpg
- karl
- nøkkel
- Type
- Vet
- føre
- lært
- Lewis
- mange
- Kan..
- midler
- måle
- mekanismer
- Middle
- millioner
- MIT
- MIT-utdannet
- modell
- modeller
- molekyl
- mer
- mer effektivt
- mest
- bevegelse
- bevegelse
- mye
- Natur
- Trenger
- negativt
- Nøytral
- Ny
- Noah
- nå
- observere
- hindring
- forekomme
- forekom
- of
- ofte
- on
- or
- organisk
- Annen
- vår
- ut
- enn
- samlet
- Overcome
- Oksygen
- Papir
- del
- spesielt
- passere
- Ansatte
- plato
- Platon Data Intelligence
- PlatonData
- mulig
- potensiell
- potensielt
- presis
- nettopp
- prosess
- Prosesser
- produsere
- Professor
- protoner
- Sats
- priser
- reaksjon
- reaksjoner
- Lese
- virkelig
- reduksjon
- relevant
- fjerning
- fjerne
- fjernet
- Fornybar
- fornybar energi
- forskning
- forskere
- Resultater
- avslører
- reversere
- ikke sant
- Ryan
- s
- samme
- sier
- sier
- Skala
- Forsker
- forskere
- Sekund
- senior
- oppsett
- signifikant
- enkelt
- nettstedet
- Nettsteder
- langsom
- So
- løsning
- Solutions
- noe
- fart
- Tilstand
- Trinn
- Steps
- stimulerer
- sterk
- struktur
- Student
- Studer
- Studerer
- slik
- foreslår
- foreslår
- overflaten
- overraskelse
- rundt
- system
- Ta
- lag
- Technologies
- enn
- Det
- De
- Staten
- deres
- Dem
- Disse
- de
- denne
- De
- tid
- ganger
- til
- i dag
- spore
- overføre
- overføringer
- to
- typen
- typer
- allestedsnærværende
- forståelse
- universitet
- løse opp
- us
- brukt
- ved hjelp av
- vanligvis
- veldig
- var
- Vann
- Vei..
- we
- veldefinerte
- var
- Hva
- når
- hvilken
- bred
- med
- innenfor
- zephyrnet