16년 2024월 XNUMX일
(나노 워크 뉴스) 전극 표면과 전해질 사이의 양성자의 이동이 전류를 구동하는 주요 화학 반응은 수소 가스를 생산하는 데 사용되는 연료 전지 및 전해조를 포함한 많은 에너지 기술에서 중요한 단계입니다. 처음으로 MIT 화학자들은 이러한 양성자 결합 전자 이동이 전극 표면에서 어떻게 일어나는지 자세히 파악했습니다. 그들의 결과는 연구자들이 보다 효율적인 연료 전지, 배터리 또는 기타 에너지 기술을 설계하는 데 도움이 될 수 있습니다. "이 논문에서 우리의 발전은 에너지 변환 장치 또는 촉매 반응의 맥락에서 중요한 촉매 반응과 관련된 표면 사이트에서 이러한 전자와 양성자가 결합하는 방식의 특성을 연구하고 이해하는 것이었습니다."라고 Yogesh Surendranath는 말합니다. MIT의 화학 및 화학 공학 교수이자 해당 연구의 수석 저자입니다. 연구진은 연구 결과에서 전극을 둘러싼 전해질 용액의 pH 변화가 전극 내 양성자 운동 속도와 전자 흐름에 어떻게 영향을 미치는지 정확히 추적할 수 있었습니다. MIT 대학원생 노아 루이스(Noah Lewis)는 오늘 발표된 논문의 주 저자입니다. 자연 화학 ("계면 양성자 결합 전자 이동 역학을 위한 분자 수준의 기계적 프레임워크"). 전 MIT 박사후 연구원인 Ryan Bisbey; MIT 대학원생 Karl Westendorff; Yale University의 연구 과학자인 Alexander Soudackov도 이 논문의 저자입니다.
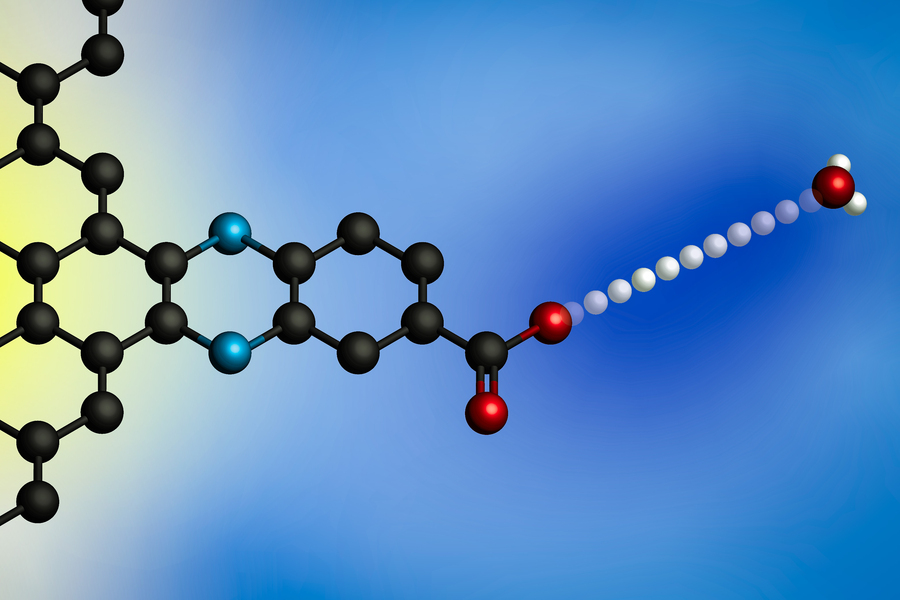 전위를 가하면 양성자가 하이드로늄 이온(오른쪽)에서 전극 표면으로 이동합니다. MIT 연구진은 분자적으로 정의된 양성자 결합 부위가 있는 전극을 사용하여 이러한 계면 양성자 결합 전자 전달 반응에 대한 일반 모델을 개발했습니다. (이미지 : 연구원 제공)
전위를 가하면 양성자가 하이드로늄 이온(오른쪽)에서 전극 표면으로 이동합니다. MIT 연구진은 분자적으로 정의된 양성자 결합 부위가 있는 전극을 사용하여 이러한 계면 양성자 결합 전자 전달 반응에 대한 일반 모델을 개발했습니다. (이미지 : 연구원 제공)
 전위를 가하면 양성자가 하이드로늄 이온(오른쪽)에서 전극 표면으로 이동합니다. MIT 연구진은 분자적으로 정의된 양성자 결합 부위가 있는 전극을 사용하여 이러한 계면 양성자 결합 전자 전달 반응에 대한 일반 모델을 개발했습니다. (이미지 : 연구원 제공)
전위를 가하면 양성자가 하이드로늄 이온(오른쪽)에서 전극 표면으로 이동합니다. MIT 연구진은 분자적으로 정의된 양성자 결합 부위가 있는 전극을 사용하여 이러한 계면 양성자 결합 전자 전달 반응에 대한 일반 모델을 개발했습니다. (이미지 : 연구원 제공)
양성자 통과
양성자 결합 전자 전달은 분자(주로 물이나 산)가 양성자를 다른 분자나 전극 표면으로 전달할 때 발생하며, 이는 양성자 수용체가 전자도 흡수하도록 자극합니다. 이러한 종류의 반응은 많은 에너지 응용 분야에 활용되었습니다. “이러한 양성자 결합 전자 전달 반응은 어디에나 존재합니다. 이는 종종 촉매 메커니즘의 핵심 단계이며 수소 생성이나 연료 전지 촉매 작용과 같은 에너지 전환 과정에 특히 중요합니다.”라고 Surendranath는 말합니다. 수소 생성 전해조에서 이 접근법은 물에서 양성자를 제거하고 양성자에 전자를 추가하여 수소 가스를 형성하는 데 사용됩니다. 연료전지에서는 수소가스에서 양성자와 전자가 제거되고 산소에 첨가되어 물이 생성될 때 전기가 생성됩니다. 양성자 결합 전자 전달은 이산화탄소 환원(전자와 양성자를 추가하여 이산화탄소를 화학 연료로 전환)과 같은 다른 많은 유형의 화학 반응에서 흔히 발생합니다. 과학자들은 양성자 수용체가 분자일 때 이러한 반응이 어떻게 일어나는지에 대해 많은 것을 배웠습니다. 왜냐하면 각 분자의 구조를 정밀하게 제어하고 전자와 양성자가 분자 사이를 어떻게 통과하는지 관찰할 수 있기 때문입니다. 그러나 양성자와 결합된 전자 이동이 전극 표면에서 발생하는 경우 전극 표면은 일반적으로 매우 이질적이며 양성자가 잠재적으로 결합할 수 있는 다양한 위치가 있기 때문에 프로세스를 연구하기가 훨씬 더 어렵습니다. 이러한 장애물을 극복하기 위해 MIT 팀은 전극 표면의 구성을 훨씬 더 정확하게 제어할 수 있는 전극 표면을 설계하는 방법을 개발했습니다. 그들의 전극은 표면에 유기 고리 함유 화합물이 부착된 그래핀 시트로 구성됩니다. 이들 유기 분자 각각의 끝에는 주변 용액으로부터 양성자를 받아들일 수 있는 음으로 하전된 산소 이온이 있으며, 이는 전자가 회로에서 흑연 표면으로 흐르게 합니다. “우리는 다양한 부위로 구성되지 않고 각각 동일한 친화력으로 양성자와 결합할 수 있는 매우 잘 정의된 단일 유형의 균일한 배열인 전극을 만들 수 있습니다.”라고 Surendranath는 말합니다. "우리는 매우 잘 정의된 사이트를 가지고 있기 때문에 이를 통해 우리가 할 수 있었던 것은 실제로 이러한 프로세스의 역학을 풀 수 있었던 것입니다." 이 시스템을 사용하여 연구원들은 전극으로의 전류 흐름을 측정할 수 있었으며 이를 통해 평형 상태에서 표면의 산소 이온으로의 양성자 이동 속도(표면에 대한 양성자 기증 속도)를 계산할 수 있었습니다. 표면에서 용액으로 다시 양성자가 이동하는 것은 동일합니다. 그들은 주변 용액의 pH가 이 속도에 중요한 영향을 미친다는 사실을 발견했습니다. 가장 높은 속도는 pH 척도의 끝 부분(가장 산성인 pH 0, 가장 염기성인 pH 14)에서 발생했습니다. 이러한 결과를 설명하기 위해 연구자들은 전극에서 발생할 수 있는 두 가지 가능한 반응을 기반으로 모델을 개발했습니다. 3O+)은 강산성 용액에 고농도로 존재하여 표면 산소 이온에 양성자를 전달하여 물을 생성합니다. 두 번째로, 물은 표면 산소 이온에 양성자를 전달하여 수산화물 이온(OH)을 생성합니다.-), 이는 강염기성 용액에 고농도로 존재합니다. 그러나 pH 0에서의 속도는 pH 14에서의 속도보다 약 XNUMX배 빠릅니다. 부분적으로는 하이드로늄이 물보다 더 빠른 속도로 양성자를 포기하기 때문입니다.다시 생각해보라는 반응
연구진은 또한 놀랍게도 두 반응의 속도가 하이드로늄과 수산화물 농도가 동일한 중성 pH 7이 아니라 수산화 이온 농도가 하이드로늄 농도의 10만 배인 pH 1에서 동일하다는 사실도 발견했습니다. 모델은 하이드로늄이나 물로부터 양성자 기증과 관련된 순방향 반응이 물이나 수산화물에 의한 양성자 제거와 관련된 역방향 반응보다 전체 속도에 더 많이 기여하기 때문이라고 제안합니다. 전극 표면에서 이러한 반응이 어떻게 발생하는지에 대한 기존 모델은 순방향 반응과 역방향 반응이 전체 속도에 동일하게 기여한다고 가정하므로 새로운 발견은 이러한 모델을 재고할 필요가 있음을 시사한다고 연구진은 말합니다. Surendranath는 “이것이 정방향 반응과 역방향 반응이 반응 속도에 동일하게 기여한다는 기본 가정입니다.”라고 말했습니다. "우리의 발견은 사람들이 연료 전지 촉매 작용부터 수소 진화까지 모든 것을 분석하기 위해 사용하고 있는 가정이 우리가 재검토해야 할 것일 수 있다는 것을 의미하기 때문에 정말 놀랍습니다." 연구원들은 이제 실험 장치를 사용하여 전극을 둘러싼 전해질 용액에 다양한 유형의 이온을 추가하면 양성자 결합 전자 흐름의 속도를 높이거나 낮출 수 있는 방법을 연구하고 있습니다. "우리 시스템을 사용하면 사이트가 일정하고 서로 영향을 미치지 않는다는 것을 알 수 있습니다. 따라서 용액의 변화가 표면 반응에 어떤 영향을 미치는지 읽을 수 있습니다."라고 Lewis는 말합니다.- SEO 기반 콘텐츠 및 PR 배포. 오늘 증폭하십시오.
- PlatoData.Network 수직 생성 Ai. 자신에게 권한을 부여하십시오. 여기에서 액세스하십시오.
- PlatoAiStream. 웹3 인텔리전스. 지식 증폭. 여기에서 액세스하십시오.
- 플라톤ESG. 탄소, 클린테크, 에너지, 환경, 태양광, 폐기물 관리. 여기에서 액세스하십시오.
- PlatoHealth. 생명 공학 및 임상 시험 인텔리전스. 여기에서 액세스하십시오.
- 출처: https://www.nanowerk.com/news2/green/newsid=64425.php
- :있다
- :이다
- :아니
- :어디
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- 할 수 있는
- 소개
- 수락
- 더하다
- 추가
- 첨가
- 전진
- 영향을
- 에 영향을 미치는
- 알렉산더
- 수
- 또한
- 중
- an
- 분석하다
- 및
- 다른
- 등장하다
- 어플리케이션
- 적용
- 접근
- 있군요
- 배열
- AS
- 취하다
- 가정
- At
- 저자
- 작성자
- 뒤로
- 기반으로
- 기본
- 배터리
- BE
- 때문에
- 된
- 사이에
- 바인딩
- 제본
- 비자 면제 프로그램에 해당하는 국가의 시민권을 가지고 있지만
- by
- 계산하다
- CAN
- 탄소
- 이산화탄소
- 원인
- 세포
- 셀
- 센터
- 이전 단계로 돌아가기
- 변경
- 청구 된
- 화학
- 화학
- 화학자
- 공통의
- 구성
- 집중
- 상수
- 문맥
- 기여하다
- 기여하다
- 제어
- 매출 상승
- 수
- 두
- 만들
- 임계
- Current
- 날짜
- 거래
- 태만
- 한정된
- 배달하다
- 제공
- 디자인
- 세부 묘사
- 개발
- 디바이스
- 다른
- 어려운
- 발견
- 다양성
- do
- 하지 않습니다
- 하기
- 기부
- 아래 (down)
- 드라이브
- 마다
- 효과
- 효율적인
- 전기
- 전기
- 전해질
- 전자
- end
- 종료
- 에너지
- 엔지니어링
- 같은
- 균일하게
- 평형
- 에테르 (ETH)
- 모두
- 진화
- 정확하게
- 예
- 현존하는
- 실험
- 설명
- 극단
- 빠른
- 발견
- 결과
- 먼저,
- 처음으로
- 흐름
- 럭셔리
- 형태
- 이전
- 앞으로
- 발견
- 사
- 뼈대
- 에
- 연료
- 연료 전지들
- 연료
- 가스
- 일반
- 생성
- 생성
- 세대
- 제공
- 졸업
- 그래 핀
- 큰
- 발생
- 하네스
- 있다
- 심장
- 도움
- 높은
- 최고
- 방법
- 그러나
- HTTPS
- 수소
- 영상
- 중대한
- in
- 포함
- 으로
- 참여
- IT
- JPG
- 칼
- 키
- 종류
- 알아
- 리드
- 배운
- 남자 이름
- .
- XNUMX월..
- 방법
- 측정
- 메커니즘
- 중간
- 백만
- MIT
- MIT 졸업생
- 모델
- 모델
- 분자
- 배우기
- 보다 효율적으로
- 가장
- 운동
- 운동
- 많은
- 자연
- 필요
- 부정적으로
- 중립의
- 신제품
- 남자 이름
- 지금
- 관찰
- 장애물
- 발생
- 발생
- of
- 자주
- on
- or
- 유기적인
- 기타
- 우리의
- 아웃
- 위에
- 전체
- 극복하다
- 산소
- 서
- 부품
- 특별히
- 패스
- 사람들
- 플라톤
- 플라톤 데이터 인텔리전스
- 플라토데이터
- 가능한
- 가능성
- 잠재적으로
- 정확한
- 정밀하게
- 방법
- 프로세스
- 생산
- 교수
- 양성자
- 율
- 거주비용
- 반응
- 반응
- 읽기
- 정말
- 축소
- 관련된
- 제거
- 제거
- 제거됨
- 재생 가능
- 재생 에너지
- 연구
- 연구원
- 결과
- 계시
- 역
- 연락해주세요
- 라이언
- s
- 같은
- 라고
- 라고
- 규모
- 과학자
- 과학자
- 둘째
- 연장자
- 설치
- 상당한
- 단일
- 대지
- 사이트
- 느리게
- So
- 해결책
- 솔루션
- 무언가
- 속도
- 주 정부
- 단계
- 단계
- 자극하다
- 강하게
- 구조
- 학생
- 교육과정
- 공부
- 이러한
- 제안
- 제안
- 표면
- 놀람
- 주변
- 체계
- 받아
- 팀
- 기술
- 보다
- 그
- XNUMXD덴탈의
- 국가
- 그들의
- 그들
- Bowman의
- 그들
- 이
- 그
- 시간
- 시대
- 에
- 오늘
- 더듬다
- 이전
- 전송
- 두
- 유형
- 유형
- 어디에나 있는
- 이해
- 대학
- 풀다
- us
- 익숙한
- 사용
- 보통
- 대단히
- 였다
- 물
- 방법..
- we
- 잘 정의 된
- 했다
- 뭐
- 언제
- 어느
- 넓은
- 과
- 이내
- 제퍼 넷