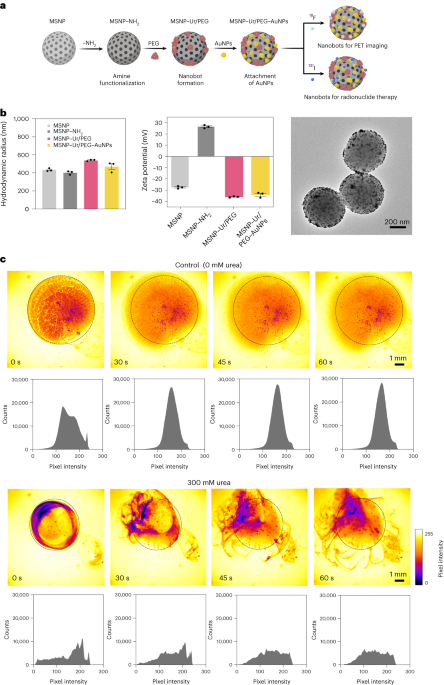
סינתזה של ננובוט
ננו-בוטים הוכנו כפי שתואר קודם לכן33. בקצרה, MSNPs סונתזו באמצעות שיטת Stöber שונה41, מגיב טריאתנולמין (35 גרם), מים טהורים במיוחד (20 מ"ל) והקסדציל-טרימתיל-אמוניום ברומיד (CTAB; 570 mg) ב-95°C למשך 30 דקות תוך כדי ערבוב. טטראתיל אורתוזיליקט (1.5 ml) הוסף לאחר מכן טיפה; התערובת הושארה להגיב במשך 2 שעות ב-95 מעלות צלזיוס וה-MSNP שהתקבל נאספו בצנטריפוגה ונשטפו באתנול (שלוש פעמים, 2,500g, 5 דקות). כדי להסיר את תבנית CTAB, MSNPs הוכנסו לרפלוקס במתנול חומצי (1.8 ml HCl, 30 ml מתנול) למשך 24 שעות. לאחר מכן, MSNPs נאספו באמצעות צנטריפוגה ונשטפו שלוש פעמים באתנול (2,500g, 5 דקות) לפני שילוב שינוי אמינים על ידי הוספת APTES (6 µl למ"ג של MSNP) ל-MSNPs (1 mg ml-1) בתמיסה אתנולית 70% בטמפרטורה של 70 מעלות צלזיוס, תוך ערבוב נמרץ במשך שעה אחת. MSNPs-NH2 נאספו ונשטפו שלוש פעמים באתנול ושלוש פעמים במים בצנטריפוגה (שלוש פעמים, 1,150g, 5 דקות). MSNPs-NH2 הושעו מחדש ב-PBS בריכוז של 1 mg ml-1 ונפח כולל של 900 µl, ומופעל עם גלוטאראלדהיד (100 µl) למשך 2.5 שעות בטמפרטורת החדר. MSNPs-NH המופעלים2 נאספו ונשטפו ב-PBS שלוש פעמים על ידי צנטריפוגה (1,150g, 5 דקות), מושהה מחדש בתמיסה של אוריאה (3 mg ml-1) ו-PEG heterobifunctional (1 μg PEG למ"ג של 5 kDa HS-MSNPs-NH2) ב-PBS, והגיב במשך 24 שעות בטמפרטורת החדר. לאחר מכן נאספו הננו-בוטים שהתקבלו ונשטפו שלוש פעמים ב-PBS על ידי צנטריפוגה (1,150g, 5 דקות) לפני השעייתם מחדש בפיזור של AuNPs, שהוכן כפי שתואר קודם לכן51, משאיר אותם להגיב למשך 10 דקות, ושטיפה יסודית באמצעות צנטריפוגה (שלוש פעמים, 1,150g, 5 דקות).
חלוקת גודל הידרודינמית ומטען פני השטח של MSNPs, MSNPs-NH2, ננו-בוטים וננו-בוטים מעוטרי AuNP נקבעו באמצעות מערכת פיזור אור דינמית של Wyatt Mobius ו-Malvern Zetasizer, בהתאמה. בכל המקרים, הריכוז היה 20 µg ml-1 וזמן רכישה 5 שניות, תוך שימוש בשלוש ריצות לכל ניסוי. בוצעו שלוש מדידות לכל סוג חלקיקים.
סינתזה של FITC MSNPs
הוכנה תערובת של FITC (2 mg), אתנול (5 ml) ו-APTES (400 μl) וערבבה במשך 30 דקות. לאחר מכן, הפרוטוקול שתואר קודם לסינתזה של MSNP נערך, פרט לכך שהוספנו טטראתיל אורתוזיליקט (1.25 מ"ל) טיפה בשילוב עם תערובת FITC-APTES (250 µl). שלבי הפונקציונליזציה להשגת ננו-בוטים עם תווית FITC היו כאמור.
סינתזה של AuNPs
AuNPs סונתזו באמצעות שיטה מדווחת33. בקצרה, כל החומרים נוקו באמצעות אקווה רג'יה שהוכנה טריה, שטופה היטב במים וייובשה באוויר. לאחר מכן, AuCl 1 mM4 התמיסה חוממה לסף רתיחה תוך כדי ערבוב בבקבוק עם תחתית עגולה המשולבת במערכת ריפלוקס. לאחר מכן, נוספו 10 מ"ל של תמיסת נתרן ציטראט (30.8 מ"מ), והתמיסה הרתחה במשך 20 דקות, וכתוצאה מכך נוצר צבע אדום. התמיסה הורתה להתקרר לטמפרטורת החדר תוך כדי ערבוב למשך שעה אחת. AuNPs שהתקבלו אוחסנו בחושך והאפיון נערך באמצעות מיקרוסקופ אלקטרונים שידור.
פעילות אנזימטית
פעילות אנזימטית של ננו-בוטים, 18F-nanobots ו 131I-nanobots נמדד באמצעות פנול אדום. לשם כך, 2 µl של ננו-בוטים (1 mg ml-1) נוספו לצלחת בעלת 96 בארות וערבבו עם 200 µl של תמיסות אוריאה שונות (0, 50, 100, 200 mM) ב-1.1 mM פנול אדום. ספיגה ב-560 nm נמדדה לאורך זמן ב-37 °C.
דינמיקת תנועה של ננובוט באמצעות מיקרוסקופיה אופטית
סרטונים אופטיים של ננו-בוטים נרכשו באמצעות מיקרוסקופ Leica Thunder, יחד עם מצלמת CCD מהירה של Hamamatsu ואובייקט של ×1.25. לשם כך, הננו-בוטים עברו צנטריפוגה והוצעו מחדש ב-50 µl של PBS (ריכוז סופי של 20 mg ml-1). לאחר מכן, צלחת פטרי מולאה ב-3 מ"ל של PBS או בתמיסה של 300 מ"מ של אוריאה (ב-PBS) ונצפה תחת המיקרוסקופ. טיפה של 5 µl עם ננו-בוטים (20 mg ml-1לאחר מכן נוספה לצלחת הפטרי המלאה בנוזל וסרטונים הוקלטו במהירות של 25 פריימים לשנייה. הפצות עוצמת פיקסלים של וידאו ב-ROI נותחו במרווחים של 15 שניות באמצעות תוכנת ImageJ.
תיוג רדיו של ננו-בוטים עם [18F]F-PyTFP
סינתזה של [18F]F-PyTFP
[18F]F-PyTFP סונתז במודול Neptis xSeed (Optimized Radiochemical Applications), בעקבות שיטה שדווחה בעבר33.
סינתזה של 18ננו-בוטים עם תווית F
ננו-בוטים סומנו עם [18F]F-PyTFP, על בסיס נוהל שנקבע בעבר עם שינויים קלים33. בקיצור, 200 µl של תמיסת ננובוט (1 mg ml-1) עבר צנטריפוגה (10 דקות, 13,853g), מושהה מחדש ב-10 µl של PBS (1 mM, pH 8), ומודגרת עם 4 µl של [18F]F-PyTFP באצטוניטריל (בערך 37 MBq) למשך 35 דקות בטמפרטורת החדר. לאחר הדגירה, תערובת התגובה דוללה במים (200 µl) וטיהרה באמצעות צנטריפוגה (5 דקות, 13,853g). לאחר מכן, הכדור שהתקבל נשטף שלוש פעמים במים לפני שנמדד בכייל מינון (CPCRC-25R, Capintec). תפוקה רדיוכימית חושבה כיחס בין כמות הרדיואקטיביות הקיימת בננו-בוטים לאחר הכביסה לבין כמות הרדיואקטיביות הראשונית. הטוהר הרדיוכימי לאחר טיהור היה ≥99%, כפי שנקבע על ידי כרומטוגרפיה רדיו-שכבת דקה (רדיו-TLC) באמצעות נייר כרומטוגרפיה iTLC-SG (Agilent Technologies) ודיכלורומתאן ומתנול (2:1) כשלב נייח ונייד, בהתאמה. לוחות TLC נותחו באמצעות קורא TLC (MiniGITA, Raytest).
יציבות של 18F-nanobots
היציבות של 18ננו-בוטים עם תווית F נקבעו באמצעות המדיות הבאות: (1) 300mM אוריאה, (2) מים ו-(3) שתן מבעלי חיים נושאי גידול. 18ננו-בוטים עם תווית F (10 µl) הודגרו עם התמיסה המתאימה (100 µl) למשך שעה אחת בטמפרטורת החדר. לאחר מכן, ננו-בוטים וסופרנטנט הופרדו באמצעות צנטריפוגה ונאספו, ונמדדה רדיואקטיביות בכייל מינון (CPCRC-1R).
תיוג רדיו של ננו-בוטים עם 131I
יוד הרדיו של ננו-אוריאה בוצע על ידי דגירה של ננו-בוטים עם הזרקה [131תמיסת I]NaI (925 MBq ml-1; GE HealthCare). בקיצור, 400 µl של תמיסת urease nanobot (1 mg ml-1) עבר צנטריפוגה (13,853g, 5 דקות), מושהה מחדש ב-100 µl של PBS (10 mM, pH 7.4) ומודגרת עם 25 µl או 185 µl להזרקה [131I]NaI (בערך 42.55 או 277.5 MBq, בהתאמה) למשך 30 דקות, תלוי בפעילות הסופית הרצויה. לאחר הדגירה, תערובת התגובה טוהרה על ידי צנטריפוגה (13,853g, 5 דקות). המשקע שהתקבל נשטף שלוש פעמים במים (100 µl). הרדיואקטיביות בסופרנטנט ובמשקע נקבעה באמצעות כיול מינון (CPCRC-25R), ושני השברים נותחו באמצעות רדיו-TLC, באשר 18F-nanobots.
פיתוח מודלים של בעלי חיים
עכברים תוחזקו וטופלו בהתאם להנחיית המועצה האירופית 2010/63/UE ולהנחיות פנימיות. כל ההליכים הניסויים אושרו על ידי ועדת האתיקה של CIC biomaGUNE והרשויות המקומיות (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). ניתוח תמונה (הן PET והן MRI) סונוור לקראת הפצה קבוצתית של החיות.
המודל העכברי האורתוטופי של סרטן שלפוחית השתן נוצר על ידי מתן תוך שלפוחית של תאי MB49 (קו תאי קרצינומה שלפוחית השתן) לעכברי נקבות C57BL/6JRj (בנות 8 שבועות, Janvier). עבור ניסויים שמטרתם לקבוע הצטברות גידול (ארבע קבוצות; פירוט להלן), חוננו שישה בעלי חיים לקבוצה, כפי שנקבע באמצעות ניתוח דיוק, עם ההנחות הבאות: דיוק נדרש, 20%; s.d. צפוי, ±20%; ביטחון עצמי, 95%; אובדן בעלי חיים, 20%. עבור ניסויי יעילות טיפולית (שש קבוצות; פרטים בהמשך), עשרה בעלי חיים נכללו בכל קבוצה, כפי שחושבו באמצעות תלמיד חד-זנב t-מבחן, הבדל בין שני אמצעים בלתי תלויים, עם ההנחות הבאות: השערת אפס, הטיפול אינו משפיע על צמיחת הגידול; α, 0.05; 1 - β, 0.95; s.d., ±50%; הבדלים צפויים בין הקבוצות, 50%; אובדן בעלי חיים, 20%. מכיוון שהניסוי נערך בשתי קבוצות מסיבות תפעוליות, קבוצת ביקורת אחת נכללה בשתי המנות (טבלה 2), ואז כל החיות אספו. לצורך הקמת גידול, עכברים הורדמו בשאיפה של 3% איזופלורן ב-O טהור2 ומתוחזק על ידי 1.0-1.5% איזופלורן ב-100% O2. לאחר מכן, שלפוחית השתן רוקנה, ונגעים כימיים נגרמו על האורותל על ידי הזרקת תוך ורידי של 50 µl של פולי-l-ליזין (Sigma-Aldrich) דרך צנתר בגודל 24 למשך 15 דקות. לאחר מכן, השלפוחית התרוקנה שוב ותאי MB49 (105 תאים) ב-DMEM עתיר גלוקוז (100 µl) הוזלפו למשך שעה אחת לפני הסרת הקטטר וריקון שלפוחית השתן באמצעות עיסוי בטן. במהלך הניסויים, עכברים נוטרו ונשקלו לצורך ניטור בריאות ורווחה. נקודת קצה אנושית הוחלה אם הירידה במשקל עלתה על 1% או על בסיס תסמינים קליניים, לפי הקריטריונים של הווטרינר האחראי.
מעקב אחר גודל הגידול
מחקרי MRI נערכו 7 ו-14 ימים לאחר השראת הגידול, באמצעות סורק 7 T Bruker BioSpec USR 70/30 (Bruker BioSpin) מצויד בהכנסת שיפוע BGA-12S של 440 mT m-1 ומהוד 112/086 QSN (T12053V3) עבור תדרי רדיו14 שידור, וסליל משטח מוח חולדה (T11205V3) עבור קליטת RF (שניהם פועלים ב-300 MHz). בעלי חיים הורדמו עם איזופלורן (4% לאינדוקציה ו-1.5% לתחזוקה ב-50% O2/50% N2 תערובת) והונחו על עריסה תואמת MR. טמפרטורת הגוף וקצב הנשימה נוטרו באופן רציף באמצעות מכשיר ניטור תואם MR (דגם 1030 SA, Small Animal Instruments), מחובר למערכת מחמם אוויר מכרסמים קטנים כדי לשמור על טמפרטורת הגוף. לאחר רכישת תמונות ייחוס, נעשה שימוש ברצף הדמיה משוקלל דיפוזיה מבוסס ספין לצילום גידולים, תוך שימוש בפרמטרים הבאים: זמן הד (TE) = 22.3 ms, זמן חזרה (TR) = 2,500 אלפיות השנייה, n = 2 ממוצעים, תמונה אחת A0 (תמונה בסיסית עם b = 0 שניות מ"מ-2) ותמונת DW אחת שנרכשה באמצעות מעברי דיפוזיה בכיוון (1, 0, 0) עם משך שיפוע δ = 4.5 ms והפרדת שיפוע Δ = 10.6 ms, נתינה b = 650 שניות מ"מ-2, 16 × 16 mm2 שדה ראיה, גודל מטריצת תמונה של 160 × 160 נקודות, 20 פרוסות רצופות בעובי של 0.5 mm (ללא פער, נרכש במצב שזירה) ורוחב פס של 192.9 Hz לפיקסל. כדי להמחיש גידולים, תמונות עברו עיבוד לאחר עם תוכנת ImageJ, תוך חלוקת תמונות שנרכשו עם שיפוע דיפוזיה (b = 650 שניות מ"מ-2) על ידי אלה שנרכשו ללא (b = 0 שניות מ"מ-2), והחלת מסנן גאוסי תלת מימדי (σx = σy = σz = 0.7) לתוצאה. הגידולים הוגדרו באופן ידני כדי לקבוע את נפחם.
הפצה ביולוגית in vivo
ביום 15 לאחר השראת הגידול, חולקו עכברים אקראית לארבע קבוצות כדי לקבל התפלגות נפח גידול הומוגנית בין הקבוצות. סריקות PET-CT (סורקי MOLECUBES β ו-X-CUBE) נרכשו 3 שעות לאחר מתן תוך ורידי של 100 µl של 18F-BSA (קבוצות 1 ו-2) או 18F-urease (קבוצות 3 ו-4) ננובוטים בריכוז של 200 µg ml-1, שימוש במים (קבוצות 1 ו-3) או 300 מ"מ אוריאה במים (קבוצות 2 ו-4) ככלי רכב (טבלה 1). עבור רכישת תמונה, בעלי חיים הושרה עם הרדמה (5% איזופלורן בחמצן טהור) והונחו בשכיבה לפני עיסוי אזור הבטן לפינוי שלפוחית השתן. מיד לאחר מכן, המקביל 18ננובוטים עם תווית F (18F-BSA/18F-urease במים/אוריאה) הוחדרו לשלפוחית השתן דרך צנתר בגודל 24 והודגרו במשך שעה אחת, לפני הסרת הקטטר, ריקון השלפוחית והשארת העכברים להתאושש מההרדמה. בְּ t = 3 שעות לאחר מתן, החיות הורדמו מחדש ונרכשו תמונות PET סטטיות של כל הגוף למשך 10 דקות, ואחריהן סריקות CT. תמונות PET שוחזרו באמצעות אלגוריתם שחזור מקסום ציפיות המשנה לפי סדר 3D עם תיקוני אקראיים, פיזור והנחתה. תמונות PET-CT של אותו עכבר נרשמו ונותחו באמצעות כלי עיבוד התמונות PMOD. עלילות של ריכוז רדיואקטיביות לעומת זמן התקבלו על ידי יצירת נפח עניין באזור שלפוחית השתן העליונה באמצעות כלי מתאר תלת מימד ומדידת פעילות (מתוקנת ריקבון) בקילובקרל לאיבר. התוצאות תוקנו על ידי יישום גורם כיול ולאחר מכן נורמלו על ידי נפח הגידול שמקורו ב-MRI.
לימודי Ex vivo
ניתוחים היסטופתולוגיים
לאחר השלמת כל ההדמיה, שלפוחיות השתן שנבחרו (n = 3 לקבוצה) מבעלי חיים נושאי גידול ובריאים הוסרו בתנאים אספטיים וקובעו מיד בפורמלדהיד של 4%. לאחר מכן, שלפוחיות השתן הוטבעו בפרפין לפני נטילת קטעים של 2-3 µm לצביעה של המטוקסילין-אאוזין. תמונות מייצגות התקבלו מכל התנאים לבדיקה היסטופתולוגית.
ניתוח ICP-MS
המדידות בוצעו ב-Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) בשילוב עם דגימה אוטומטית ASX-560 (CETAC Tech). לאחר השלמת כל ההדמיה, בעלי חיים נהרגו, ונבחרו שלפוחיות השתן (n = 2 לקבוצה; ארבע קבוצות) נאספו ועוכלו ב-1 ml של HNO3:HCl (תערובת 4:1). הפיזור היה מבושל עד שהאיברים נמסו לחלוטין. לאחר מכן, התמיסה צוננה לטמפרטורת החדר ונותחה באמצעות ICP-MS כדי לקבוע את ריכוז Au בכל דגימה, תוך הפיכת התוצאות לאחוזים של מינון מוזרק לכל גרם רקמה (%ID g-1).
אימונוהיסטוכימיה והדמיית מיקרוסקופיה קונפוקלית
לצורך ניתוחי אימונוהיסטוכימיה, בעלי חיים נושאי גידול קיבלו ננו-בוטים עם תווית FITC במים או 300 מ"מ אוריאה (n = 4 לקבוצה), כמתואר לעיל, עבור מחקרי PET-CT. בנוסף, חיות נושאות גידול ללא ננו-בוטים שימשו כקבוצת ביקורת (n = 2). בכל המקרים, שלפוחיות השתן נאספו, הוקפאו ונחתכו למקטעים של 10 µm שקובעו מיד ב-10% פורמלדהיד למשך 15 דקות, נשטפו עם 10 mM PBS ולאחר מכן הודגרו ב-50 mM NH4Cl ב-PBS למשך 5 דקות לפני שטיפה נוספת עם PBS. הפרמיביליזציה בוצעה עם מתנול:אצטון (1:1) למשך 5 דקות בטמפרטורת החדר ו-0.1% טריטון ב-PBS למשך 5 דקות. לאחר שטיפת PBS, הדגימות רוויות בתמיסה של 5% BSA-0.5% Tween ב-PBS למשך 15 דקות בטמפרטורת החדר והודגרו למשך שעה אחת בטמפרטורת החדר עם אנטי-FITC של עכברים (1:1, Abcam) ב-100% BSA -5% טווין. המקטעים נשטפו שלוש פעמים עם 0.5 מ"מ PBS למשך 10 דקות והודגרו למשך 5 דקות בטמפרטורת החדר עם נוגדן משני Alex Fluor 30 חמור נגד עכבר IgG (Molecular Probes, Life Technologies, 647:1) ב-1,000% BSA-5% Tween ב-PBS, נשטף שוב ב-PBS (0.5 × 3 דקות) והורכב עם ערכת ProLong נגד דהייה עם 5-diamidino-4,6-phenylindole (DAPI; Molecular Probes, Life Technologies). התמונות נרכשו עם מיקרוסקופ קונפוקאלי Leica STELLARIS 2 (UPV/EHU Scientific Park) עם הגדרות זהות לכל המקטעים: הגדלה של ×5 עם הדמיית אריחים ותפירה (בדרך כלל שדה ראייה של 10 × 4). קו לייזר וחלונות זיהוי היו 5 nm ו-405–440 nm עבור DAPI, 503 nm ו-489–494 nm עבור לייזר לבן FITC ו-602 nm ו-653–660 nm עבור לייזר Alexa836 לבן.
סליקה אופטית
לאחר זלוף עם 4% פרפורמלדהיד ו-PBS, דגימות שלפוחית השתן הוסרו וקבועו עוד יותר ב-4% פרפורמלדהיד למשך הלילה ב-4 מעלות צלזיוס, ואז הוטמעו במזרק של 5 מ"ל עם אגרוז 0.8% בנקודת התכה נמוכה כדי ליצור בלוק גלילי ולאפשר קל הרכבה בקובטת הקוורץ. הבלוק כולו התייבש בהדרגה באמצעות מתנול:H2O ב-4 מעלות צלזיוס (30%:70% למשך שעה אחת, 1%:50% למשך שעה אחת, 50%:1% למשך שעה אחת, 70%:30% למשך שעה אחת, ואז 1% מתנול למשך הלילה ושוב עבור 100 שעות) ולבסוף טבול בבנזיל אלכוהול-בנזיל בנזואט (BABB) כפתרון התאמת אינדקס השבירה להדמיה. לצורך השוואות חוץ גופיות של ננו-בוטים ירוקים של FITC עם חלקיקים אדומים מסחריים, השתמשנו בחלקיקי סיליקה ניאון אדומים ב-DiagNano (Creative Diagnostics), בקוטר 0 µm, עמידים לניקוי BABB.
Autofluorescence והדמיית sLS מקוטבת
הדמיית גיליון קלה בוצעה על MacroSPIM, מערכת מותאמת אישית להדמיה של איברים שלמים שפותחה ב-IRB ברצלונה44,45. בקצרה, דגימות מוטבעות בגוש אגרוז, מנוקים יחד עם הדוגמה ומצטלמים בתוך קובטת קוורץ. הדמיית פלואורסצנציה אוטומטית השתמשה בלייזרים ב-488, 561 או 638 ננומטר המספקים תאורה דרך עדשה גלילית כפולה אכרומטית בגודל 50 מ"מ (ACY254-050-A, Thorlabs). כדי לצמצם חפצי פסים, גיליון האור מסובב עם סורק תהודה SC-10 (EOPC) לאורך טלסקופ 4f עם G322288322 עדשות כפולה אכרומטיות 100 mm (QI Optic Photonics). פלואורסצנציה אוטומטית של רקמות נאספת באמצעות מסנני פלואורסצנטי בפס-פס או מעבר ארוך ונקלטת עם מצלמת ORCA Flash v2 (Hamamatsu Photonics). ההדמיה בוצעה ב-×9.6 עם זום ×8, עדשת ×2 ועדשת צינור ×0.6. יריעת האור הייתה משוטחת על פני שדה הראייה, והניבה 5-6 µm של רזולוציה צירית. הדמיה תלת מימדית נעשתה בשלבים של 3 µm. הדמיה של שלפוחית השתן בוצעה ב-2.5 × 2 או 3 × 3 XY אריחים, בהתאם לגודל האיבר.
הדמיית sLS הושגה על ידי הסרת מסנן הקרינה או שימוש בכל מסנן המשדר את הלייזר. סיבוב יריעות אור הפחית את רעש כתמי לייזר, וכתוצאה מכך ממוצע זמני של קוהרנטיות לייזר כפי שהוצג קודם לכן52. הכיוון של קיטוב גיליון אור ליניארי בתאורה נשלט על ידי סיבוב לוחית חצי גל (AHWP05M-600, Thorlabs) לפני סורק הציר. האות שזוהה נבחר בקיטוב באמצעות מקטב ליניארי מסתובב (LPVISC100, Thorlabs) לפני גלגל המסנן בזיהוי, מה שמציג יותר מ-50% אובדן עוצמה בזיהוי הקרינה. בעוד שחלוקת אותות sLS משתנה באופן כללי עם כיוון המקטב, האות האוטו-פלואורסצנטי של הרקמה נשאר בלתי מושפע מסיבוב המקטב. sLS מניב רזולוציה מרחבית של 2.4 ± 0.3 µm ב-BABB, אשר דומה לרזולוציה בהדמיית גיליון אור פלואורסצנטי (אשר מאושרת על ידי התאמת פונקציה גאוסית ל- XY תגובת תמונה של חלקיק בודד, איור משלים. 8 ליטר-מ') וקרוב לרזולוציה התיאורטית באוויר (1.53 µm עם צמצם מספרי (NA) = 0.2 בזום מאקרו מקסימלי ×8).
עיבוד תמונה וניתוח תלת מימד
עיבוד תמונה, פילוח וניתוח של מערכי נתונים של גיליונות אור נעשו עם ImageJ/Fiji, בעוד איורים. 3 ו 4 נוצרו עם Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) וסרטון משלים 3 נוצר עם Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). מערכי נתונים של גיליונות אור עם אריחים נתפרו עם MosaicExplorerJ53. פילוח 3D של רקמת שלפוחית השתן בוצע באמצעות פקודות מאקרו מותאמות אישית של ImageJ/Fiji עבור הערות 3D אוטומטיות למחצה של נפחים גדולים במצב וירטואלי. בקצרה, סקריפט ראשון, 'Macro1', טוען ערימות תמונות תלת-ממדיות, מאפשר הערות למשתמש על ROI במספר מישורים ומערב אוטומטית את ה-ROIs כדי ליצור ולייצא מסכות תלת-ממדיות. החזר ROI צויר כל 3 מישורים (כל 3 µm) כדי להקל על המשכיות פילוח טובה תוך שמירה על הערות למינימום סביר. סקריפט שני, 'Macro15', מבצע את הפעולות המתמטיות או הבוליאניות, מישור אחר מישור מבלי לטעון את כל הערימות לזיכרון, בין מסכות תלת ממדיות או בין מסיכת תלת מימד לנתונים המקוריים, ושומר את התוצאה כמחסנית חדשה. כל המסכות נוצרו על ידי הערת תמונות אוטומטית פלואורסצנטיות.
הן שכבות הגידול והן שכבות משטח הרקמה הבריאה (איור. 3) תוחמו באמצעות השרביט של פיג'י וכלי לאסו על חלל שלפוחית השתן במסכה. קריאת האיטרציה הראשונה הזו BC1, הריצות הבאות של Macro1 מרחיבות אוטומטית את קו המתאר התלת-ממדי הזה בכמות פיקסל מוגדרת כדי להניב איטרציות מסיכה חדשות, BC3, BC2 וכן הלאה, עם הרחבות הולכות וגדלות. השכבה הראשונה המכילה גם את הגידול וגם את הרקמה הבריאה, מסכה L3, מתקבלת על ידי הפחתת מסכה BC1 מ-BC1 וכן הלאה, מה שיוצר את L2 ו-L2 כשכבות קונצנטריות. נפח הגידול הקרוב ביותר לחלל הושג על ידי הערת הגידול בעזרת שרביט וכלי לאסו ליצירת מסכה T3, בעוד ששכבת האורותליום התלת-ממדית הבריאה זוהתה בנפרד לתוך מסכה U1. הפחתת U3 מ-L1 מניבה את שכבת פני השטח של הגידול, וכן הלאה: L1 - U1, L2 - U1. לעומת זאת, השכבה הראשונה של האורותל מתקבלת על ידי הפחתת T3 מ-L1. כל השכבות באיור. 3 הוגדרו בעובי של 33 µm.
אותה חבילה של פקודות מאקרו והליכים (כלי שרביט ImageJ, שחיקה דיגיטלית של 500 µm וכן הלאה) שימשו כדי לתחום ולפלח את החלק הפנימי של רקמת השלפוחית ולאחר מכן להעריך את נפח הרקמה הפנימית של שלפוחית השתן (איור. 4, ראה לעיל לפרטים). היסטוגרמות של עוצמת האות המפוזר נוצרו בפיג'י על ידי שילוב האות המפוזר ומסכה.
RNT באמצעות 131אני-ננובוטים
בין הימים 8 ל-15 לאחר השתלת הגידול, בעלי החיים חולקו לשש קבוצות (קבוצות 1-6), בניסיון להשיג נפחי גידול ממוצעים דומים על פני קבוצות (טבלה 2). לצורך הניסויים, בעלי חיים הושרה עם הרדמה (5% איזופלורן ב-O טהור2) וממוקם בשכיבה לפני ריקון שלפוחית השתן על ידי עיסוי אזור הבטן. מיד לאחר מכן, 100 µl מהטיפול המתאים בריכוז של 400 µg ml-1 (שולחן 2) הוחדר לשלפוחית השתן באמצעות צנתר בגודל 24. הטיפול והרכב (מים או אוריאה) נשארו בשלפוחית השתן למשך שעה אחת לפני הסרת הקטטר. שלפוחית השתן רוקנה שוב על ידי עיסוי בטן ועכברים שהתאוששו מהרדמה בכלובים שלהם, והחליפו נסורת של כלוב בעלי חיים 1 שעות לאחר הטיפול להסרת זיהום רדיואקטיבי.
יעילות טיפולית נקבעת על ידי MRI
שני מחקרי MRI בוצעו על כל עכבר: (1) בין הימים 7 ל-14 לאחר חיסון הגידול כדי לבצע אקראית של בעלי חיים בין קבוצות ולמדוד נפחי גידול ראשוניים (לפני טיפול); (2) בין הימים 16 ל-21 לאחר חיסון הגידול (אחרי טיפול) כדי להעריך יעילות טיפולית. MRI נערך באמצעות סורקי 7 T Bruker BioSpec ו-11.7 T Bruker BioSpec (שניהם עם תוכנת ParaVision 7), בהתאם לזמינות. זה לא השפיע על התוצאות מכיוון שהשדה החיצוני אינו קריטי להדמיה אנטומית14. ניסויי הדמיה נערכו תוך שימוש באותם פרמטרי הדמיה ועיבוד כפי שהוסבר לעיל (מעקב אחר גודל הגידול). במקרה של סורק 11.7 T, ההתקנה כללה סליל משטח לב של עכבר לקליטה וסליל נפחי לשידור. נפחי הגידול בכל פרוסה נקבעו מתוך כרכים שצוירו ידנית של עניין המכסים את אזור הגידול.
ניתוח סטטיסטי
במחקרי הדמיית PET, אחוזים של מינון מוזרק (% מזהה) ושל מינון מוזרק לנפח גידול (% ID ס"מ-3) הושוו באמצעות ANOVA חד כיווני. ההבדלים בין הקבוצות נקבעו באמצעות מבחן ההשוואות המרובות של Tukey. NTV במדור RNT התקבל מא t-מבחן של ערכים לא מזווגים. ההנחה הייתה שחלוקת הנתונים היא תקינה, אך הדבר לא נבדק רשמית. ניתוחים סטטיסטיים בוצעו עם GraphPad Prism v.8.
סיכום הדיווח
מידע נוסף על עיצוב המחקר זמין ב סיכום דיווח תיקי טבע מקושר למאמר זה.
- הפצת תוכן ויחסי ציבור מופעל על ידי SEO. קבל הגברה היום.
- PlatoData.Network Vertical Generative Ai. העצים את עצמך. גישה כאן.
- PlatoAiStream. Web3 Intelligence. הידע מוגבר. גישה כאן.
- PlatoESG. פחמן, קלינטק, אנרגיה, סביבה, שמש, ניהול פסולת. גישה כאן.
- PlatoHealth. מודיעין ביוטכנולוגיה וניסויים קליניים. גישה כאן.
- מקור: https://www.nature.com/articles/s41565-023-01577-y
- :הוא
- :לֹא
- ][עמ'
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- אודות
- מֵעַל
- בהתאם
- הצטברות
- להשיג
- הושג
- נרכש
- רכישה
- רכישה
- לרוחב
- מופעל
- פעיל
- פעילות
- הוסיף
- מוסיף
- בנוסף
- מנהל
- להשפיע על
- לאחר
- לאחר מכן
- שוב
- מכוון
- AIR
- AL
- alex
- אַלגוֹרִיתְם
- תעשיות
- מותר
- לאורך
- אלצהיימר
- בין
- כמות
- עמילואיד
- an
- מנתח
- אנליזה
- עוגן
- ו
- בעלי חיים
- בעלי חיים
- נוגדן
- כל
- יישומים
- יישומית
- מריחה
- מתאים
- מאושר
- אקווה
- ARE
- AREA
- מאמר
- AS
- להניח
- הנחות
- At
- רשויות
- באופן אוטומטי
- זמינות
- זמין
- מְמוּצָע
- ממוצעת
- b
- BABB
- רוחב פס
- בסיס
- BE
- לפני
- התנהגות
- להיות
- להלן
- בֵּין
- לחסום
- גוּף
- מְבוּשָׁל
- שניהם
- מוֹחַ
- ניטל
- אבל
- by
- כלובים
- מחושב
- קוראים
- חדר
- מחלת הסרטן
- מקרה
- מקרים
- CCD
- תא
- תאים
- שינויים
- תשלום
- כימי
- קרחת יער
- קליק
- קליני
- סְגוֹר
- סליל
- שילוב
- שילוב
- מסחרי
- הוועדה
- השוואה
- לעומת
- השוואות
- לחלוטין
- מַשׁלִים
- ריכוז
- מצב
- תנאים
- מנוהל
- אמון
- מְאוּשָׁר
- רצופים
- המשכיות
- ברציפות
- לִשְׁלוֹט
- נשלט
- להיפך
- קריר
- תוקן
- תיקונים
- תוֹאֵם
- המועצה
- יחד
- כיסוי
- לִיצוֹר
- נוצר
- יוצרים
- יְצִירָתִי
- הקריטריונים
- קריטי
- סריקות CT
- מנהג
- חותך
- כהה
- נתונים
- מערכי נתונים
- יְוֹם
- ימים
- de
- מוגדר
- אספקה
- תלוי
- מְתוּאָר
- עיצוב
- רצוי
- פרטים
- זוהה
- איתור
- לקבוע
- נחוש
- קביעה
- מפותח
- מכשיר
- אבחון
- DID
- הבדל
- ההבדלים
- אחר
- שידור
- דיגיטלי
- דָלִיל
- כיוון
- מַחֲלָה
- צלחת
- פיזור
- הפצה
- הפצות
- מחולק
- do
- עושה
- עשה
- מנה
- נמשך
- ירידה
- משך
- דינמי
- דינמיקה
- e
- E&T
- כל אחד
- קל
- הד
- יעילות
- או
- מוטבע
- לאפשר
- מאפשר
- נקודת קצה
- משופר
- שלם
- אנזימטית
- מְצוּיָד
- נוסד
- הקמה
- לְהַעֲרִיך
- Ether (ETH)
- אתיקה
- אֵירוֹפִּי
- להעריך
- כל
- בדיקה
- חריג
- אלא
- תוחלת
- צפוי
- לְנַסוֹת
- ניסיוני
- ניסויים
- מוסבר
- יצוא
- חיצוני
- לְהַקֵל
- גורם
- נְקֵבָה
- שדה
- תאנה
- תרשים
- ממולא
- לסנן
- מסננים
- סופי
- בסופו של דבר
- ראשון
- הוֹלֵם
- קבוע
- פלאש
- בעקבות
- הבא
- בעד
- טופס
- פורמלדהיד
- רשמית
- הָלְאָה
- ארבע
- החל מ-
- קפוא
- פונקציה
- נוסף
- פער
- ge
- GE Healthcare
- כללי
- ליצור
- נוצר
- נתינה
- טוב
- שיפועים
- גרמתי
- ירוק
- קְבוּצָה
- קבוצה
- צמיחה
- הנחיות
- יש
- he
- בְּרִיאוּת
- בריאות
- בריא
- לֵב
- HTTPS
- huang
- בן אנוש
- ICAP
- ID
- זהה
- if
- תמונה
- ניתוח תמונה
- תמונות
- הדמיה
- מיד
- שָׁקוּעַ
- משפר
- in
- כלול
- שילוב
- גדל
- דגירה
- דגירה
- דגירה
- עצמאי
- מדד
- אינדוקציה
- מידע
- בתחילה
- פְּנִימִי
- בתוך
- מכשירים
- משולב
- אינטראקטיבי
- אינטרס
- פנימי
- אל תוך
- החדרה
- איטרציה
- איטרציות
- שֶׁלָה
- KDA
- שמירה
- ערכה
- l2
- גָדוֹל
- לייזר
- לייזרים
- שכבה
- שכבות
- עזיבה
- עזבו
- Lens
- עדשות
- החיים
- אוֹר
- קו
- קשר
- צמוד
- טוען
- המון
- מקומי
- את
- מאקרו
- פקודות מאקרו
- לתחזק
- תחזוקה
- באופן ידני
- מסכה
- מבחר המסיכות
- תואם
- חוֹמֶר
- חומרים
- מתימטי
- מַטרִיצָה
- מקסימום
- אומר
- למדוד
- נמדד
- מידות
- מדידת
- מדיה
- זכרון
- מרינו
- מתנול
- שיטות
- עכברים
- מיקרוסקופ
- מיקרוסקופיה
- דקות
- מינימום
- קטין
- מעורב
- תַעֲרוֹבֶת
- ML
- סלולרי
- מצב
- מודל
- מודלים
- שונים
- מודול
- מולקולרי
- פיקוח
- ניטור
- תנועה
- עכבר
- MRI
- MS
- MT
- מספר
- ננוטכנולוגיה
- טבע
- רשתות
- נטרל
- חדש
- לא
- רעש
- נוֹרמָלִי
- מטרה
- שנצפה
- להשיג
- מושג
- of
- זקן
- on
- ONE
- פועל
- מבצעי
- תפעול
- אופטימיזציה
- or
- אורקה
- מְקוֹרִי
- יותר
- בין לילה
- אוקספורד
- חמצן
- מאמר
- פרמטרים
- פארק
- חלק
- חלקיק
- PBS
- Peg
- חֲדִירָה
- עבור
- ביצעתי
- מבצע
- חיית מחמד
- פטרי
- שלבים
- Pivot
- פיקסל
- מוצב
- מטוס
- מטוסים
- אפלטון
- מודיעין אפלטון
- אפלטון נתונים
- נקודה
- נקודות
- תיק עבודות
- עמדה
- מיקום
- דיוק
- מוּכָן
- להציג
- קוֹדֶם
- הליך
- נהלים
- תהליך
- בהדרגה
- פרוטוקול
- Qi
- כמותי
- רדיו
- אקראי
- אקראי
- דרג
- ציון
- יחס
- להגיב
- תגובה
- קורא
- סביר
- סיבות
- קיבלו
- קבלה
- מוקלט
- להחלים
- Red
- להפחית
- מופחת
- מפחית
- הפניה
- באזור
- נשאר
- שְׂרִידִים
- להסיר
- הוסר
- הסרת
- דווח
- דווח
- נציג
- נדרש
- מחקר
- עמיד בפני
- החלטה
- בהתאמה
- תגובה
- תוצאה
- וכתוצאה מכך
- תוצאות
- רובוט
- חֶדֶר
- פועל
- s
- SA
- אותו
- חסכת
- סריקות
- פזור
- SCI
- מדעי
- תסריט
- שְׁנִיָה
- משני
- סעיף
- סעיפים
- לִרְאוֹת
- קטע
- פילוח
- נבחר
- רצף
- שירת
- הגדרות
- כמה
- גיליון
- הראה
- לאותת
- הפצת אותות
- דומה
- since
- יחיד
- שישה
- מידה
- פרוסה
- קטן
- So
- נתרן
- תוכנה
- פִּתָרוֹן
- פתרונות
- מרחבית
- יציבות
- לערום
- ערימות
- סטטיסטי
- כוכבים
- צעדים
- מאוחסן
- פס
- סטודנט
- מחקרים
- לאחר מכן
- כתוצאה מכך
- מערכת
- משטח
- תסמינים
- סינתזה
- מערכת
- T
- T1
- שולחן
- נטילת
- טק
- טכנולוגיות
- טלסקופ
- תבנית
- עשר
- מבחן
- נבדק
- זֶה
- השמיים
- שֶׁלָהֶם
- אותם
- אז
- תיאורטי
- רפואי
- תרפיה
- זֶה
- בִּיסוֹדִיוּת
- אלה
- שְׁלוֹשָׁה
- תלת-ממדי
- דרך
- בכל
- זמן
- פִּי
- רקמה
- ל
- יַחַד
- כלי
- כלים
- סה"כ
- לקראת
- לקראת
- הפיכה
- טיפול
- טריטון
- מנסה
- גידולים
- שתיים
- סוג
- בדרך כלל
- לא מושפע
- תחת
- עד
- על
- מְשׁוּמָשׁ
- משתמש
- באמצעות
- ערכים
- רכב
- נגד
- באמצעות
- וִידֵאוֹ
- וידאו
- לצפיה
- וירטואלי
- לחזות
- vivo
- כֶּרֶך
- כרכים
- נפח
- הליכון
- שרביט
- היה
- כביסה
- מים
- we
- שבועות
- מִשׁקָל
- סעד
- היו
- גַלגַל
- אשר
- בזמן
- לבן
- חלונות
- עם
- בתוך
- לְלֹא
- X
- תְשׁוּאָה
- מותר
- תשואות
- זפירנט
- זום