Tutti i reagenti sono stati utilizzati così come ricevuti, salvo diversa indicazione. Tutti i prodotti chimici sono stati acquistati da Sigma Aldrich ad eccezione delle sfere di conteggio (CountBright Absolute Counting Beads, Invitrogen). ζ-Il potenziale è stato misurato utilizzando uno Zetasizer NanoZS90 (Malvern Instruments). Le dimensioni e la morfologia delle particelle sono state studiate mediante SEM in un microscopio JEOL JSM 7800F Prime con EDS integrato per fornire l'analisi elementare. La dimensione delle particelle è stata determinata misurando 50 particelle indipendenti. La cromatografia radio istantanea su strato sottile (ITLC) è stata sviluppata su carta per cromatografia in microfibra di vetro Agilent Technologies impregnata con acido silicico e analizzata utilizzando uno scanner TLC Lablogic Flow-count e un rilevatore di tubi fotomoltiplicatori (PMT) BioScan B-FC-3200 utilizzando il software Laura. La fase mobile ITLC era composta da 0.175 M di acido citrico e 0.325 M di citrato trisodico in acqua, salvo diversa indicazione. I campioni radioattivi sono stati misurati utilizzando un Capintec CRC-25R (Capintec) o un LKB Wallac 1282 Compugamma CS (PerkinElmer) per i quali i dati sono stati raccolti utilizzando il software EdenTerm. Gli esperimenti di citometria a flusso sono stati condotti in un selezionatore di cellule BD FACSMelody utilizzando il software BD FACSChorus. Le immagini PET/CT sono state acquisite utilizzando uno scanner NanoPET/CT (Mediso), ricostruite utilizzando il software Nucline v.0.21 e le immagini sono state analizzate utilizzando il software VivoQuant (versione 3.5, InviCRO). I dati Listmode sono stati ottenuti da uno specifico strumento software MATLAB sviluppato da Mediso. L'autoradiografia è stata eseguita in uno strumento GE Amersham Typhoon.
Sintesi di particelle di silice di dimensioni submicrometriche
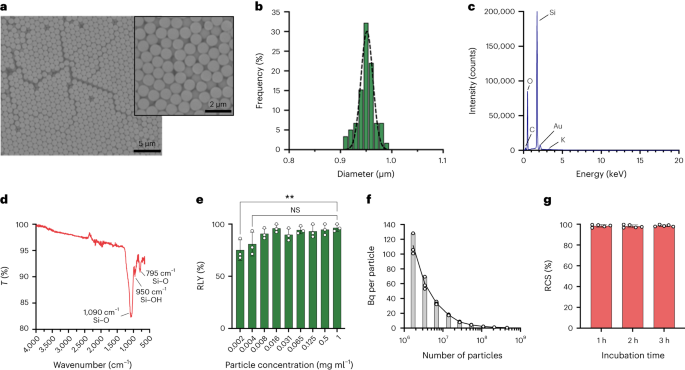
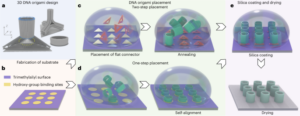
Le particelle sono state sintetizzate utilizzando il metodo Stöber. Questo metodo si basa sull'idrolisi e sulla condensazione consecutiva di alcossidi di silicio per produrre particelle di silice sferiche monodisperse27. Come fonte di silicio è stato utilizzato il tetraetil ortosilicato (TEOS), l'ammoniaca come catalizzatore di base e il cloruro di potassio come elettrolita. Una soluzione di TEOS in etanolo è stata aggiunta in continuo ad una soluzione contenente il catalizzatore e l'elettrolita. La modifica della quantità iniziale del reagente o della velocità di aggiunta fornisce differenze nella dimensione delle particelle come riportato in precedenza28. Qui, sono state preparate due soluzioni prima della sintesi delle particelle: Soluzione 1 contenente 19.0 mmol di TEOS in 33.3 ml di EtOH e Soluzione 2 contenente 0.23 mmol di KCl in 9 ml di ammoniaca, 65 ml di EtOH e 6.75 ml di H2O. Per la sintesi, la Soluzione 2 è stata posta in un pallone a fondo tondo da 250 ml riscaldato a 50 °C sotto agitazione a 300 rpm per 15 min. Quindi, la Soluzione 1 è stata aggiunta goccia a goccia alla Soluzione 2 (velocità di fornitura 0.2 ml min-1). Dopo l'aggiunta della Soluzione 1, le particelle ottenute sono state purificate mediante centrifugazione a 18,300g per 3 minuti e lavato con EtOH cinque volte. Infine, il SiO2 le microparticelle sono state essiccate sotto vuoto.
Innesto delle particelle di dimensioni submicrometriche con silano-PEG5k
Una dose da 20 mg ml-1 soluzione di silano-PEG5k (Sigma Aldrich) in EtOH al 98% è stato aggiunto su una soluzione di smSiP a 5 mg ml-1 in EtOH 98% e 2.8% di ammoniaca. La miscela è stata agitata per una notte a temperatura ambiente e le particelle sono state recuperate mediante centrifugazione a 18,300g per 3 minuti Infine, le particelle sono state lavate tre volte con acqua distillata ed essiccate sotto vuoto per una notte. Le soluzioni di lavaggio sono state liofilizzate durante la notte e la quantità di silano-PEG non attaccato5k ponderato per il calcolo della resa della reazione. A 0.05 mg ml-1 soluzione di smSiP–PEG5k in acqua distillata è stato impiegato per ulteriori reazioni di radiomarcatura.
[68Ga]GaCl3
Il gallio-68 è stato eluito come [68Ga]GaCl3 da un Eckert e Ziegler 68Ge /68Generatore di Ga in HCl ultrapuro (4 ml, 0.1 M) prodotto secondo i requisiti delle buone pratiche di produzione (ABX).
Concentrazione del [68Ga]GaCl3 eluizione mediante scambio cationico
La concentrazione dell'eluizione è stata effettuata utilizzando la configurazione descritta nella Figura supplementare. 1. Innanzitutto, i 4 ml del [68Ga]GaCl3 le eluizioni sono state caricate su una cartuccia Strata-X-C 33u (Phenomenex) e l'eluato è stato scartato. Quindi, la cartuccia è stata lavata con 5 ml di una soluzione di acetone/HCl 0.1 M (80:20) e l'eluato è stato scartato. Infine, il concentrato [68Ga]GaCl3 è stata raccolta aggiungendo 700 µl di una soluzione di acetone/HCl 0.05 M (98:2), essiccata sotto N2 flusso e risospeso in 50 µl di tampone HEPES 0.5 M (pH 4.9). La radio-TLC è stata eseguita nelle diverse fasi per il controllo di qualità. Il protocollo richiede circa 20 min fornendo una resa di recupero di 86.2 ± 8.5%.
Radiomarcatura di particelle di silice a diverse concentrazioni con 68Ga
Le particelle di silice sono state risospese a diverse concentrazioni (da 1 a 0.002 mg ml-1) in tampone HEPES 0.5 M (pH 4.9). Quindi, 50 µl della soluzione sono stati aggiunti in una provetta di reazione prima dell'aggiunta della soluzione concentrata [68Ga]GaCl3 eluizione in 50 µl di tampone HEPES 0.5 M (pH 4.9). Le reazioni sono state condotte a 90°C per 30°min ed è stata effettuata la radio-TLC per calcolare la resa radiochimica.
Misurazione della concentrazione di particelle mediante citometria a flusso
Le concentrazioni di particelle sono state calcolate mediante citometria a flusso utilizzando sfere di conteggio (CountBright Absolute Counting Beads, Invitrogen) seguendo le istruzioni del produttore. Le particelle di silice sono state risospese a 0.05 mg ml-1, sonicato per 10 min e fatto passare attraverso un filtro con dimensione di cut-off di 10 μm (filtro per siringa KX, nylon, 25 mm, 10 μm). Le microsfere per conteggio assoluto CountBright sono state riscaldate a temperatura ambiente e vortexate per 30 secondi. Quindi, 50 µl di sfere sono stati aggiunti a 300 µl di particelle di silice e la miscela è stata agitata in vortex per 30 µl per ottenere una soluzione omogenea. Il campione è stato analizzato sul citometro a flusso e la soglia di dispersione diretta (FSC) è stata impostata per includere le sfere e le particelle sul grafico di dispersione lineare-FSC rispetto a quello lineare-laterale. Successivamente, la tensione del rilevatore di fluorescenza è stata regolata per le sfere di conteggio ed è stata eseguita una strategia di gating per isolare le particelle di silice e le popolazioni di sfere di conteggio. Infine, sono stati disegnati i gate sulle particelle e sulle sfere di conteggio assoluto e sono stati registrati 1,000 eventi di sfere per ciascun campione. Utilizzando questa strategia, il numero di particelle in soluzione è stato calcolato utilizzando la seguente equazione:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Particelle}},{mathrm{conteggio}},volte,{mathrm{Conteggio}},{mathrm{perline}},{mathrm{volume}})}{({mathrm{Conteggio}},{mathrm{perline}} ,{mathrm{conteggio}},volte,{mathrm{Particelle}},{mathrm{volume}})} volte,{mathrm{Conteggio}},{mathrm{perline}},{mathrm{concentrazione}}sinistra(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Radiomarcatura di 500 smSiP
Cinquecento smSiP sono stati aggiunti a 50 µl di soluzione concentrata [68Ga]GaCl3 eluizione in tampone HEPES 0.5 M pH 4.9. Quindi sono stati aggiunti 5.6 µl di polisorbato 80 e la miscela è stata riscaldata a 90 °C per 30 min a 900 giri al minuto in un miscelatore termico. Successivamente, è stato progettato un protocollo finale di purificazione multifase per rimuovere la sostanza colloidale/non reagita 68Ga. Sono stati aggiunti cinquanta microlitri di EDTA 10 mM e la miscela è stata incubata per 5 minuti a temperatura ambiente. Quindi, le particelle sono state centrifugate per 3 minuti a 18,300g, risospesi in 500 µl di PBS contenente EDTA 1 mM + 0.1% di polisorbato 80 e delicatamente agitati nel vortex per 10 s. Le particelle sono state nuovamente centrifugate, lavate con una soluzione di EDTA 0.1 mM + polisorbato 0.1 80% in PBS e vortexate delicatamente per 10 s. Infine, le particelle sono state centrifugate e lavate altre cinque volte con PBS + 0.1% di polisorbato 80 e risospese in 500 µl di PBS. La reazione di radiomarcatura è stata monitorata mediante radio-TLC durante le successive fasi di reazione per valutare la presenza di colloidi (che possono essere confusi con particelle se non rimossi adeguatamente), la radiomarcatura delle particelle e la purezza del prodotto finale. L'RLY è stato calcolato confrontando la quantità di radioattività nelle particelle e nei surnatanti dopo le fasi di lavaggio.
frazionamento
Per la strategia di frazionamento, volumi da 0.5 μl a 20 μl del 68Ga-smSiP ad una concentrazione teorica di 1 particella μl-1 sono stati aggiunti in diverse provette campione in passaggi da 1 μl (0.5, 1, 2, 3…) ed è stato aggiunto PBS per portare il volume finale a 50 μl. Quindi, 37.5 µl della prima provetta sono stati pipettati in una seconda provetta per campioni, 25 µl della seconda provetta in una terza provetta e infine 12.5 µl della terza provetta in una quarta provetta. Questa strategia fornisce quattro provette per campione con un volume finale di 12.5 μl per provetta. La radioattività in ciascuna provetta è stata misurata in un contatore gamma e i valori sono stati calcolati in kBq utilizzando una curva di calibrazione, per ulteriori confronti e analisi. I campioni contenenti la maggior parte della radioattività in una sola provetta sono stati sonicati per 30 secondi a temperatura ambiente e sottoposti ad una seconda fase di frazionamento. Quindi, i campioni in cui tutta la radioattività è stata trovata in un unico tubo (con attività trascurabile negli altri tre tubi) sono stati utilizzati per ulteriori esperimenti in vivo/ex vivo.
Imaging fantasma PET/CT
Con uno di essi è stato effettuato un esperimento di imaging fantasma 68Ga-smSiP. È stata utilizzata una cannula per erogare la particella in una provetta per campione per valutare se una singola particella potesse rimanere intrappolata nel tubo della cannula durante la somministrazione. In breve, il tubo fantasma è stato posizionato nello scanner nanoPET/CT con l'estremità della punta della cannula fissata al tubo. Dopo aver avviato l'acquisizione PET, la particella risospesa in 100 µl di PBS è stata erogata con una siringa da insulina fissata all'inizio della cannula. Quindi, la cannula è stata lavata con 50 µl di PBS per garantire l'erogazione della particella nel tubo fantasma. L'acquisizione PET è stata effettuata per 2 h seguita da una scansione TC standard.
Imaging PET/CT in vivo
Gli studi di imaging sugli animali sono stati esaminati eticamente e condotti in conformità con le normative del Ministero degli Interni britannico del 1986 (ASPA) sugli animali (procedure scientifiche) che regolano la sperimentazione sugli animali. L'imaging in vivo è stato condotto in topi BALB/c sani di 8 settimane. Gli animali sono stati anestetizzati con isoflurano (2-3% in ossigeno), cannulati e posizionati sul letto dello scanner sotto anestesia. Il letto è stato riscaldato a 37 °C mediante flusso d'aria interno per mantenere l'animale alla normale temperatura corporea e la frequenza respiratoria è stata monitorata e mantenuta a 60–80 respiri min-1 durante tutta la scansione. Mantenere il controllo sulla temperatura dell'animale è importante, poiché un calo inaspettato della temperatura potrebbe portare a una riduzione della velocità delle particelle nel sangue. Uno 68Gas-smSiP (n = 4) o 68Ga-smSiP–PEG5k particella (n = 2) è stato somministrato attraverso la cannula in 100 μl di PBS, seguito da lavaggio con 50 μl di PBS dopo l'avvio dell'acquisizione PET (modalità coincidenza 1:5; finestra temporale di coincidenza 5 ns). La PET è stata registrata per 2 h, quindi è stata eseguita una scansione TC semicircolare. Durante l'intero processo sono state monitorate la temperatura corporea e la frequenza respiratoria degli animali. Le immagini PET/CT dinamiche sono state ricostruite utilizzando la ricostruzione 3D Tera-Tomo (finestra di energia 400–600 keV, modalità coincidenza 1:5, 20 iterazioni e 1 sottoinsieme) con una dimensione voxel di 0.4 × 0.4 × 0.4 mm3 e corretto per attenuazione, dispersione e decadimento. È possibile trovare i dati in modalità elenco per tutte le acquisizioni PET/PEPT 68Ga-smSiP al rif. 29 e per 68Ga-smSiP–PEG5k al rif. 30.
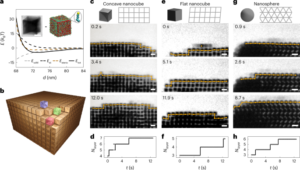
Monitoraggio in tempo reale
Innanzitutto, i dati sono stati esportati dallo scanner in formato listmode (ovvero un formato con un timestamp e un indice dei cristalli per i fotoni di coincidenza rilevati). È stata applicata una trasformazione geometrica per convertire dagli indici dei cristalli alla posizione in unità mm. Il metodo Birmingham calcola iterativamente l'MDP da un sottoinsieme di tutti i LoR. Lo fa scartando i LoR che sono più lontani di una distanza prestabilita dall'MDP poiché è probabile che derivino da falsi LoR, ad esempio, LoR che potrebbero avere origine da scatter. L'MDP viene perfezionato ad ogni iterazione; il numero di iterazioni è effettivamente impostato da f-fattore e si riferisce al numero totale di LoR utilizzati per stimare la posizione finale delle particelle all'interno di quel sottoinsieme (ad esempio, un f-fattore pari a 0.5 significa che il ciclo di iterazione terminerà quando rimane il 50% dei LoR nel sottoinsieme). Il numero di LoR utilizzati in un sottoinsieme può essere ridotto per migliorare il campionamento temporale (i sottoinsiemi sono consecutivi nel tempo senza sovrapposizioni) al costo di aumentare l'incertezza nella posizione (ulteriori dettagli dell'algoritmo possono essere trovati in Parker et al.5) Il metodo Birmingham è stato utilizzato per analizzare i dati in modalità elenco dallo scanner PET. Per tracciare la particella nei topi è stata utilizzata una dimensione del campione adattativa. La dimensione del campione è stata impostata per raggiungere un equilibrio di campionamento temporale sufficiente riducendo al minimo gli errori di posizionamento. Nelle prime fasi delle scansioni è stata utilizzata una dimensione del campione compresa tra 100 e 200 LoR (<60 s dall'inizio della scansione), con f = 0.1, ottenendo intervalli di circa 1–5 s. Con tempi di scansione > 60 , le dimensioni dei campioni variavano tra 1,000 e 2,000, il che ha prodotto intervalli di tempo compresi tra 30 e 60 a seconda dell'esperimento in vivo. Il numero di conteggi utilizzati per calcolare l'MDP (nell'iterazione finale) può essere trovato moltiplicando la dimensione del campione per il f-valore del fattore. Questi parametri erano basati su esperienze precedenti e informati da pubblicazioni precedenti1.
La velocità è stata ottenuta come (quadrato{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) where ({v}_{m}^{2}) è la velocità nel x, y ed z indicazioni.
Assorbimento d'organo ex vivo
L'assorbimento in diversi organi è stato valutato mediante conteggio gamma. Dopo l'imaging PET/CT in vivo, gli animali sono stati uccisi mediante dislocazione cervicale e gli organi sono stati asportati e pesati per il conteggio della radioattività in un contatore gamma (LKB Wallac 1282 Compugamma CS). I dati sono stati espressi come percentuale di dose iniettata (dose nell'organo/dose totale iniettata) per grammo di tessuto (%ID g-1).
Autoradiografia
La radioattività nei polmoni è stata tracciata con un rilevatore di radiazioni (sonda EP15, Morgan) e i polmoni sono stati tagliati in piccole sezioni con un bisturi fino ad ottenere una piccola porzione di tessuto con il segnale radioattivo. Il tessuto è stato congelato istantaneamente in isopropanolo a -80 °C. Immediatamente dopo il congelamento, il tessuto è stato incorporato in un mezzo a temperatura di taglio ottimale e tagliato in un criostato in fette da 20 µm. Ogni fetta è stata esaminata con il rilevatore finché non è stata trovata la fetta radioattiva. La fetta precedente (sotto lo sfondo), radioattiva e successiva (sotto lo sfondo) sono state posizionate su un vetrino per microscopio Superfrost (Epredia). Anche il resto del tessuto rimanente era sotto lo sfondo. Il vetrino da microscopio con le tre sezioni è stato coperto con pellicola trasparente e posto di fronte ad una lastra per autoradiografia GE durante la notte. La piastra è stata analizzata utilizzando GE Amersham Typhoon con una risoluzione di 25 µm e un'impostazione PMT di 4,000. L'immagine autoradiografica è stata sovrapposta all'immagine del tessuto, mostrando un punto di radioattività nella fetta radioattiva. Per la quantificazione, gli standard sono stati preparati in diverse attività note e ciascuno è stato individuato come quintetto da 1 μl su carta. Gli spot sono stati incubati nello stesso schermo di fosforo di stoccaggio, BAS-IP MS (Multifunction Standard) di GE mentre venivano quantificate le singole particelle. L'immagine è stata acquisita con l'Amersham Typhoon 5 con il software di controllo versione 2.0 in modalità fosforo con una dimensione pixel di 100 μm e una sensibilità di 4,000. Le immagini sono state quantificate con il software ImageQantTL v10.0-261 utilizzando la casella degli strumenti di quantificazione del gel. Le macchie sono state corrette scegliendo una regione immediatamente prima o dopo la macchia come sfondo costante. Il volume risultante dello spot è stato utilizzato per calcolare il Bq nella particella sulla base della curva di calibrazione.
Statistica e riproducibilità
Per l'analisi quantitativa, sono state analizzate un minimo di tre repliche biologiche escludendo i dati in vivo di 68Ga-smSiP–PEG5k (n = 2). I dati sono stati analizzati mediante l’analisi ordinaria della varianza unidirezionale (ANOVA) con il test dei confronti multipli di Dunnett e quello di Student. t-test. UN P il valore <0.05 è stato considerato statisticamente significativo.
- Distribuzione di contenuti basati su SEO e PR. Ricevi amplificazione oggi.
- PlatoData.Network Generativo verticale Ai. Potenzia te stesso. Accedi qui.
- PlatoAiStream. Intelligenza Web3. Conoscenza amplificata. Accedi qui.
- PlatoneESG. Carbonio, Tecnologia pulita, Energia, Ambiente, Solare, Gestione dei rifiuti. Accedi qui.
- Platone Salute. Intelligence sulle biotecnologie e sulle sperimentazioni cliniche. Accedi qui.
- Fonte: https://www.nature.com/articles/s41565-023-01589-8
- :È
- :non
- :Dove
- ][P
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Assoluta
- accordo
- Raggiungere
- acquisito
- acquisizione
- acquisizioni
- Legge
- attività
- attività
- adattabile
- aggiunto
- l'aggiunta di
- aggiunta
- Rettificato
- amministrato
- amministrazione
- avanzamenti
- Dopo shavasana, sedersi in silenzio; saluti;
- dopo
- ancora
- ARIA
- AL
- algoritmo
- Tutti
- anche
- Ammoniaca
- quantità
- an
- analizzare
- .
- Presentatrice
- ed
- animali
- animali
- applicato
- circa
- SONO
- sorgere
- AS
- At
- b
- sfondo
- Equilibrio
- base
- basato
- base
- BD
- BE
- prima
- Inizio
- sotto
- fra
- Birmingham
- sangue
- stile di vita
- brevemente
- portare
- bufferizzare
- by
- calcolare
- calcolato
- calcola
- calcolo
- Materiale
- svolta
- Catalizzatore
- cella
- chimico
- la scelta
- clicca
- coincidenza
- confronto
- confronto
- composto
- concentrato
- concentrazione
- condotto
- confuso
- consecutivo
- considerato
- costante
- continuamente
- di controllo
- controllata
- convertire
- corretto
- Costo
- potuto
- contatore
- conteggio
- coperto
- Cristallo
- cs
- curva
- taglio
- taglio
- dati
- consegnare
- consegnato
- consegna
- Dipendente
- descritta
- progettato
- dettagli
- rilevato
- determinato
- sviluppato
- differenze
- diverso
- itinerario
- lussazione
- distanza
- effettua
- dose
- disegnato
- Cadere
- durante
- dinamico
- e
- E&T
- ogni
- Presto
- in maniera efficace
- elettrolito
- incorporato
- emissione
- occupato
- fine
- energia
- Ingegneria
- garantire
- usate
- errori
- stima
- Etere (ETH)
- valutare
- valutato
- eventi
- esempio
- Tranne
- esclusa
- esperienza
- esperimento
- esperimenti
- espresso
- falso
- Fico
- Film
- filtro
- finale
- Infine
- Nome
- cinque
- flusso
- seguito
- i seguenti
- Nel
- formato
- Avanti
- essere trovato
- quattro
- Quarto
- congelamento
- da
- congelati
- FSC
- ulteriormente
- Gates
- ge
- generatore
- vetro.
- buono
- governo
- Grammo
- Crescita
- sano
- qui
- Casa
- Home Office
- HTTPS
- if
- Immagine
- immagini
- Imaging
- subito
- importante
- competenze
- in
- includere
- crescente
- incubato
- studente indipendente
- Index
- Indici
- informati
- immediato
- istruzioni
- strumento
- strumenti
- integrato
- Interfaccia
- interno
- ai miglioramenti
- IT
- iterazione
- iterazioni
- mantenere
- conosciuto
- Kx
- portare
- probabile
- LINK
- Polmoni
- mantenimento
- manufatto
- consigliato per la
- materiale
- Maggio..
- si intende
- misurato
- di misura
- medie
- metodo
- metodi
- topi
- micron
- Microscopio
- verbale
- minimizzando
- ordine
- di mischiare
- miscela
- ML
- Mobile
- Moda
- monitorati
- Scopri di più
- Morgan
- maggior parte
- MS
- multiplo
- moltiplicando
- nanotecnologia
- Natura
- GENERAZIONE
- no
- normale
- numero
- ottenere
- ottenuto
- of
- Office
- on
- ONE
- esclusivamente
- opposto
- ottimale
- or
- ordinario
- Altro
- altrimenti
- su
- ancora
- per una notte
- Oxygen
- Carta
- parametri
- particella
- Passato
- PBS
- per
- percentuale
- eseguita
- animale domestico
- fantasma
- fase
- fotone
- immagine
- pixel
- posto
- Platone
- Platone Data Intelligence
- PlatoneDati
- popolazioni
- porzione
- posizione
- posizionamento
- positrone
- pratica
- preparato
- presenza
- precedente
- in precedenza
- premio
- Precedente
- sonda
- procedure
- processi
- produrre
- Prodotto
- propriamente
- protocollo
- fornire
- fornisce
- fornitura
- acquistati
- qualità
- quantificazione
- quantitativo
- quantità
- R
- Radiazione
- radio
- gamma
- tasso
- reazione
- reazioni
- tempo reale
- ricevuto
- recente
- registrato
- recupero
- Ridotto
- riduzione
- riferimento
- raffinato
- regione
- normativa
- riferisce
- rimanere
- rimanente
- rimuovere
- rimosso
- replica
- Requisiti
- Risoluzione
- REST
- risultante
- recensioni
- rivisto
- Prenotazione sale
- Correre
- s
- stesso
- scansione
- scansione
- scansioni
- SCI
- scientifico
- allo
- Secondo
- secondo
- sezioni
- SEM
- Sensibilità
- set
- regolazione
- flessibile.
- mostra
- Sigma
- Signal
- significativa
- Silicio
- singolo
- Taglia
- Dimensioni
- Taglia
- scivolo
- piccole
- Scatto
- Software
- soluzione
- Soluzioni
- Fonte
- specifico
- Spot
- spot
- tappe
- Standard
- standard
- inizia a
- Di partenza
- ha dichiarato
- statisticamente
- step
- Passi
- conservazione
- Strategia
- ruscello
- studiato
- studi
- Studiando
- sufficiente
- fornire
- intervistati
- sintesi
- prende
- per l'esame
- Tecnologie
- test
- di
- che
- Il
- poi
- teorico
- termico
- Strumenti Bowman per analizzare le seguenti finiture:
- Terza
- questo
- tre
- soglia
- Attraverso
- per tutto
- tempo
- volte
- timestamp
- tipo
- fazzoletto di carta
- a
- Strumenti
- Totale
- pista
- Tracking
- Trasformazione
- intrappolati
- seconda
- Uk
- Incertezza
- per
- Inaspettato
- unità
- fino a quando
- utilizzato
- utilizzando
- Vuoto
- APPREZZIAMO
- Valori
- Velocità
- versione
- contro
- vivo
- Tensione
- volume
- volumi
- voxel
- W
- Prima
- lavaggio
- Water
- sono stati
- quando
- se
- quale
- while
- tutto
- volere
- finestra
- con
- entro
- dare la precedenza
- dato
- cedevole
- zefiro
- Codice postale