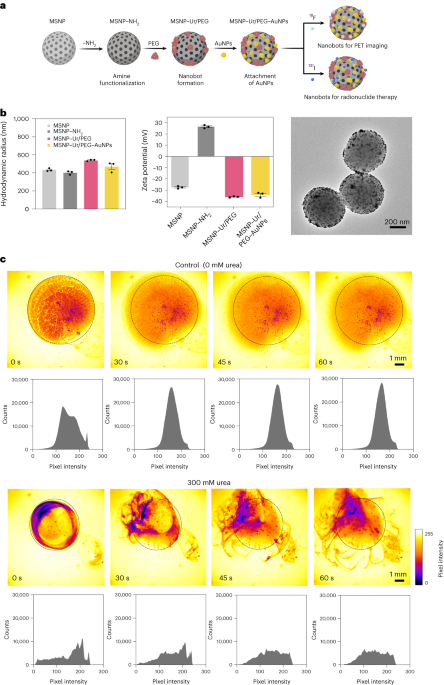
Nanobot szintézis
A nanobotokat a korábban leírtak szerint készítettük el33. Röviden, az MSNP-ket módosított Stöber-módszerrel szintetizálták41trietanol-amint (35 g), ultratiszta vizet (20 ml) és hexadecil-trimetil-ammónium-bromidot (CTAB; 570 mg) reagáltat 95 C-on 30 percig keverés közben. Ezt követően tetraetil-ortoszilikátot (1.5 ml) csepegtetünk hozzá; az elegyet 2 órán keresztül 95 °C-on reagálni hagyjuk, majd a kapott MSNP-ket centrifugálással összegyűjtjük, és etanolban mossuk (háromszor, 2,500g, 5 perc). A CTAB templát eltávolításához az MSNP-ket savas metanolban (1.8 ml HCl, 30 ml metanol) visszafolyató hűtő alatt forraljuk 24 órán át. Ezután az MSNP-ket centrifugálással összegyűjtöttük, és háromszor mostuk etanolban (2,500g, 5 perc), mielőtt amin-módosítást építettünk be az MSNP-khez (6 mg ml) APTES-t (1 µl/mg MSNP) adva.-1) 70%-os etanolos oldatban 70°C-on, erőteljes keverés közben 1 órán át. MSNPs-NH2 összegyűjtöttük, és centrifugálással háromszor etanolban és háromszor vízzel mostuk (háromszor 1,150g, 5 perc). MSNPs-NH2 PBS-ben újraszuszpendáltuk 1 mg-os koncentrációban-1 és teljes térfogata 900 µl, és glutáraldehiddel (100 µl) aktiválva 2.5 órán át szobahőmérsékleten. Az aktivált MSNP-NH2 összegyűjtöttük és háromszor mostuk PBS-ben centrifugálással (1,150g, 5 perc), ureáz oldatban (3 mg ml) újraszuszpendálva-1) és heterobifunkcionális PEG (1 μg PEG/mg 5 kDa HS-MSNPs-NH2) PBS-ben, és 24 órán át szobahőmérsékleten reagáltatjuk. A kapott nanobotokat ezután összegyűjtöttük és háromszor mostuk PBS-ben centrifugálással (1,150g, 5 perc), mielőtt a korábban leírtak szerint elkészített AuNP-k diszperziójában újraszuszpendálnák őket.5110 percen keresztül reagálnak, majd centrifugálással alaposan mossuk (háromszor, 1,150g, 5 perc).
Az MSNP-k hidrodinamikai méreteloszlása és felületi töltése, MSNP-NH2, a nanobotokat és az AuNP-díszített nanobotokat Wyatt Mobius dinamikus fényszórási rendszerrel, illetve Malvern Zetasizerrel határoztuk meg. A koncentráció minden esetben 20 µg ml volt-1 és a felvételi idő 5 s, kísérletenként három futtatással. Részecsketípusonként három mérést végeztünk.
FITC MSNP-k szintézise
FITC (2 mg), etanol (5 ml) és APTES (400µl) keverékét állítottuk elő, és 30 percig kevertük. Ezután a korábban leírt MSNP szintézis protokollt követtük, azzal a különbséggel, hogy tetraetil-ortoszilikátot (1.25 ml) cseppenként adtunk hozzá a FITC-APTES keverékkel (250 µl) kombinálva. A FITC-jelölt nanobotok funkcionalizálásának lépései a fent említettek voltak.
Az AuNP-k szintézise
Az AuNP-ket egy közölt módszerrel szintetizálták33. Röviden, minden anyagot frissen készített aqua regia segítségével tisztítottak meg, alaposan leöblítettek vízzel és levegőn szárították. Ezt követően 1 mM AuCl4 Az oldatot forráspontig melegítjük keverés közben egy visszafolyórendszerbe integrált gömblombikban. Ezt követően 10 ml nátrium-citrát oldatot (30.8 mM) adtunk hozzá, és az oldatot 20 percig forraltuk, ami vörös színt eredményezett. Az oldatot ezután hagyjuk szobahőmérsékletre hűlni, miközben 1 órán át keverjük. A kapott AuNP-ket sötétben tároltuk, és a jellemzést transzmissziós elektronmikroszkóppal végeztük.
Enzimatikus aktivitás
A nanobotok enzimatikus aktivitása, 18F-nanobotok és 131Az I-nanobotokat fenolvörös segítségével mértük. Ehhez 2 µl nanobotot (1 mg ml-1) 96 lyukú lemezre adtuk, és 200 µl különböző karbamid oldattal (0, 50, 100, 200 mM) 1.1 mM fenolvörösben kevertük össze. Az abszorbanciát 560 nm-en mértük az idő függvényében 37 °C-on.
Nanobot mozgásdinamika optikai mikroszkóppal
A nanobotokról készült optikai videókat Leica Thunder mikroszkóp segítségével készítettük, amelyhez egy Hamamatsu nagysebességű CCD-kamerát és egy ×1.25-ös objektívet csatlakoztattak. Ehhez a nanobotokat centrifugáltuk, és 50 µl PBS-ben (végső koncentráció 20 mg ml) újraszuszpendáltuk.-1). Ezután egy Petri-csészét megtöltöttünk 3 ml PBS-sel vagy 300 mM-os karbamid-oldattal (PBS-ben), és mikroszkóp alatt megfigyeltük. 5 µl-es csepp nanobotokkal (20 mg ml-1) hozzáadtuk a folyadékkal teli Petri-csészébe, és a videókat 25 képkocka/másodperc sebességgel rögzítettük. A ROI-kban a videó pixelintenzitás-eloszlását 15 s-os időközönként elemeztük az ImageJ szoftverrel.
Nanobotok radioaktív jelölése [18F]F-PyTFP
[[18F]F-PyTFP
[18Az F]F-PyTFP-t egy Neptis xSeed modulban (Optimized Radiochemical Applications) szintetizálták, egy korábban ismertetett módszert követve.33.
Szintézise 18F-jelölésű nanobotok
A nanobotokat a [18F]F-PyTFP, egy korábban kialakított eljárás alapján kisebb módosításokkal33. Röviden, 200 µl nanobot oldat (1 mg ml-1) centrifugáltuk (10 perc, 13,853 XNUMXg), 10 µl PBS-ben (1 mM, pH 8) újraszuszpendáljuk, és 4 µl [18F]F-PyTFP acetonitrilben (körülbelül 37 MBq) 35 percig szobahőmérsékleten. Inkubálás után a reakcióelegyet vízzel (200 µl) hígítottuk, és centrifugálással tisztítottuk (5 perc, 13,853 XNUMX).g). A kapott pelletet ezután háromszor vízzel öblítettük, majd egy dóziskalibrátorban (CPCRC-25R, Capintec) mértük. A radiokémiai hozamot a mosás után a nanobotokban jelenlévő radioaktivitás és a kezdeti radioaktivitás arányaként számítottuk ki. A radiokémiai tisztaság a tisztítás után ≥99% volt, amelyet rádiós vékonyréteg-kromatográfiával (radio-TLC) határoztunk meg, iTLC-SG kromatográfiás papírt (Agilent Technologies), valamint diklór-metánt és metanolt (2:1) álló és mozgó fázisként. A TLC lemezeket TLC-leolvasóval (MiniGITA, Raytest) elemeztük.
Stabilitása 18F-nanobotok
A stabilitás 18Az F-jelölt nanobotokat a következő közegekkel határoztuk meg: (1) 300 mM karbamid, (2) víz és (3) daganatos állatok vizelete. 18F-jelölt nanobotokat (10 µl) inkubáltunk a megfelelő oldattal (100µl) 1 órán át szobahőmérsékleten. Ezután a nanobotokat és a felülúszót centrifugálással elválasztottuk, összegyűjtöttük, és a radioaktivitást dóziskalibrátorban (CPCRC-25R) mértük.
Nanobotok radioaktív jelölése a 131I
Az ureáz nanobotok radiojódozását nanobotok injektálható [131I]NaI-oldat (925 MBq ml-1; GE HealthCare). Röviden: 400µl ureáz nanobot oldat (1 mg/ml)-1) centrifugáltuk (13,853 XNUMXg, 5 perc), 100 µl PBS-ben (10 mM, pH 7.4) újraszuszpendáljuk, és 25 µl vagy 185 µl injektálható [131I]NaI (körülbelül 42.55 vagy 277.5 MBq) 30 percig, a kívánt végső aktivitástól függően. Inkubálás után a reakcióelegyet centrifugálással tisztítottuk (13,853 XNUMXg, 5 perc). A kapott csapadékot háromszor mossuk vízzel (100 µl). A felülúszóban és a csapadékban lévő radioaktivitást dóziskalibrátorral (CPCRC-25R) határoztuk meg, és mindkét frakciót radio-TLC-vel elemeztük. 18F-nanobotok.
Állatmodell fejlesztés
Az egereket az Európai Tanács 2010/63/UE irányelvének és a belső iránymutatásoknak megfelelően tartották karban és kezelték. Minden kísérleti eljárást jóváhagyott a CIC biomaGUNE etikai bizottsága és a helyi hatóságok (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). A képanalízis (mind a PET, mind az MRI) az állatok csoportos megoszlását tekintve vak volt.
A húgyhólyagrák ortotopikus egérmodelljét MB49-sejtek (egérkarcinóma-hólyag-sejtvonal) intravesicalis beadásával hoztuk létre C57BL/6JRj nőstény egereknek (8 hetes, Janvier). A tumor felhalmozódásának meghatározását célzó kísérletekhez (négy csoport; részletek alább) csoportonként hat állatot oltottak be, precíziós analízissel meghatározva, a következő feltevések szerint: szükséges pontosság, 20%; várható s.d., ±20%; bizalom, 95%; állatveszteség, 20%. A terápiás hatékonysági kísérletekhez (hat csoport; részletek alább) csoportonként tíz állatot vettek fel, egyfarkú diákkal kiszámítva. t-teszt, két független átlag különbsége, a következő feltevések mellett: nullhipotézis, a kezelés nem befolyásolja a daganat növekedését; α, 0.05; 1 − β0.95; s.d., ±50%; várható különbségek a csoportok között, 50%; állatveszteség, 20%. Mivel a kísérletet működési okokból két tételben végezték, mindkét tételbe egy-egy kontrollcsoport került ( táblázat 2), majd az összes állatot egyesítettük. A daganat felállításához az egereket 3%-os tiszta O-ban lévő izoflurán belélegzésével érzéstelenítettük.2 és 1.0-1.5% izofluránnal tartjuk fenn 100% O-ban2. Ezután a húgyhólyagot kiürítettük, és kémiai elváltozásokat idéztünk elő az urotheliumon 50µl poli-l-lizin (Sigma-Aldrich) 24-es katéteren keresztül 15 percig. Ezt követően a hólyagot ismét kiürítettük, és MB49 sejteket (105 sejtek) magas glükóz tartalmú DMEM-ben (100 µl) csepegtettünk 1 órán át, mielőtt eltávolítottuk a katétert és a húgyhólyagot hasi masszázzsal kiürítettük. A kísérletek során az egereket figyelemmel kísérték, és lemértük az egészségi állapot és jólét ellenőrzését. Humán végpontot alkalmaztunk, ha a súlycsökkenés meghaladta a 20%-ot, vagy klinikai tünetek alapján, a felelős állatorvos kritériumai szerint.
A daganat méretének követése
Az MRI-vizsgálatokat 7 és 14 nappal a tumor indukciója után végezték egy 7 T Bruker BioSpec USR 70/30 szkennerrel (Bruker BioSpin), amely 12 mT m BGA-440S gradiens betéttel volt felszerelve.-1 és egy 112/086 QSN rezonátor (T12053V3) a rádiófrekvenciához14 átvitelt és egy patkány agyfelületi tekercset (T11205V3) az RF vételhez (mindkettő 300 MHz-en működik). Az állatokat izofluránnal érzéstelenítettük (4% az indukcióhoz és 1.5% a karbantartáshoz 50% O-ban2/50% N2 keverék) és MR-kompatibilis bölcsőre helyezzük. A testhőmérsékletet és a légzésszámot folyamatosan figyelték egy MR-kompatibilis megfigyelőeszközzel (1030 SA modell, Small Animal Instruments), amely egy kis rágcsálók légfűtőrendszeréhez volt csatlakoztatva a testhőmérséklet fenntartása érdekében. A referenciaképek beszerzése után spin-echo alapú diffúziós súlyozott képalkotó szekvenciát használtunk a daganatok leképezésére, a következő paraméterekkel: echo time (TE) = 22.3 ms, ismétlési idő (TR) = 2,500 ms, n = 2 átlag, egy A0 kép (alapkép a b = 0 s mm-2) és egy DW-kép, amelyet diffúziós gradiensek segítségével nyertünk az (1, 0, 0) irányban, a gradiens időtartamával δ = 4.5 ms és gradiens elválasztás Δ = 10.6 ms, így b = 650 s mm-2, egy 16 ×16 mm2 látómező, 160 × 160 pont képmátrix mérete, 20 egymást követő 0.5 mm vastag szelet (nincs rés, átlapolt módban) és pixelenként 192.9 Hz sávszélesség. A daganatok megjelenítéséhez a képeket ImageJ szoftverrel utólag feldolgoztuk, a diffúziós gradienssel kapott képeket felosztottuk (b = 650 s mm-2nélkül szerzettek által (b = 0 s mm-2), és 3D Gauss-szűrőt alkalmazva (σx = σy = σz = 0.7) az eredményhez. A daganatokat manuálisan körvonalaztuk, hogy meghatározzuk térfogatukat.
In vivo biológiai eloszlás
A tumor indukcióját követő 15. napon az egereket véletlenszerűen négy csoportba osztották, hogy a csoportok között homogén átlagos tumortérfogat-eloszlást kapjunk. A PET-CT-vizsgálatokat (MOLECUBES β és X-CUBE szkennerek) 3 órával 100 µl intravesicalis beadása után végezték. 18F-BSA (1. és 2. csoport) ill 18F-ureáz (3. és 4. csoport) nanobotok 200 µg ml koncentrációban-1, vivőanyagként vizet (1. és 3. csoport) vagy 300 mM karbamidot vízben (2. és 4. csoport) használva ( táblázat 1). A képalkotáshoz az állatokat érzéstelenítéssel (5% izoflurán tiszta oxigénben) indukáltuk, és hanyatt fektették, mielőtt a hasi régiót masszírozták a hólyag evakuálására. Közvetlenül ezután a megfelelő 18F-jelölésű nanobotok (18F-BSA/18F-ureáz vízben/karbamidban) 24-es katéteren keresztül a hólyagba csepegtettük, és 1 órán át inkubáltuk, majd eltávolítottuk a katétert, kiürítettük a hólyagot, és hagytuk, hogy az egerek felépüljenek az érzéstelenítésből. Nál nél t = 3 órával a beadás után az állatokat újra elaltattuk, és 10 perces statikus teljes testű PET-képeket készítettünk, majd CT-vizsgálatot végeztünk. A PET-képeket a 3D rendezett részhalmaz várható maximalizálási rekonstrukciós algoritmusával rekonstruáltuk véletlenszerű, szórás- és csillapítási korrekciókkal. Ugyanazon egér PET-CT képeit együtt regisztráltuk és elemeztük a PMOD képfeldolgozó eszközzel. A radioaktivitás koncentrációját az idő függvényében úgy kaptuk meg, hogy egy 3D-s kontúreszköz segítségével létrehoztunk egy érdekes térfogatot a hólyag felső régiójában, és szervenként kilobecquerelben mértük az aktivitást (a bomláskorrigált). Az eredményeket kalibrációs faktor alkalmazásával korrigáltuk, majd az MRI-ből származó tumortérfogattal normalizáltuk.
Ex vivo vizsgálatok
Szövettani elemzések
Az összes képalkotás befejezése után kiválasztott hólyagok (n = 3 csoportonként) a daganatos és egészséges állatokból aszeptikus körülmények között eltávolítottuk, és azonnal fixáltuk 4%-os formaldehidben. Ezután a hólyagokat paraffinba ágyaztuk, mielőtt 2-3 µm-es metszeteket vettünk a hematoxilin-eozin festéshez. A kórszövettani vizsgálathoz minden körülményből reprezentatív képeket kaptunk.
ICP-MS elemzés
A méréseket Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) készüléken, ASX-560 automatikus mintavevővel (CETAC Tech) kapcsoltuk. Az összes képalkotás befejezése után az állatokat leölték, és kiválasztottak a hólyagokat (n = 2 csoportonként; négy csoport) összegyűjtöttük és 1 ml HNO-ban emésztettük3:HCl (4:1 keverék). A diszperziót addig forraljuk, amíg a szervek teljesen fel nem oldódnak. Ezután az oldatot szobahőmérsékletre hűtöttük, és ICP-MS segítségével analizáltuk, hogy meghatározzuk az Au-koncentrációt az egyes mintákban, az eredményeket a szövet grammonkénti befecskendezett dózis százalékában kifejezve (%ID g).-1).
Immunhisztokémia és konfokális mikroszkópos képalkotás
Az immunhisztokémiai elemzésekhez a daganatos állatok FITC-vel jelölt nanobotokat kaptak vízben vagy 300 mM karbamidban.n = 4 csoportonként), a fent leírtak szerint a PET-CT vizsgálatokhoz. Ezenkívül a nanobot nélküli daganatos állatok kontrollcsoportként szolgáltak (n = 2). Minden esetben a hólyagokat összegyűjtöttük, lefagyasztottuk és 10 µm-es metszetekre vágtuk, amelyeket azonnal fixáltunk 10%-os formaldehidben 15 percen keresztül, mostuk 10 mM PBS-sel, majd 50 mM NH-ban inkubáltuk.4Cl PBS-ben 5 percen át, majd ismét PBS-sel öblítjük. A permeabilizálást metanol:aceton (1:1) eleggyel végeztük 5 percen keresztül szobahőmérsékleten és 0.1% Triton PBS-ben 5 percig. PBS-mosás után a mintákat 5% BSA–0.5% Tween PBS-ben készült oldatával telítettük 15 percen keresztül szobahőmérsékleten, és 1 órán át szobahőmérsékleten inkubáltuk egér anti-FITC-vel (1:100, Abcam) 5% BSA-ban. –0.5% Tween. A metszeteket háromszor mostuk 10 mM PBS-sel 5 percig, és 30 percig szobahőmérsékleten inkubáltuk Alex Fluor 647 szamár anti-egér IgG másodlagos antitesttel (Molecular Probes, Life Technologies, 1:1,000) 5% BSA–0.5% Tweenben. PBS-ben, újra mostuk PBS-ben (3 × 5 perc), és ProLong fakulásgátló készlettel szereltük fel 4,6-diamidino-2-fenil-indollal (DAPI; Molecular Probes, Life Technologies). A képeket Leica STELLARIS 5 konfokális mikroszkóppal (UPV/EHU Tudományos Park) készítettük, minden szekcióban azonos beállításokkal: 10-szeres nagyítás csempe képalkotással és varrással (jellemzően 4 × 5 látómező). A lézervonal és az észlelési ablakok 405 nm és 440–503 nm DAPI, 489 nm és 494–602 nm FITC fehér lézer, valamint 653 nm és 660–836 nm Alexa647 fehér lézer esetén.
Optikai törlés
4%-os paraformaldehiddel és PBS-sel történő perfúzió után a hólyagmintákat eltávolítottuk, majd 4%-os paraformaldehidben egy éjszakán át 4°C-on rögzítettük, majd 5%-os alacsony olvadáspontú agarózt tartalmazó 0.8 ml-es fecskendőbe ágyaztuk, hogy hengeres blokkot képezzenek, és lehetővé tegyék a könnyű kezelést. beszerelés a kvarc küvettába. Az egész blokkot fokozatosan dehidratáltuk metanol:H alkalmazásával2O 4 °C-on (30%:70% 1 órán át, 50%:50% 1 órán keresztül, 70%:30% 1 órán át, 100%:0% 1 órán át, majd 100% metanol egy éjszakán át és ismét 4 h), végül benzil-alkohol-benzil-benzoátba (BABB) merítjük, mint törésmutató-megfelelő oldatot a képalkotáshoz. A zöld FITC nanobotok és a kereskedelmi forgalomban lévő vörös részecskék in vitro összehasonlításához DiagNano (Creative Diagnostics) vörös fluoreszcens szilícium-dioxid nanorészecskéket használtunk, amelyek átmérője 1 µm, és ellenáll a BABB-tisztulásnak.
Autofluoreszcencia és polarizált sLS képalkotás
A fénylemezes képalkotást a MacroSPIM-en, az IRB Barcelonában kifejlesztett egyedi rendszeren végezték a teljes szerv tiszta leképezésére.44,45. Röviden: a mintákat agaróz blokkba ágyazzák, a mintával együtt tisztítják, és egy kvarc küvettába helyezik le. Az autofluoreszcens képalkotás során 488, 561 vagy 638 nm-es lézereket használtak, amelyek egy 50 mm-es akromatikus dupla hengeres lencsén (ACY254-050-A, Thorlabs) keresztül nyújtottak megvilágítást. A csíkos műtermékek csökkentése érdekében a fénylapot egy SC-10 (EOPC) rezonáns szkennerrel elforgatják egy 4f teleszkóp mentén, G322288322 100 mm-es akromatikus dupla lencsékkel (QI Optic Photonics). A szöveti autofluoreszcenciát sáv- vagy hosszú áteresztő fluoreszcenciás szűrőkön keresztül gyűjtik össze, és ORCA Flash v2 kamerával (Hamamatsu Photonics) rögzítik. A képalkotás × 9.6-on történt ×8-as zoommal, ×2-es objektívvel és ×0.6-os csöves objektívvel. A fénylapot a látómezőben elsimították, 5–6 µm axiális felbontást eredményezve. A 3D-s képalkotás 2.5 µm-es lépésekben készült. Az egész hólyag képalkotását 2 × 3-ban vagy 3 × 4-ben végezték. XY csempe, az orgona méretétől függően.
Az sLS képalkotást a fluoreszcens szűrő eltávolításával vagy bármely, a lézert továbbító szűrő használatával végezték. A fénylap elforgatása csökkentette a lézerfoltzajt, ami a lézer koherenciájának időbeli átlagolását eredményezi, amint azt korábban bemutattuk52. A lineáris fénylap polarizáció orientációját megvilágításban egy félhullámú lemez (AHWP05M-600, Thorlabs) elforgatásával szabályoztuk a pivot szkenner előtt. A detektált jelet polarizációban választottuk ki egy forgó lineáris polarizátor (LPVISC100, Thorlabs) segítségével a szűrőkerék detektálása előtt, ami >50%-os intenzitásveszteséget eredményezett a fluoreszcencia detektálásban. Míg az sLS jeleloszlás általában a polarizátor orientációjával változik, a szöveti autofluoreszcencia jelet nem befolyásolja a polarizátor forgása. Az sLS 2.4 ±0.3 µm térbeli felbontást ad BABB-ben, ami összevethető a fluoreszcenciás fénylapos képalkotás felbontásával (ezt egy Gauss-függvény illesztése erősíti meg XY egyetlen részecske képválasza, kiegészítő ábra. 8l-m) és közel az elméleti felbontáshoz levegőben (1.53 µm numerikus rekesznyílással (NA) = 0.2 maximális makrozoomnál ×8).
Képfeldolgozás és 3D elemzés
A képfeldolgozást, a fénylapos adatkészletek szegmentálását és elemzését az ImageJ/Fiji programmal végeztük, míg a 1-1. 3 és a 4 az Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) és kiegészítő videó 3 az Imaris 9-el lett generálva (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). A csempézett light-sheet adatkészleteket a MosaicExplorerJ-vel varrtuk össze53. A hólyagszövet 3D-s szegmentálását egyedi ImageJ/Fiji makrók segítségével végezték nagy mennyiségek félautomata 3D annotációjához virtuális módban. Röviden, az első szkript, a „Macro1”, 3D képhalmazokat tölt be, lehetővé teszi a felhasználók számára a ROI-k több síkban történő megjegyzését, és automatikusan interpolálja a ROI-kat a 3D maszkok generálásához és exportálásához. A ROI-kat 15 síkonként (minden 37.5 µm) rajzoltuk a jó szegmentálási folytonosság elősegítése érdekében, miközben az annotációkat ésszerű minimumon tartották. Egy második szkript, a „Macro2” a matematikai vagy logikai műveleteket síkról síkra hajtja végre anélkül, hogy a teljes veremeket a memóriába töltené, akár a 3D-maszkok között, akár a 3D-maszk és az eredeti adatok között, és az eredményt új veremként menti el. Az összes maszkot autofluoreszcens képek annotálásával hoztuk létre.
Mind a daganat, mind az egészséges szövet felszíni rétegei (ábra). 3). Ezt az első iterációt BC1-nek hívják, majd a Macro1 következő futtatásai automatikusan kitágítják ezt a 3D kontúrt egy meghatározott pixel mennyiséggel, hogy új maszkiterációkat kapjanak, BC2, BC3 és így tovább, növekvő dilatációkkal. A daganatot és egészséges szövetet egyaránt tartalmazó első réteget, az L1 maszkot úgy kapjuk meg, hogy a BC1 maszkot kivonjuk a BC2-ből és így tovább, így L2 és L3 koncentrikus rétegeket kapunk. Az üreghez legközelebb eső tumortérfogatot úgy kaptuk meg, hogy a daganatot pálcával és lasszó eszközökkel annotáltuk, hogy létrehozzuk a T1 maszkot, míg az egészséges urothelium 3D réteget külön detektáltuk az U1 maszkban. Ha kivonjuk az U1-et az L1-ből, megkapjuk a daganat felszíni rétegét, és így tovább: L2 − U1, L3 − U1. Ezzel szemben az urothelium első rétegét úgy kapjuk meg, hogy kivonjuk a T1-et L1-ből. ábrán látható összes réteg. 3 33 µm vastagságúak voltak.
Ugyanazt a makrót és eljárást (ImageJ pálca eszköz, 500 µm-es digitális erózió és így tovább) használták a hólyagszövet belső részének körülhatárolására és szegmentálására, majd megbecsülték a hólyag belső szövettérfogatát (XNUMX. 4, részletekért lásd fent). A szórt jel intenzitásának hisztogramjait Fidzsi-szigeteken hozták létre a szórt jel és a maszk kombinálásával.
RNT használatával 131I-nanobotok
A daganat beültetése utáni 8. és 15. nap között az állatokat hat csoportra osztották (1-6. csoportok), és igyekeztek hasonló átlagos tumortérfogatot elérni a csoportok között (táblázat). 2). A kísérletekhez az állatokat érzéstelenítéssel (5% izoflurán tiszta O-ban) indukáltuk2) és hanyatt helyezve a hólyag kiürítése előtt a hasi régió masszírozásával. Közvetlenül ezután 100 µl megfelelő kezelést 400 µg ml koncentrációban-1 (Asztal 2) 24-es katéterrel a hólyagba csepegtették. A kezelés és a vivőanyag (víz vagy karbamid) 1 órán át a hólyagban maradt a katéter eltávolítása előtt. A hólyagot hasi masszázzsal ismét kiürítettük, és az egerek ketrecükben altatásból felépültek, és 24 órával a kezelés után cserélték ki az állatok ketrecében lévő fűrészport, hogy eltávolítsák a radioaktív szennyeződést.
A terápiás hatékonyság MRI-vel meghatározott
Két MRI-vizsgálatot végeztünk minden egéren: (1) a tumor beoltása utáni 7. és 14. nap között az állatok véletlenszerű besorolására a csoportok között és a kezdeti (kezelés előtti) tumortérfogat mérésére; (2) a tumor beoltását követő 16. és 21. nap között (utókezelés) a terápiás hatékonyság értékelésére. Az MRI-t 7 T Bruker BioSpec és 11.7 T Bruker BioSpec szkennerekkel végezték (mindkettő ParaVision 7 szoftverrel), a rendelkezésre állás függvényében. Ez nem befolyásolta az eredményeket, mivel a külső mező nem kritikus az anatómiai képalkotás szempontjából14. A képalkotó kísérleteket ugyanazokkal a képalkotó paraméterekkel és feldolgozásokkal végeztük, mint a fentiekben (A daganat méretének követése). A 11.7 T szkenner esetében a beállítás egy egér szív felületi tekercséből állt a vételhez és egy térfogati tekercsből az átvitelhez. A tumor térfogatát minden szeletben a daganat területét lefedő, manuálisan megrajzolt mennyiségekből határoztuk meg.
Statisztikai analízis
A PET képalkotó vizsgálatokban az injektált dózis százalékos aránya (% ID) és az injektált dózis tumor térfogatonként (% ID cm)-3) egyutas ANOVA segítségével hasonlították össze. A csoportok közötti különbségeket Tukey többszörös összehasonlítási tesztje segítségével határoztuk meg. Az RNT szekcióban az NTV-t a t-párosítatlan értékek tesztelése. Az adatok eloszlását normálisnak feltételezték, de ezt formálisan nem tesztelték. A statisztikai elemzéseket a GraphPad Prism v.8 programmal végeztük.
Jelentési összefoglaló
A kutatástervezésről további információk a Nature Portfolio Reporting Összefoglaló ehhez a cikkhez kapcsolódik.
- SEO által támogatott tartalom és PR terjesztés. Erősödjön még ma.
- PlatoData.Network Vertical Generative Ai. Erősítse meg magát. Hozzáférés itt.
- PlatoAiStream. Web3 Intelligence. Felerősített tudás. Hozzáférés itt.
- PlatoESG. Carbon, CleanTech, Energia, Környezet, Nap, Hulladékgazdálkodás. Hozzáférés itt.
- PlatoHealth. Biotechnológiai és klinikai vizsgálatok intelligencia. Hozzáférés itt.
- Forrás: https://www.nature.com/articles/s41565-023-01577-y
- :is
- :nem
- ][p
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- Rólunk
- felett
- összhangban
- felhalmozódás
- Elérése
- elért
- szerzett
- megszerzése
- beszerzés
- át
- aktív
- aktív
- tevékenység
- hozzáadott
- hozzáadásával
- Ezen kívül
- igazgatás
- érint
- Után
- később
- újra
- célzó
- AIR
- AL
- alex
- algoritmus
- Minden termék
- megengedett
- mentén
- Alzheimer-kór
- között
- összeg
- amiloid
- an
- elemzések
- elemzés
- Horgony
- és a
- állat
- állatok
- ellenanyag
- bármilyen
- alkalmazások
- alkalmazott
- Alkalmazása
- megfelelő
- jóváhagyott
- aqua
- VANNAK
- TERÜLET
- cikkben
- AS
- feltételezte
- feltételezések
- At
- Hatóság
- automatikusan
- elérhetőség
- elérhető
- átlagos
- átlagolás
- b
- BABB
- Sávszélesség
- alap
- BE
- előtt
- viselkedés
- hogy
- lent
- között
- Blokk
- test
- főtt
- mindkét
- Agy
- teher
- de
- by
- ketrecek
- számított
- hívás
- szoba
- Rák
- eset
- esetek
- CCD
- sejt
- Cellák
- Változások
- díj
- kémiai
- Klíring
- kettyenés
- Klinikai
- közel
- tekercs
- kombináció
- kombinálása
- kereskedelmi
- bizottság
- hasonló
- képest
- összehasonlítások
- teljesen
- kitöltésével
- koncentráció
- feltétel
- Körülmények
- lefolytatott
- bizalom
- MEGERŐSÍTETT
- folyamatos
- folytonosság
- folyamatosan
- ellenőrzés
- vezérelt
- fordítva
- Hűvös
- korrigált
- Hiba
- Megfelelő
- Tanács
- összekapcsolt
- fedő
- teremt
- készítette
- létrehozása
- Kreatív
- kritériumok
- kritikai
- CT szkennel
- szokás
- vágás
- sötét
- dátum
- adatkészletek
- nap
- Nap
- de
- meghatározott
- átadó
- attól
- leírt
- Design
- kívánatos
- részletek
- észlelt
- Érzékelés
- Határozzuk meg
- eltökélt
- meghatározó
- fejlett
- eszköz
- diagnosztika
- DID
- különbség
- különbségek
- különböző
- Diffusion
- digitális
- hígított
- irány
- betegség
- tál
- Szórás
- terjesztés
- disztribúció
- megosztott
- do
- nem
- csinált
- adag
- húzott
- Csepp
- időtartama
- dinamikus
- dinamika
- e
- E&T
- minden
- könnyű
- visszhang
- hatékonyság
- bármelyik
- beágyazott
- lehetővé
- lehetővé teszi
- Endpoint
- fokozott
- Egész
- enzimatikus
- felszerelt
- megalapozott
- intézmény
- becslés
- Eter (ETH)
- etika
- európai
- értékelni
- Minden
- vizsgálat
- meghaladta
- Kivéve
- várakozás
- várható
- kísérlet
- kísérleti
- kísérletek
- magyarázható
- export
- külső
- megkönnyítése
- tényező
- női
- mező
- Füge
- Ábra
- megtöltött
- szűrő
- Szűrők
- utolsó
- Végül
- vezetéknév
- szerelvény
- rögzített
- Vaku
- követ
- következő
- A
- forma
- formaldehid
- Formálisan
- tovább
- négy
- ból ből
- fagyasztva
- funkció
- további
- rés
- ge
- GE Healthcare
- általános
- generál
- generált
- Giving
- jó
- színátmenetek
- Gramm
- Zöld
- Csoport
- Csoportok
- Növekedés
- irányelvek
- Legyen
- he
- Egészség
- egészségügyi
- egészséges
- Szív
- HTTPS
- huang
- emberi
- követelmény
- ID
- identiques
- if
- kép
- képelemzés
- képek
- Leképezés
- azonnal
- elmerült
- javítja
- in
- beleértve
- amely magában foglalja
- növekvő
- inkubált
- Inkubálás
- INKUBÁCIÓ
- független
- index
- indukció
- információ
- kezdetben
- belső
- belső
- eszközök
- integrált
- interaktív
- kamat
- belső
- bele
- bevezetéséről
- ismétlés
- iterációk
- ITS
- KDA kiterjesztése
- tartás
- készlet
- l2
- nagy
- lézer
- lézerek
- réteg
- tojók
- kilépő
- balra
- Lencsék
- lencsék
- élet
- fény
- vonal
- LINK
- összekapcsolt
- betöltés
- terhelések
- helyi
- le
- Macro
- Makrók
- fenntartása
- karbantartás
- kézzel
- maszk
- maszkok
- egyező
- anyag
- anyagok
- matematikai
- Mátrix
- maximális
- eszközök
- intézkedés
- megmért
- mérések
- mérő
- Média
- Memory design
- merinó
- metanol
- mód
- egerek
- Mikroszkóp
- Mikroszkópia
- perc
- minimum
- kisebb
- vegyes
- keverék
- ML
- Mobil
- Mód
- modell
- modellek
- módosított
- modul
- molekuláris
- ellenőrizni
- ellenőrzés
- mozgás
- egér
- MRI
- MS
- MT
- többszörös
- nanotechnológia
- Természet
- hálózatok
- Semleges
- Új
- nem
- Zaj
- normális
- célkitűzés
- megfigyelt
- szerez
- kapott
- of
- Régi
- on
- ONE
- üzemeltetési
- operatív
- Művelet
- optimalizált
- or
- Orca
- eredeti
- felett
- éjszakai
- Oxford
- Oxigén
- Papír
- paraméterek
- Park
- rész
- részecske
- PBS
- Szeg
- behatolás
- mert
- teljesített
- Előadja
- kedvenc
- Petri
- fázisok
- tengely
- pixel
- helyezett
- repülőgép
- Planes
- Plató
- Platón adatintelligencia
- PlatoData
- pont
- pont
- portfolió
- pozíció
- pozicionált
- Pontosság
- előkészített
- be
- korábban
- eljárás
- eljárások
- feldolgozás
- fokozatosan
- protokoll
- Qi
- mennyiségi
- rádió
- véletlen
- Véletlenszerűsített
- PATKÁNY
- Arány
- hányados
- Reagál
- reakció
- Olvasó
- ésszerű
- miatt
- kapott
- fogadás
- feljegyzett
- Meggyógyul
- Piros
- csökkenteni
- Csökkent
- csökkenti
- referencia
- vidék
- maradt
- maradványok
- eltávolítása
- eltávolított
- eltávolítása
- Számolt
- Jelentő
- reprezentatív
- kötelező
- kutatás
- ellenálló
- Felbontás
- illetőleg
- válasz
- eredményez
- kapott
- Eredmények
- robot
- Szoba
- fut
- s
- SA
- azonos
- megtakarítás
- vizsgál
- elszórt
- SCI
- tudományos
- forgatókönyv
- Második
- másodlagos
- Rész
- szakaszok
- lát
- részes
- szegmentáció
- kiválasztott
- Sorozat
- szolgált
- beállítások
- számos
- adatlap
- mutatott
- Jel
- Jelelosztás
- hasonló
- óta
- egyetlen
- SIX
- Méret
- Szelet
- kicsi
- So
- nátrium
- szoftver
- megoldások
- Megoldások
- térbeli
- Stabilitás
- verem
- Stacks
- statisztikai
- stellaris
- Lépései
- memorizált
- csík
- diák
- tanulmányok
- későbbi
- Később
- kíséret
- felületi
- Tünetek
- szintézis
- rendszer
- T
- T1
- táblázat
- bevétel
- tech
- Technologies
- távcső
- sablon
- tíz
- teszt
- kipróbált
- hogy
- A
- azok
- Őket
- akkor
- elméleti
- Gyógyászati
- terápia
- ezt
- alaposan
- azok
- három
- háromdimenziós
- Keresztül
- egész
- idő
- alkalommal
- szövet
- nak nek
- együtt
- szerszám
- szerszámok
- Végösszeg
- felé
- felé
- transzformáló
- kezelés
- Triton
- próbál
- tumorok
- kettő
- típus
- jellemzően
- érzéketlen
- alatt
- -ig
- upon
- használt
- használó
- segítségével
- Értékek
- jármű
- Ellen
- keresztül
- videó
- Videók
- Megnézem
- Tényleges
- Képzeld
- vivo
- kötet
- kötetek
- térfogat-
- járóka
- pálca
- volt
- mosás
- Víz
- we
- Hetek
- súly
- Jólét
- voltak
- Kerék
- ami
- míg
- fehér
- ablakok
- val vel
- belül
- nélkül
- X
- Hozam
- így
- hozamok
- zephyrnet
- gyertya