Tous les réactifs ont été utilisés tels qu’ils ont été reçus, sauf indication contraire. Tous les produits chimiques ont été achetés auprès de Sigma Aldrich, à l'exception des billes de comptage (CountBright Absolute Counting Beads, Invitrogen). ζ-Le potentiel a été mesuré à l'aide d'un Zetasizer NanoZS90 (Malvern Instruments). La taille et la morphologie des particules ont été étudiées par SEM dans un microscope JEOL JSM 7800F Prime avec EDS intégré pour fournir l'analyse élémentaire. La taille des particules a été déterminée en mesurant 50 particules indépendantes. La chromatographie radio-instantanée en couche mince (ITLC) a été développée sur du papier de chromatographie en microfibre de verre Agilent Technologies imprégné d'acide silicique et analysée à l'aide d'un scanner Lablogic Flow-count TLC et d'un détecteur de tube photomultiplicateur (PMT) BioScan B-FC-3200 à l'aide du logiciel Laura. La phase mobile ITLC était composée de 0.175 M d’acide citrique et de 0.325 M de citrate trisodique dans l’eau, sauf indication contraire. Les échantillons radioactifs ont été mesurés à l'aide d'un Capintec CRC-25R (Capintec) ou d'un LKB Wallac 1282 Compugamma CS (PerkinElmer) pour lesquels les données ont été collectées à l'aide du logiciel EdenTerm. Des expériences de cytométrie en flux ont été réalisées dans un trieur de cellules BD FACSMelody à l'aide du logiciel BD FACSChorus. Les images TEP/CT ont été acquises à l'aide d'un scanner NanoPET/CT (Mediso), reconstruites à l'aide du logiciel Nucline v.0.21, et les images ont été analysées à l'aide du logiciel VivoQuant (version 3.5, InviCRO). Les données Listmode ont été obtenues par un outil logiciel spécifique MATLAB développé par Mediso. L'autoradiographie a été réalisée dans un instrument GE Amersham Typhoon.
Synthèse de particules de silice de taille inférieure au micromètre
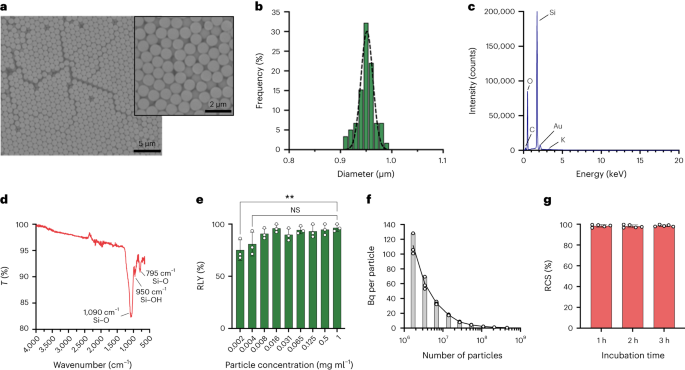
Les particules ont été synthétisées selon la méthode Stöber. Cette méthode est basée sur l'hydrolyse et la condensation consécutive d'alcoolates de silicium pour produire des particules de silice sphériques monodispersées.27. L'orthosilicate de tétraéthyle (TEOS) a été utilisé comme source de silicium, l'ammoniac comme catalyseur basique et le chlorure de potassium comme électrolyte. Une solution de TEOS dans l'éthanol a été ajoutée en continu à une solution contenant le catalyseur et l'électrolyte. La modification de la quantité de départ du réactif ou du taux d'ajout entraîne des différences dans la taille des particules, comme indiqué précédemment.28. Ici, deux solutions ont été préparées avant la synthèse des particules : Solution 1 contenant 19.0 mmol de TEOS dans 33.3 ml d’EtOH et Solution 2 contenant 0.23 mmol de KCl dans 9 ml d’ammoniac, 65 ml d’EtOH et 6.75 ml de H.2O. Pour la synthèse, la solution 2 a été placée dans un ballon à fond rond de 250 ml chauffé à 50 °C sous agitation à 300 rpm pendant 15 min. Ensuite, la solution 1 a été ajoutée goutte à goutte à la solution 2 (débit d'alimentation 0.2 ml min-1). Après ajout de la solution 1, les particules obtenues ont été purifiées par centrifugation à 18,300 XNUMX °C.g pendant 3 min et lavé avec EtOH cinq fois. Enfin, le SiO2 les microparticules ont été séchées sous vide.
Greffage des particules de taille submicrométrique avec du silane-PEG5k
Un 20 mg ml-1 solution de silane-PEG5k (Sigma Aldrich) dans EtOH 98 % a été ajouté sur une solution de smSiP à 5 mg ml-1 dans EtOH 98% et 2.8% d'ammoniaque. Le mélange a été agité toute la nuit à température ambiante et les particules ont été récupérées par centrifugation à 18,300 XNUMX °C.g pendant 3 minutes. Enfin, les particules ont été lavées trois fois avec de l’eau distillée et séchées sous vide pendant une nuit. Les solutions de lavage ont été lyophilisées pendant une nuit et la quantité de silane-PEG non attaché5k pondéré pour le calcul du rendement de la réaction. A 0.05 mg ml-1 solution de smSiP-PEG5k dans de l'eau distillée a été utilisé pour d'autres réactions de radiomarquage.
[68Ga]GaCl3
Le gallium-68 a été élué comme [68Ga]GaCl3 d'un Eckert et Ziegler 68Ge /68Générateur de Ga en HCl ultrapur (4 ml, 0.1 M) fabriqué selon les exigences des bonnes pratiques de fabrication (ABX).
Concentration du [68Ga]GaCl3 élution par échange de cations
La concentration de l'élution a été réalisée en utilisant la configuration décrite dans la Fig. 1. Premièrement, les 4 ml du [68Ga]GaCl3 L'élution a été chargée sur une cartouche Strata-X-C 33u (Phenomenex) et l'éluat a été jeté. Ensuite, la cartouche a été lavée avec 5 ml d’une solution acétone/HCl 0.1 M (80:20) et l’éluat a été jeté. Enfin, le concentré [68Ga]GaCl3 a été collecté en ajoutant 700 µl d’une solution acétone/0.05 M HCl (98:2), séchée sous atmosphère N.2 et remis en suspension dans 50 µl de tampon HEPES 0.5 M (pH 4.9). Une radio-TLC a été réalisée aux différentes étapes pour le contrôle qualité. Le protocole prend environ 20 min, offrant un rendement de récupération de 86.2 ± 8.5 %.
Radiomarquage de particules de silice à différentes concentrations avec 68Ga
Les particules de silice ont été remises en suspension à différentes concentrations (de 1 à 0.002 mg ml-1) dans un tampon HEPES 0.5 M (pH 4.9). Ensuite, 50 µl de la solution ont été ajoutés dans un tube de réaction avant l’ajout du concentré [68Ga]GaCl3 élution dans 50 µl de tampon HEPES 0.5 M (pH 4.9). Les réactions ont été conduites à 90 °C pendant 30 min et une radio-CCM a été réalisée pour calculer le rendement radiochimique.
Mesure de la concentration de particules par cytométrie en flux
Les concentrations de particules ont été calculées par cytométrie en flux à l'aide de billes de comptage (CountBright Absolute Counting Beads, Invitrogen) en suivant les instructions du fabricant. Les particules de silice ont été remises en suspension à 0.05 mg ml-1, soniqué pendant 10 min et passé à travers un filtre de taille de coupure de 10 µm (filtre de seringue KX, nylon, 25 mm, 10 µm). Les billes de comptage CountBright Absolute ont été réchauffées à température ambiante et vortexées pendant 30 secondes. Ensuite, 50 µl de billes ont été ajoutés à 300 µl de particules de silice et le mélange a été vortexé pendant 30 min pour obtenir une solution homogène. L'échantillon a été analysé sur le cytomètre en flux et le seuil de diffusion directe (FSC) a été défini pour inclure les billes et les particules sur le diagramme de dispersion linéaire FSC versus côté linéaire. Ensuite, la tension du détecteur de fluorescence a été ajustée pour les billes de comptage et une stratégie de déclenchement a été réalisée pour isoler les particules de silice et les populations de billes de comptage. Enfin, des portes sur les particules et les billes de comptage absolu ont été tracées et 1,000 XNUMX événements de billes ont été enregistrés pour chaque échantillon. En utilisant cette stratégie, le nombre de particules en solution a été calculé à l'aide de l'équation suivante :
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Particules}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volume}})} fois,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}gauche(frac {{mathrm{Beads}}}{{{upmu l}}}right)end{array}$$
Radiomarquage de 500 smSiP
Cinq cents smSiP ont été ajoutés à 50 µl du concentré [68Ga]GaCl3 élution dans du tampon HEPES 0.5 M pH 4.9. Ensuite, 5.6 µl de polysorbate 80 ont été ajoutés et le mélange a été chauffé à 90 °C pendant 30 min à 900 rpm dans un mélangeur thermique. Ensuite, un protocole final de purification en plusieurs étapes a été conçu pour éliminer les substances n'ayant pas réagi/colloïdales. 68Ga. Cinquante microlitres d'EDTA 10 mM ont été ajoutés et le mélange a été incubé pendant 5 minutes à température ambiante. Ensuite, les particules ont été centrifugées pendant 3 min à 18,300 XNUMXg, remis en suspension dans 500 µl de PBS contenant 1 mM d'EDTA + 0.1 % de polysorbate 80 et doucement vortexé pendant 10 s. Les particules ont été à nouveau centrifugées, lavées avec une solution de 0.1 mM d'EDTA + 0.1% de polysorbate 80 dans du PBS et doucement vortexées pendant 10 s. Enfin, les particules ont été centrifugées et lavées cinq fois de plus avec du PBS + 0.1 % de polysorbate 80 et remises en suspension dans 500 µl de PBS. La réaction de radiomarquage a été suivie par radio-CMC au cours des étapes réactionnelles successives pour évaluer la présence de colloïdes (qui peuvent être confondus avec des particules s'ils ne sont pas correctement éliminés), le radiomarquage des particules et la pureté du produit final. RLY a été calculé par comparaison entre la quantité de radioactivité dans les particules et les surnageants après les étapes de lavage.
Fractionnement
Pour la stratégie de fractionnement, des volumes de 0.5 µl à 20 µl du 68Ga-smSiP à une concentration théorique de 1 particule µl-1 ont été ajoutés dans différents tubes d'échantillon par étapes de 1 µl (0.5, 1, 2, 3…) et du PBS a été ajouté pour amener le volume final à 50 µl. Ensuite, 37.5 µl du premier tube ont été pipetés dans un deuxième tube d’échantillon, 25 µl du deuxième tube dans un troisième tube et enfin 12.5 µl du troisième tube dans un quatrième tube. Cette stratégie fournit quatre tubes par échantillon avec un volume final de 12.5 µl par tube. La radioactivité dans chaque tube a été mesurée dans un compteur gamma et les valeurs ont été calculées en kBq à l'aide d'une courbe d'étalonnage, pour une comparaison et une analyse plus approfondies. Les échantillons contenant la majeure partie de la radioactivité dans un seul tube ont été soniqués pendant 30 secondes à température ambiante et soumis à une deuxième étape de fractionnement. Ensuite, les échantillons dans lesquels toute la radioactivité était trouvée dans un seul tube (avec une activité négligeable dans les trois autres tubes) ont été utilisés pour d’autres expériences in vivo/ex vivo.
Imagerie fantôme TEP/CT
Une expérience d'imagerie fantôme a été réalisée avec un 68Ga-smSiP. Une canule a été utilisée pour administrer la particule dans un tube à échantillon afin d'évaluer si une seule particule pouvait rester piégée dans le tube de la canule pendant l'administration. En bref, le tube fantôme a été placé dans le scanner nanoPET/CT avec l’extrémité de la pointe de la canule attachée au tube. Après avoir démarré l'acquisition TEP, la particule remise en suspension dans 100 µl de PBS a été délivrée avec une seringue à insuline fixée au début de la canule. Ensuite, la canule a été lavée avec 50 µl de PBS pour assurer la délivrance de la particule dans le tube fantôme. L'acquisition TEP a été réalisée pendant 2 h suivie d'un scanner standard.
Imagerie TEP/CT in vivo
Les études d’imagerie animale ont été examinées de manière éthique et réalisées conformément à la loi de 1986 sur les animaux (procédures scientifiques) (ASPA) des réglementations du Home Office du Royaume-Uni régissant l’expérimentation animale. L'imagerie in vivo a été réalisée chez des souris BALB/c en bonne santé, âgées de 8 semaines. Les animaux ont été anesthésiés avec de l'isoflurane (2 à 3 % dans de l'oxygène), canulés et placés sur le lit du scanner sous anesthésie. Le lit a été chauffé à 37 °C par un flux d'air interne pour maintenir l'animal à une température corporelle normale, et la fréquence respiratoire a été surveillée et maintenue entre 60 et 80 respirations min.-1 tout au long de l'analyse. Il est important de maintenir le contrôle de la température de l'animal, car une baisse inattendue de la température pourrait entraîner une réduction de la vitesse de la particule dans le sang. Un 68Ga-smSiP (n = 4) ou 68Ga-smSiP-PEG5k particule (n = 2) a été administré à travers la canule dans 100 µl de PBS, suivi d'un lavage avec 50 µl de PBS après le démarrage de l'acquisition TEP (mode de coïncidence 1:5 ; fenêtre de temps de coïncidence de 5 ns). La TEP a été enregistrée pendant 2 heures, puis une tomodensitométrie semi-circulaire a été réalisée. La température corporelle et la fréquence respiratoire des animaux ont été surveillées pendant tout le processus. Les images TEP/CT dynamiques ont été reconstruites à l'aide de la reconstruction Tera-Tomo 3D (fenêtre d'énergie de 400 à 600 keV, mode de coïncidence 1:5, 20 itérations et 1 sous-ensemble) à une taille de voxel de 0.4 × 0.4 × 0.4 mm.3 et corrigé pour l'atténuation, la diffusion et la décroissance. Les données en mode liste pour toutes les acquisitions PET/PEPT peuvent être trouvées pour 68Ga-smSiP à la réf. 29 et pour 68Ga-smSiP-PEG5k à la réf. 30.
Suivi en temps réel
Tout d’abord, les données ont été exportées du scanner au format listmode (c’est-à-dire un format avec un horodatage et un indice cristallin pour les photons de coïncidence détectés). Une transformation géométrique a été appliquée pour convertir les indices cristallins en positions en unités mm. La méthode de Birmingham calcule de manière itérative le MDP à partir d’un sous-ensemble de toutes les LoR. Pour ce faire, il élimine les LoR situées à une distance supérieure à une distance définie du MDP, car elles sont susceptibles de provenir de fausses LoR, par exemple des LoR pouvant provenir d'une dispersion. Le MDP est affiné à chaque itération ; le nombre d'itérations est effectivement fixé par le f-facteur et se rapporte au nombre total de LoR qui sont utilisés pour estimer la position finale des particules dans ce sous-ensemble (par exemple, un f-un facteur de 0.5 signifie que la boucle d'itération se terminera lorsqu'il restera 50 % des LoR du sous-ensemble). Le nombre de LoR utilisées dans un sous-ensemble peut être réduit pour améliorer l'échantillonnage temporel (les sous-ensembles sont consécutifs dans le temps sans chevauchement) au prix d'une augmentation de l'incertitude de position (plus de détails sur l'algorithme peuvent être trouvés dans Parker et al.5) La méthode de Birmingham a été utilisée pour analyser les données en mode liste du scanner TEP. Une taille d’échantillon adaptative a été utilisée pour suivre la particule chez les souris. La taille de l'échantillon a été définie pour atteindre un équilibre entre un échantillonnage temporel suffisant tout en minimisant les erreurs de positionnement. Une taille d'échantillon comprise entre 100 et 200 LoR a été utilisée dans les premières étapes des analyses (<60 s à partir du début de l'analyse), avec f = 0.1, ce qui donne des intervalles d'environ 1 à 5 s. À des temps de balayage > 60 s, la taille des échantillons variait entre 1,000 2,000 et 30 60, ce qui donnait des intervalles de temps compris entre XNUMX et XNUMX selon l'expérience in vivo. Le nombre de comptes utilisés pour calculer le MDP (dans l'itération finale) peut être trouvé en multipliant la taille de l'échantillon par le f-valeur du facteur. Ces paramètres étaient basés sur une expérience antérieure et informés par des publications antérieures1.
La vitesse a été obtenue comme (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) De ({v}_{m}^{2}) est la vitesse dans le x, y et de z directions.
Absorption d'organes ex vivo
L'absorption dans différents organes a été évaluée par comptage gamma. Après l'imagerie TEP/CT in vivo, les animaux ont été tués par luxation cervicale et les organes excisés et pesés pour le comptage de la radioactivité dans un compteur gamma (LKB Wallac 1282 Compugamma CS). Les données ont été exprimées en pourcentage de dose injectée (dose dans l'organe/dose totale injectée) par gramme de tissu (%ID g-1).
Autoradiographie
La radioactivité dans les poumons a été tracée avec un détecteur de rayonnement (sonde EP15, Morgan) et les poumons ont été coupés en petites sections avec un scalpel jusqu'à ce qu'une petite partie de tissu présentant le signal radioactif soit obtenue. Le tissu a été congelé instantanément dans de l'isopropanol à -80 °C. Immédiatement après la congélation, le tissu a été incorporé dans un milieu à température de coupe optimale et coupé dans un cryostat en tranches de 20 µm. Chaque tranche a été étudiée avec le détecteur jusqu'à ce que la tranche radioactive soit trouvée. La tranche précédente (sous l'arrière-plan), radioactive et suivante (sous l'arrière-plan) ont été placées sur une lame de microscope Superfrost (Epredia). Le reste du tissu restant était également inférieur au bruit de fond. La lame de microscope avec les trois coupes a été recouverte d'un film alimentaire et placée contre une plaque d'autoradiographie GE pendant la nuit. La plaque a été analysée à l'aide du GE Amersham Typhoon avec une résolution de 25 µm et un réglage PMT de 4,000 1. L'image d'autoradiographie a été superposée à l'image du tissu, montrant une tache de radioactivité dans la tranche radioactive. Pour la quantification, des étalons ont été préparés dans différentes activités connues, et chacun a été repéré sous la forme d'un quintette de 5 µl dans du papier. Les spots ont été incubés dans le même écran de stockage au phosphore, BAS-IP MS (MultiPurpose Standard) de GE, lors de la quantification des particules uniques. L'image a été acquise avec l'Amersham Typhoon 2.0 avec le logiciel de contrôle version 100 en mode phosphore avec une taille de pixel de 4,000 µm et une sensibilité de 10.0 261. Les images ont été quantifiées avec le logiciel ImageQantTL vXNUMX-XNUMX en utilisant la boîte à outils de quantification de gel. Les taches ont été corrigées en choisissant une région immédiatement avant ou après la tache comme arrière-plan constant. Le volume résultant de la tache a été utilisé pour calculer le Bq dans la particule sur la base de la courbe d'étalonnage.
Statistiques et reproductibilité
Pour l'analyse quantitative, un minimum de trois répétitions biologiques ont été analysées, à l'exclusion des données in vivo de 68Ga-smSiP-PEG5k (n = 2). Les données ont été analysées par analyse de variance unidirectionnelle ordinaire (ANOVA) avec le test de comparaisons multiples de Dunnett et le test de Student. t-test. UN P une valeur <0.05 a été considérée comme statistiquement significative.
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://www.nature.com/articles/s41565-023-01589-8
- :est
- :ne pas
- :où
- ][p
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Absolute
- conformité
- atteindre
- a acquise
- acquisition
- acquisitions
- Agis
- d'activités
- activité
- adaptatif
- ajoutée
- ajoutant
- ajout
- Ajusté
- administré
- administration
- avances
- Après
- après
- encore
- Transport Aérien
- AL
- algorithme
- Tous
- aussi
- Ammoniac
- montant
- an
- analyser
- selon une analyse de l’Université de Princeton
- Présentatrice
- et de
- animal
- animaux
- appliqué
- d'environ
- SONT
- survenir
- AS
- At
- b
- fond
- Balance
- base
- basé
- base
- BD
- BE
- before
- Début
- ci-dessous
- jusqu'à XNUMX fois
- Birmingham
- sang
- corps
- brièvement
- apporter
- tampon
- by
- calculer
- calculé
- calcule
- calcul
- CAN
- réalisée
- Catalyseur
- cellule
- produits chimiques
- choose
- cliquez
- coïncidence
- Comparaison
- comparaisons
- composé
- Concentré
- concentration
- menée
- confus
- consécutif
- considéré
- constant
- continuellement
- des bactéries
- contrôlée
- convertir
- corrigé
- Prix
- pourriez
- Counter
- compte
- couvert
- Cristal
- cs
- courbe
- Cut/Taille
- Coupe
- données
- livrer
- livré
- page de livraison.
- Selon
- décrit
- un
- détails
- détecté
- déterminé
- développé
- différences
- différent
- instructions
- dislocation
- distance
- dose
- tiré
- Goutte
- pendant
- Dynamic
- e
- E & T
- chacun
- "Early Bird"
- de manière efficace
- électrolyte
- intégré
- émission
- employés
- fin
- énergie
- ENGINEERING
- assurer
- l'équipements
- Erreurs
- estimation
- Ether (ETH)
- évaluer
- évalué
- événements
- exemple
- Sauf
- à l'exclusion
- d'experience
- expérience
- expériences
- exprimé
- non
- figues
- Film
- une fonction filtre
- finale
- finalement
- Prénom
- cinq
- flux
- suivi
- Abonnement
- Pour
- le format
- Avant
- trouvé
- quatre
- Quatrièmement
- Congélation
- De
- gelé
- FSC
- plus
- Portes
- ge
- générateur
- en verre.
- Bien
- gouvernant
- Gramme
- Croissance
- la santé
- ici
- Accueil
- Travail à Domicile :
- HTTPS
- if
- image
- satellite
- Imagerie
- immédiatement
- important
- améliorer
- in
- comprendre
- croissant
- incubé
- indépendant
- indice
- Indices
- Actualités
- instantané
- Des instructions
- instrument
- instruments
- des services
- Interfaces
- interne
- développement
- IT
- itération
- itérations
- XNUMX éléments à
- connu
- Kx
- conduire
- Probable
- LINK
- Poumons
- le maintien
- fabriqué
- fabrication
- Matériel
- Mai..
- veux dire
- mesuré
- mesure
- moyenne
- méthode
- méthodes
- souris
- micron
- Microscope
- m.
- réduisant au minimum
- minimum
- mixer
- mélange
- ML
- Breeze Mobile
- Mode
- surveillé
- PLUS
- Morgan
- (en fait, presque toutes)
- MS
- plusieurs
- multiplier
- nanotechnologies
- Nature
- next
- aucune
- Ordinaire
- nombre
- obtenir
- obtenu
- of
- Bureaux
- on
- ONE
- uniquement
- opposé
- optimaux
- or
- ordinaire
- Autre
- autrement
- ande
- plus de
- du jour au lendemain
- Oxygène
- Papier
- paramètres
- particule
- passé
- PBS
- /
- pourcentage
- effectué
- animal de compagnie
- fantôme
- phase
- photon
- image
- pixel
- mis
- Platon
- Intelligence des données Platon
- PlatonDonnées
- populations
- partieInvestir dans des appareils économes en énergie et passer à l'éclairage
- position
- positionnement
- positron
- pratique
- préparé
- présence
- précédent
- précédemment
- Prime
- Avant
- sonde
- procédures
- processus
- produire
- Produit
- correctement
- protocole
- fournir
- fournit
- aportando
- acheté
- qualité
- quantification
- quantitatif
- Quantité
- R
- Radiation
- Radio
- gamme
- Tarif
- réaction
- réactions
- en temps réel
- reçu
- récent
- enregistré
- récupération
- Prix Réduit
- réduction
- référence
- raffiné
- région
- règlements
- se rapporte
- rester
- restant
- supprimez
- Supprimé
- réplique
- Exigences
- Résolution
- REST
- résultant
- Avis
- examiné
- Salle
- Courir
- s
- même
- balayage
- balayage
- analyse
- SCI
- sur une base scientifique
- pour écran
- Deuxièmement
- secondes
- les sections
- SEM
- Sensibilité
- set
- mise
- installation
- montrant
- Sigma
- Signal
- significative
- Silicium
- unique
- Taille
- tailles
- Tranche
- Glissement
- petit
- Casser
- Logiciels
- sur mesure
- Solutions
- Identifier
- groupe de neurones
- Spot
- taches
- étapes
- Standard
- Normes
- Commencer
- Commencez
- A déclaré
- statistiquement
- étapes
- Étapes
- storage
- de Marketing
- courant
- étudié
- études
- Étudier
- suffisant
- la quantité
- interrogées
- synthèse
- prend
- technique
- Les technologies
- tester
- que
- qui
- La
- puis
- théorique
- thermique
- Ces
- Troisièmement
- this
- trois
- порог
- Avec
- tout au long de
- fiable
- fois
- horodatage
- pointe
- fabric
- à
- outil
- Boîte à outils
- Total
- suivre
- Tracking
- De La Carrosserie
- piégé
- deux
- Uk
- Incertitude
- sous
- Inattendu
- unités
- jusqu'à
- d'utiliser
- en utilisant
- Vide
- Plus-value
- Valeurs
- Rapidité
- version
- Versus
- vivo
- Tension
- le volume
- volumes
- Voxel
- W
- était
- lavage
- Eau
- ont été
- quand
- que
- qui
- tout en
- la totalité
- sera
- fenêtre
- comprenant
- dans les
- Rendement
- a abouti
- élastique
- zéphyrnet
- Zip