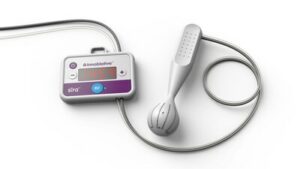
Une étude prospective, randomisée et multicentrique évaluant l'innocuité et l'efficacité du système ReCET ™ chez les patients adultes atteints de diabète de type 2
MINNEAPOLIS, Janvier 30, 2024 /PRNewswire/ — Endogenex, Inc., une société de dispositifs médicaux au stade clinique dédiée à l'amélioration des résultats chez les patients atteints de diabète de type 2 (DT2), a annoncé que la Food and Drug Administration (FDA) des États-Unis avait accordé une exemption relative aux dispositifs expérimentaux (IDE) pour initier une étude clinique du système ReCET pour le traitement du DT2 chez les patients adultes, insuffisamment contrôlés par des médicaments hypoglycémiants non insuliniques.
L'étude clinique ReCET est une étude multicentrique, prospective, randomisée, en double aveugle et contrôlée de manière fictive, évaluant la sécurité et l'efficacité du système ReCET™. L'étude pivot recrutera jusqu'à 350 patients dans des sites cliniques en les États Unis et en Australie.
« Endogenex est ravi de franchir cette étape clinique importante », a déclaré Stacey Pugh, PDG d'Endogenex. « Il s’agit d’une prochaine étape cruciale dans l’avancement de la procédure ReCET en tant que traitement qui s’attaque aux causes sous-jacentes du DT2 qui ne sont pas ciblées par les médicaments actuels contre le diabète. »
« De nombreuses personnes vivant avec le DT2 ont du mal à contrôler leur glycémie, même lorsqu’elles utilisent des médicaments modernes pour réduire la glycémie. Cela représente un défi important pour les patients et leurs prestataires de soins », a déclaré Richard Pratley, MD, directeur médical de l'Advent Health Diabetes Institute à Orlando, Floride et co-chercheur principal de l'étude ReCET. « Les résultats préliminaires de la procédure ReCET ont été très encourageants. Nous sommes donc impatients de participer à cette étude et d'élargir notre compréhension de la manière dont elle peut répondre à un besoin important en matière de soins de cette population de patients. »
« Le rôle du duodénum dans la fonction métabolique et la signalisation est bien établi », a déclaré le Dr. Barham Abou Dayyeh, MD, MPH, directeur de l'endoscopie avancée et métabolique à la clinique Mayo à Rochester, Minn.et co-chercheur principal de l'étude ReCET. « La régénération du tissu duodénal grâce à la procédure ReCET a le potentiel de cibler les facteurs physiopathologiques sous-jacents associés au diabète de type 2. L’évaluation de cette procédure dans le cadre de l’étude ReCET pourrait ouvrir la voie à une nouvelle approche thérapeutique pour cette maladie.
L'étude clinique ReCET recrutera des patients dans jusqu'à 30 sites en les États Unis et jusqu'à 10 sites en Australie.
La procédure ReCET™ :
ReCET est une nouvelle procédure endoscopique ambulatoire qui cible la pathologie cellulaire sous-jacente du duodénum qui peut contribuer au développement et à la progression du diabète de type 2.
Grâce à l'application de champs électriques pulsés non thermiques hautement contrôlés, le système ReCET est conçu pour lancer le processus de régénération naturel du corps afin de restaurer la signalisation cellulaire appropriée du duodénum et d'améliorer la fonction métabolique, notamment un meilleur contrôle de la glycémie.
Le système ReCET a été évalué dans le cadre d'études cliniques de faisabilité, notamment REGENT-1 US, REGENT-1 Australie, et ÉMINENT dans Pays-Bas. Les études cliniques ont évalué l'innocuité et l'efficacité chez les adultes atteints de diabète de type 2 dont la glycémie n'était pas suffisamment contrôlée, malgré l'utilisation d'insuline et de médicaments non insuliniques. La publication des résultats préliminaires de l’étude a été présentée lors de conférences cliniques à l’échelle mondiale.
Le système ReCET a reçu la désignation de dispositif révolutionnaire de la FDA pour le traitement du diabète de type 2 chez les patients adultes insuffisamment contrôlés par des médicaments hypoglycémiants.
À propos d'Endogenex :
Endogenex est une société privée au stade clinique dont le siège social se trouve à Minneapolis, Minnesota. Endogenex a été fondée, en partenariat avec Mayo Clinic, pour développer des thérapies visant à améliorer les résultats des personnes vivant avec le diabète de type 2. L'accent d'Endogenex est centré sur le principe selon lequel un traitement efficace contre le diabète de type 2 peut s'étendre au-delà des options pharmaceutiques, corriger la fonction métabolique et aider les personnes à reprendre le contrôle de leur glycémie.
Pour plus d'informations, s'il vous plaît visitez notre site Web à www.endogenex.com or www.twitter.com/endogenex
Demandes des médias:
Brent Collins
bcollins@endogenex.com
+ 1 (612) -227-6949
![]() Voir le contenu original pour télécharger du multimédia:https://www.prnewswire.com/news-releases/endogenex-receives-ide-approval-to-initiate-pivotal-clinical-study-302048370.html
Voir le contenu original pour télécharger du multimédia:https://www.prnewswire.com/news-releases/endogenex-receives-ide-approval-to-initiate-pivotal-clinical-study-302048370.html
SOURCEEndogenex
- Contenu propulsé par le référencement et distribution de relations publiques. Soyez amplifié aujourd'hui.
- PlatoData.Network Ai générative verticale. Autonomisez-vous. Accéder ici.
- PlatoAiStream. Intelligence Web3. Connaissance Amplifiée. Accéder ici.
- PlatonESG. Carbone, Technologie propre, Énergie, Environnement, Solaire, La gestion des déchets. Accéder ici.
- PlatoHealth. Veille biotechnologique et essais cliniques. Accéder ici.
- La source: https://www.biospace.com/article/releases/endogenex-receives-ide-approval-to-initiate-pivotal-clinical-study/?s=93
- :possède
- :est
- :ne pas
- $UP
- 10
- 12
- 30
- 350
- a
- atteindre
- adresses
- administration
- Adulte
- adultes
- Avancée
- de suivre
- avènement
- an
- ainsi que le
- annoncé
- Application
- une approche
- approbation
- SONT
- AS
- évalué
- Évaluation
- associé
- At
- Australie
- BE
- était
- Améliorée
- Au-delà
- BioEspace
- sang
- corps
- percée
- Apporter
- by
- CAN
- les soins
- les causes
- cellulaire
- centré
- CEO
- challenge
- clinique
- Infos sur les
- COM
- Société
- conférences
- contenu
- contribuer
- des bactéries
- contrôlée
- correct
- critique
- Courant
- dévoué
- la désignation
- un
- Malgré
- développer
- Développement
- dispositif
- Diabète
- Directeur
- Maladie
- double
- download
- dr
- drogue
- Efficace
- efficacité
- efficacité
- Électrique
- encourageant
- énergie
- s'inscrire
- Ether (ETH)
- évalué
- évaluation
- Pourtant, la
- excité
- expansion
- étendre
- facteurs
- fda
- faisabilité
- Des champs
- Focus
- nourriture
- Administration des aliments et des médicaments
- Administration des aliments et des médicaments (FDA)
- Pour
- Avant
- Fondée
- De
- Remplir
- fonction
- À l'échelle mondiale
- accordée
- Vous avez
- siège social
- Santé
- Tenue
- vous aider
- très
- Comment
- HTML
- HTTPS
- important
- améliorer
- l'amélioration de
- in
- Inc
- Y compris
- d'information
- initier
- Messages
- Institut
- investigateur
- IT
- jpg
- niveaux
- vie
- Style
- abaissement
- de nombreuses
- Beaucoup de gens
- Mai..
- mai
- Mayo Clinic
- médical
- dispositif médical
- médicaments
- métabolique
- étape importante
- Villas Modernes
- PLUS
- multicentrique
- Multimédia
- Nature
- Besoin
- Nouveauté
- next
- roman
- of
- on
- Options
- or
- original
- nos
- les résultats
- partie
- participant
- Partenariat
- pathologie
- patientforward
- patients
- paver
- Personnes
- Pharmaceutique
- pivot
- Platon
- Intelligence des données Platon
- PlatonDonnées
- veuillez cliquer
- population
- défaillances
- préliminaire
- présenté
- cadeaux
- principe
- PRNewswire
- procédure
- processus
- progression
- correct
- éventuel
- fournisseurs
- Publication
- Randomisé
- reçu
- reçoit
- reconquérir
- régénérateur
- rester
- restaurer
- Résultats
- Rôle
- s
- Sécurité
- Saïd
- significative
- Sites
- So
- Étape
- A déclaré
- étapes
- Lutter
- études
- Étude
- sucre
- combustion propre
- Target
- des campagnes marketing ciblées,
- objectifs
- qui
- Les
- leur
- thérapies
- this
- Avec
- fabric
- à
- traitement
- type
- Le diabète de type 2
- nous
- sous-jacent
- compréhension
- Uni
- us
- utilisé
- en utilisant
- très
- Voir
- Visiter
- était
- Façon..
- we
- Site Web
- ont été
- tout en
- dont
- sera
- comprenant
- dans les
- zéphyrnet