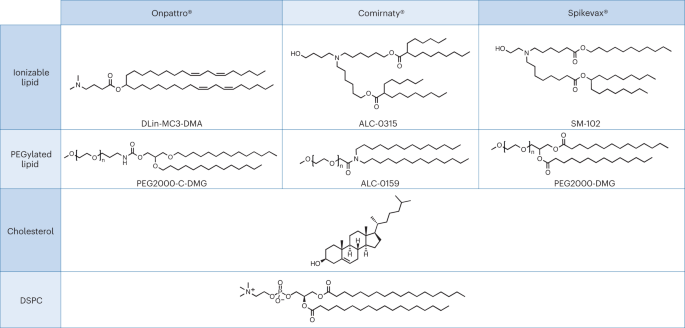
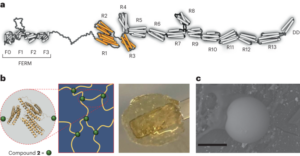
Eine relevante Fallstudie für die oben genannte Prämisse, die auch eine Ungleichheit bei der behördlichen Prüfung hervorhebt, findet sich in der jüngsten Zulassung von Nanomedikamenten auf der Basis von Ribonukleinsäure (RNA). Eng verwandte LNPs wurden als Abgabesystem für die folgenden drei RNA-Medikamente verwendet: Alnylams RNAi-basierte Therapie zur Behandlung der hereditären Transthyretin (hATTR)-Amyloidose (Handelsname: Onpattro); der Pfizer-BioNTech COVID-19-Impfstoff auf Basis der mRNA-Technologie (Handelsname: Comirnaty); und der Moderna-COVID-19-Impfstoff (Handelsname: Spikevax), der ebenfalls auf der mRNA-Technologie basiert. Die einzelnen Bestandteile der drei LNP-Produkte sind sehr ähnlich (Abb. 1.)16. Kurz gesagt bestehen die LNPs aus einem ionisierbaren kationischen Lipid, einem PEGylierten Lipid, Cholesterin und einem Strukturlipid (Distearoylphosphatidylcholin; DSPC).
Die in Onpattro, Comirnaty und Spikevax verwendeten LNPs weisen mehrere gemeinsame Merkmale auf. Konkret bestehen alle drei Produkte aus einer Kombination von vier verschiedenen Lipidtypen. Zwei dieser Lipide, nämlich Cholesterin und DSPC, sind bei allen drei Produkten identisch. Die anderen beiden Lipide sind ionisierbare Lipide mit einer tertiären Amingruppe und PEGylierte Lipide, die für alle drei Produkte ähnlich sind. Insgesamt weisen die LNPs in den drei Produkten eine Ähnlichkeit in Zusammensetzung und Struktur auf.
Alle drei Medikamente sind von der FDA und der EMA zugelassen. Doch trotz sehr ähnlicher LNP-Zusammensetzungen wurden die LNP-Komponenten von Spikevax vom Antragsteller unterschiedlich klassifiziert. Diese Klassifizierung wurde von der FDA akzeptiert und folglich wurde Spikevax LNP anders bewertet als die entsprechenden LNPs in den anderen beiden Produkten. Im Folgenden vergleichen und stellen wir die jeweiligen Regulierungsdossiers gegenüber. Für die EMA sind diese Details im European Public Assessment Report (EPAR) zu finden, und für die US-amerikanische FDA sind die Informationen in den öffentlich zugänglichen Prüf- und Zulassungsdokumenten (FDA-Zulassungsschreiben, Produktetiketten, Summary Basis for Regulatory Action und Review Memoranda) enthalten ).
Onpattro
Nach Angaben der EMA handelt es sich bei dem Onpattro-Arzneimittel um ein LNP, das aus einer Mischung von vier Lipidhilfsstoffen besteht, die die doppelsträngige siRNA (ds-siRNA) Patisiran-Natrium (Wirkstoff) einkapseln. Zwei der Lipide, DLin-MC3-DMA und PEG2000-C-DMG, gelten als neuartige Hilfsstoffe17. Die US-amerikanische FDA betrachtet die vier Lipidkomponenten, die das LNP bilden, ebenfalls als Hilfsstoffe, wobei DLin-MC3-DMA und PEG2000-C-DMG ebenfalls als neu bezeichnet werden18.
Spikevax
In der ersten Einreichung seines Zulassungsdossiers deklarierte Moderna die mRNA und die Lipidkomponenten als Arzneimittelwirkstoff19. Bei der Überprüfung dieser ersten Version durch die EMA wurde darauf hingewiesen, dass nur die mRNA als Wirkstoff betrachtet werden sollte. Das Spikevax-Dossier musste daher an die EU-Anforderungen angepasst werden, da die EMA alle vier Lipidkomponenten des LNP als Hilfsstoffe ansieht. Zwei davon gelten als neu, nämlich SM-102, ein ionisierbarer Lipidhilfsstoff, und das Polyethylenglykol-Lipid-Konjugat PEG2000-DMG (Ref. 19).
Im Gegensatz zur Überprüfung durch die EMA akzeptierte die FDA die Einstufung von PEG2000-DMG und SM-102 durch Moderna als „Ausgangsmaterialien“ für den Arzneimittelwirkstoff und nicht als Hilfsstoffe20 und das Regulierungsdossier blieb entsprechend strukturiert. In der vollständigen Liste der Hilfsstoffe sind PEG2000-DMG und SM-102 (und auch die beiden übrigen Lipide) nicht enthalten, und im BLA Review Memorandum von Chemistry Manufacturing and Controls (CMC) heißt es ausdrücklich, dass das Arzneimittel mRNA-1273 keine neuartigen Hilfsstoffe enthält. In der zusammenfassenden Grundlage für regulatorische Maßnahmen der FDA wird das LNP auch unter der Beschreibung des Wirkstoffs aufgeführt21. Gegenübergestellt zu ihrer eigenen Entscheidung im CMC-Abschnitt, der toxikologischen Prüfung der FDA für Spikevax22 identifiziert SM-102 und PEG2000-DMG als „inaktive Inhaltsstoffe“ und betrachtet SM-102 und PEG2000-DMG daher als Hilfsstoffe und nicht als Ausgangsmaterialien für den Arzneimittelwirkstoff.
comirnaty
In Übereinstimmung mit ihrer Überprüfung von Spikevax betrachtet die EMA Comirnatys Strukturlipide DSPC und Cholesterin sowie die funktionellen Lipide ALC-0315 und ALC-0159 als Hilfsstoffe, wobei die beiden letztgenannten als neuartig gelten23. Im Gegensatz dazu und zu ihrer Entscheidung zu Spikevax gibt die FDA an, dass Comirnaty vier pharmakologisch inaktive Lipidhilfsstoffe enthält. Nämlich DSPC, Cholesterin, ALC-0159 und ALC-0315, wobei die beiden letztgenannten als neuartige Hilfsstoffe beschrieben werden24. Laut der zusammenfassenden Grundlage für regulatorische Maßnahmen der FDA haben die vier Lipide, aus denen das Comirnaty LNP besteht, die Funktion einer „Lipidkomponente“, während alle anderen Inhaltsstoffe, auch vermeintlich inaktive Inhaltsstoffe, als Hilfsstoffe gelten25.
Kurz gesagt: Die FDA überprüfte die Lipide in Spikevax als Teil der Arzneimittelsubstanz, während sehr ähnliche Lipide in Onpattro und Comirnaty als Hilfsstoffe überprüft wurden. Die EMA war in ihrer Überprüfung konsistenter, da die Lipide in allen drei LNPs als Hilfsstoffe aufgeführt sind. Wir betonen hier, dass unsere Fallstudie für diese drei LNPs nicht die in den Regulierungsdossiers bereitgestellten proprietären Daten bewertet und sich auf öffentlich verfügbare Informationen beschränkt.
- SEO-gestützte Content- und PR-Distribution. Holen Sie sich noch heute Verstärkung.
- PlatoAiStream. Web3-Datenintelligenz. Wissen verstärkt. Hier zugreifen.
- Die Zukunft prägen mit Adryenn Ashley. Hier zugreifen.
- Quelle: https://www.nature.com/articles/s41565-023-01371-w
- :Ist
- :nicht
- $UP
- 1
- 20
- 2017
- 2018
- 2021
- 2022
- 22
- 23
- 24
- a
- oben
- akzeptiert
- zugänglich
- Nach
- entsprechend
- Action
- aktiv
- Alle
- ebenfalls
- an
- Moderator
- und
- jedem
- Genehmigung
- genehmigt
- SIND
- AS
- Bewertung
- verfügbar
- basierend
- Grundlage
- BE
- war
- Sein
- unten
- Taste im nun erscheinenden Bestätigungsfenster nun wieder los.
- by
- CAN
- Häuser
- Fallstudie
- Charakteristik
- Chemie
- Einstufung
- eingestuft
- klicken Sie auf
- eng
- CMC
- Kombination
- vergleichen
- Komponenten
- Bestehend
- Folglich
- betrachtet
- überlegt
- konsistent
- enthält
- Kontrast
- Steuerung
- COVID-19
- technische Daten
- Debatten.
- Lieferanten
- beschrieben
- Beschreibung
- bezeichnet
- Trotz
- Details
- anders
- Unterlagen
- die
- Medikament
- Drogen
- im
- EMA
- betonen
- Äther (ETH)
- EU
- Europa
- Europäische
- falsch
- FDA
- Feige
- Abbildung
- Vorname
- Folgende
- Aussichten für
- gebildet
- gefunden
- vier
- voller
- Funktion
- funktional
- Gruppe an
- hätten
- Haben
- mit
- daher
- hier
- Highlights
- HTTPS
- identisch
- identifiziert
- Image
- in
- inaktiv
- das
- Krankengymnastik
- Information
- Anfangs-
- IT
- SEINE
- Etiketten
- Limitiert
- Line
- LINK
- Liste
- Gelistet
- Listen
- gemacht
- Herstellung
- Materialien
- Memorandum
- Mischung
- Moderne
- mehr
- mRNA
- Name
- nämlich
- Natur
- Roman
- of
- on
- einzige
- Andere
- UNSERE
- Gesamt-
- besitzen
- Teil
- Plato
- Datenintelligenz von Plato
- PlatoData
- Produkt
- Produktqualität
- Produkte
- Eigentums-
- vorausgesetzt
- Öffentlichkeit
- öffentlich
- Qualität
- lieber
- kürzlich
- in Bezug auf
- Grüße
- Regulierungsbehörden
- bezogene
- blieb
- verbleibenden
- berichten
- Voraussetzungen:
- diejenigen
- Überprüfen
- bewertet
- RNA
- Urteil
- Abschnitt
- mehrere
- Teilen
- Short
- sollte
- ähnlich
- Ähnlich
- da
- Größe
- speziell
- Beginnen Sie
- Staaten
- strukturell
- Struktur
- strukturierte
- Studie
- Einreichung
- Substanz
- ZUSAMMENFASSUNG
- System
- Technologie
- Tertiär-
- als
- zur Verbesserung der Gesundheitsgerechtigkeit
- Das
- die Informationen
- ihr
- Therapie
- deswegen
- Diese
- fehlen uns die Worte.
- nach drei
- zu
- Handel
- Behandlungen
- was immer dies auch sein sollte.
- XNUMX
- Typen
- für
- us
- benutzt
- Impfen Sie
- Version
- sehr
- Anzeigen
- vs
- wurde
- we
- waren
- welche
- mit
- noch
- Zephyrnet