NMPA offentliggjorde det færdige dokument "Guideline on Medical Device Real-world Study Design and Statistical Analysis" den 15. januar 2024. Udkastet til versionen blev frigivet den 28. september 2023.
Retningslinjens betydning
Retningslinjen vil gøre det lettere for oversøiske producenter at udforske Hainan Real-world Data-pilotprogrammet yderligere.
Hainan Boao Pilot Zone gør det muligt at bruge oversøisk ikke-godkendt medicinsk udstyr, IVD'er, lægemidler med klinisk hastende status i Kina. Mens de kommercialiserer og sælger deres produkter, kan producenter indsamle RWD gennem RWS i Hainan som lokal klinisk dokumentation i Kina for at understøtte deres nationale NMPA-registreringsgodkendelse. Det specielle program kan hæve deres adgang til det kinesiske marked til 4 måneder.
Hainan-regeringen frigav "Forordninger om administration af hastebrug af importerede lægemidler og medicinsk udstyr i Boao Lecheng International Medical Tourism Pilot Zone i Hainan Frihandelshavn” den 28. marts 2023. Dokumentet siger, at det IKKE kræver lokal typeafprøvning eller væsentlig bevisbyrde som den nationale godkendelse.
Vejledningens højdepunkter
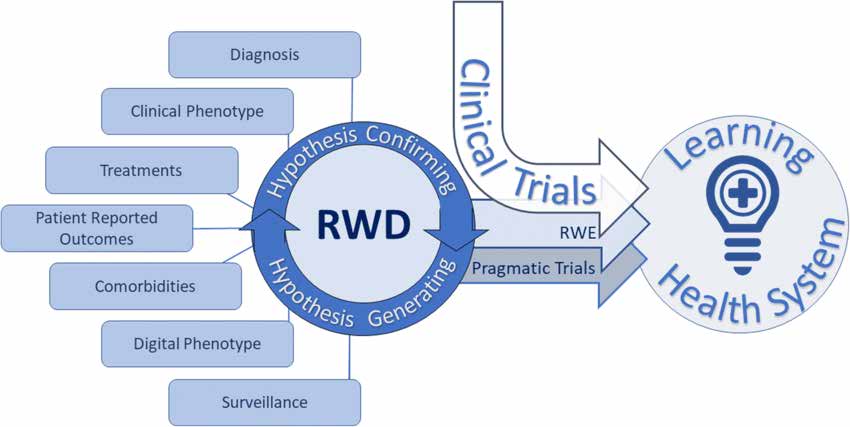
Dokumentet om undersøgelsesdesign og statistisk analyse beskriver forskellige typer forskning i den virkelige verden som følger:
Pragmatiske randomiserede kontrollerede forsøg (pRCT'er) er designet til at vurdere behandlingsresultater i rigtige sundhedsmiljøer. De anvender randomiserings- og kontrolgrupper til at evaluere interventionseffektiviteten. pRCT'erne giver højkvalitets beviser fra den virkelige verden og er velegnede til forskellige patientpopulationer og kliniske scenarier.
Observationel Real-World Research inkluderer forskellige undersøgelsesdesign:
- Beskrivende undersøgelsesdesign beskrive patientkarakteristika eller helbredstilstande uden at udlede kausalitet.
- Kohortedesign spore resultater i forskellige patientgrupper baseret på apparatbrug, med prospektive og retrospektive muligheder.
- Case-Control og afledte designs sammenligne patienter med og uden brug af udstyr og inkludere indlejrede case-kontrol- og case-kohortestudier.
- Real-World Data som eksterne kontroller involvere at bruge virkelige data som en kontrolgruppe, selvom der mangler detaljerede retningslinjer.
Dokumentet skitserer overvejelser for at designe virkelige forskningsprotokoller:
- Baggrund og mål: Definer forskningsbaggrund, -mål og sikkerheds- og effektivitetsspørgsmål baseret på eksisterende data.
- Gennemførlighedsvurdering: Evaluer muligheden for at udføre forskning i den virkelige verden under hensyntagen til datatilgængelighed, kvalitet og forvirrende variabler.
- Vælg passende forskningsdesign: Vælg designet baseret på mål, uanset om det er eksperimentelt eller observationsmæssigt.
- Undersøg flowchart: Opret et flowchart, der beskriver undersøgelsesprocessen, inklusive patientvalg, interventioner og undersøgelser.
- Definer undersøgelsespopulation: Definer klart inklusions- og eksklusionskriterier for undersøgelsespopulationen.
- Enhedseksponering: Vurder, hvordan patienter udsættes for enheden under hensyntagen til potentielle skævheder.
- Kontrolgruppe: Bestem passende kontrolgrupper til observationsstudier for at balancere forvirrende variabler.
- Resultatforanstaltninger: Definer resultatmål, herunder deres formål, definition og målemetoder.
- Dataindsamling: Udvikle dataindsamlingsformularer og ordbøger, specificering af datakilder, kvalitetsinformation og koblingsmetoder.
- Justering for konfunderende variabels: Identificer forvekslende variable og medtag/ekskluder dem med årsager.
- Opfølgningstid: Definer patientopfølgnings- eller observationstider for at besvare forskningsspørgsmål tilstrækkeligt.
- Prøvestørrelse og effektberegning: Beregn stikprøvestørrelse og statistisk styrke under hensyntagen til forskellige faktorer.
Det understreger også vigtigheden af kvalitetskontrol:
- Datakvalitet: Evaluer datakvaliteten med hensyn til repræsentativitet, fuldstændighed, nøjagtighed og mere.
- Bias Risiko: Beskriv foranstaltninger til at kontrollere bias-risici på forskellige stadier, herunder udvælgelse, information og forvirrende bias.
- Vurdering af bias: Genkend forskellige biastyper og vurder deres retning og størrelse.
- Etisk gennemgang: Sørg for, at etiske anmeldelser og informeret samtykke overholder reglerne.
Sammenligning af to versioner
Sammenlignet med udkastet, nævner det endelige dokument "Bestemmelse af konfunderende variabler, der skal ændres" i afsnittet om statistisk analyse.
I ikke-randomiserede forskningsdesigns i den virkelige verden er identifikationen af forvirrende variabler afgørende for at kontrollere bias. Tre kriterier bruges til at identificere dem: en variabel har en årsagssammenhæng med udfaldet, er forbundet med grupperingsvariablen (eksponering) og er ikke en mellemvariabel i årsagsvejen. En anbefalet tilgang involverer en rationel variabel udvælgelsesproces baseret på faglig viden og klinisk erfaring i samarbejde med kliniske og statistiske eksperter. For usikre variable foreslås følsomhedsanalyse, der giver årsager og understøtter data for inklusion/eksklusion. En konservativ tilgang til valg af variabler tilrådes, hvor man undgår urelaterede variabler og overvejer spørgsmål som multikollinearitet og interaktionseffekter, visualiseret gennem Directed Acyclic Graphs (DAG'er).
For en engelsk kopi af vejledningen, send venligst en e-mail info@ChinaMedDvice.com. Vi opkræver nominelle gebyrer for oversættelsen.
Se seneste nyt på Hainan Real World Data-programmet.
Se kommunikationsvejledning samarbejde med regulerende myndigheder.
Vis vores optaget webinar om Hainan-politikker.
- SEO Powered Content & PR Distribution. Bliv forstærket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk dig selv. Adgang her.
- PlatoAiStream. Web3 intelligens. Viden forstærket. Adgang her.
- PlatoESG. Kulstof, CleanTech, Energi, Miljø, Solenergi, Affaldshåndtering. Adgang her.
- PlatoHealth. Bioteknologiske og kliniske forsøgs intelligens. Adgang her.
- Kilde: https://chinameddevice.com/real-world-study-nmpa/
- :har
- :er
- :ikke
- 15 %
- 2023
- 2024
- 28
- a
- adgang
- nøjagtighed
- acykliske
- tilstrækkeligt
- administration
- rådgivet
- tillader
- også
- an
- analyse
- ,
- besvare
- tilgang
- passende
- godkendelse
- ER
- AS
- vurdere
- forbundet
- At
- Myndigheder
- tilgængelighed
- undgå
- baggrund
- Balance
- baseret
- BE
- skævhed
- fordomme
- byrde
- beregne
- CAN
- karakteristika
- afgift
- Kina
- Vælg
- tydeligt
- Klinisk
- samarbejde
- indsamler
- samling
- KOM
- overholde
- betingelser
- udførelse
- samtykke
- konservativ
- overvejelser
- Overvejer
- kontrol
- kontrolleret
- styring
- kontrol
- skabe
- kriterier
- afgørende
- data
- datakvalitet
- definere
- definition
- Afledt
- beskrive
- beskriver
- Design
- konstrueret
- designe
- designs
- detaljeret
- Detailing
- Bestem
- udvikle
- enhed
- Enheder
- forskellige
- rettet
- retning
- forskelligartede
- dokumentet
- gør
- udkast
- Narkotika
- effektivitet
- effekter
- understreger
- Engelsk
- sikre
- etisk
- evaluere
- bevismateriale
- eksisterende
- erfaring
- eksperimenterende
- eksperter
- udforske
- udsat
- Eksponering
- ekstern
- lette
- faktorer
- gennemførlighed
- Gebyrer
- endelige
- færdiggjort
- efter
- Til
- formularer
- Gratis
- yderligere
- Regering
- grafer
- gruppe
- Gruppens
- retningslinjer
- Helse
- sundhedspleje
- høj kvalitet
- Hvordan
- HTTPS
- identificere
- identificere
- betydning
- in
- omfatter
- omfatter
- Herunder
- inklusion
- oplysninger
- informeret
- interaktion
- Mellem
- internationalt
- indgriben
- interventioner
- involverer
- spørgsmål
- IT
- januar
- jpg
- viden
- mangler
- leder
- ligesom
- lokale
- Producenter
- Marts
- Marked
- måling
- foranstaltninger
- medicinsk
- medicinsk udstyr
- medicinsk udstyr
- nævner
- metoder
- måske
- måned
- mere
- national
- Behov
- målsætninger
- observation
- observationsstudie
- of
- on
- Indstillinger
- or
- vores
- Resultat
- udfald
- konturer
- oversøisk
- sti
- patient
- patienter
- pilot
- plato
- Platon Data Intelligence
- PlatoData
- Vær venlig
- politikker
- befolkning
- populationer
- potentiale
- magt
- behandle
- Produkter
- professionel
- Program
- bevis
- prospektive
- protokoller
- give
- leverer
- offentliggjort
- formål
- kvalitet
- Spørgsmål
- Tilfældigt
- rationel
- ægte
- virkelige verden
- årsager
- anbefales
- Registrering
- regler
- lovgivningsmæssige
- forhold
- frigivet
- kræver
- forskning
- Anmeldelser
- risici
- Sikkerhed
- siger
- scenarier
- Sektion
- valg
- Salg
- Følsomhed
- september
- indstillinger
- signifikant
- Størrelse
- Kilder
- særligt
- etaper
- statistiske
- Status
- undersøgelser
- Studere
- egnede
- support
- Støtte
- vilkår
- Test
- at
- deres
- Them
- de
- selvom?
- tre
- Gennem
- gange
- til
- Turisme
- spor
- handle
- Oversættelse
- behandling
- forsøg
- to
- typen
- typer
- Uncertain
- haster
- presserende
- brug
- anvendte
- ved brug af
- variabel
- forskellige
- udgave
- var
- we
- hvorvidt
- mens
- vilje
- med
- uden
- arbejder
- world
- zephyrnet