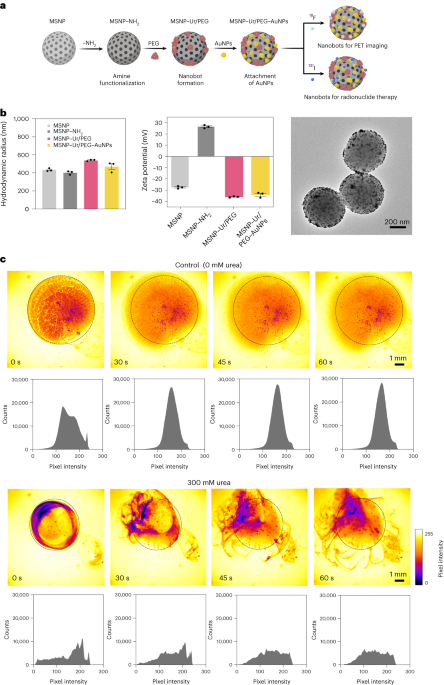
纳米机器人合成
纳米机器人的制备如前所述33。简而言之,MSNP 是使用改进的 Stöber 方法合成的41,将三乙醇胺(35g)、超纯水(20ml)和十六烷基三甲基溴化铵(CTAB;570mg)在95℃下搅拌反应30分钟。随后滴加原硅酸四乙酯(1.5ml);将混合物在 2℃ 下反应 95 小时,通过离心收集所得的 MSNP,并用乙醇洗涤(2,500 次,XNUMXg, 5分钟)。为了去除 CTAB 模板,将 MSNP 在酸性甲醇(1.8ml HCl,30ml 甲醇)中回流 24 小时。然后,通过离心收集 MSNP,并在乙醇中洗涤 2,500 次(XNUMXg,5 分钟),然后通过将 APTES(每毫克 MSNP 6 μl)添加到 MSNP(1 mg ml)中进行胺修饰 - 1)在70℃的70%乙醇溶液中,剧烈搅拌1小时。 MSNPs-NH2 收集并通过离心在乙醇中洗涤 1,150 次,在水中洗涤 XNUMX 次(XNUMX 次,XNUMXg, 5分钟)。 MSNPs-NH2 以 1mgml 的浓度重悬于 PBS 中 - 1 总体积为900μl,用戊二醛(100μl)在室温下活化2.5小时。活化的MSNPs-NH2 收集并通过离心在 PBS 中洗涤 1,150 次(XNUMXg,5分钟),重悬于脲酶溶液(3mg ml - 1)和异双功能 PEG(每毫克 1 kDa HS-MSNPs-NH 5 μg PEG2)在PBS中,并在室温下反应24小时。然后收集所得纳米机器人,并通过离心(1,150g,5 分钟),然后将它们重新悬浮在按先前所述制备的 AuNP 分散体中51,反应10分钟,离心彻底清洗(1,150次,XNUMXg,5 分钟)。
MSNPs、MSNPs-NH 的流体动力学尺寸分布和表面电荷2、纳米机器人和 AuNP 装饰的纳米机器人分别使用 Wyatt Mobius 动态光散射系统和 Malvern Zetasizer 进行测定。在所有情况下,浓度均为 20 μg ml - 1 采集时间为 5 秒,每个实验运行 XNUMX 次。对每种颗粒类型进行了三次测量。
FITC MSNP 的合成
制备FITC(2mg)、乙醇(5ml)和APTES(400μl)的混合物并搅拌30分钟。然后,遵循先前描述的 MSNP 合成方案,不同之处在于我们逐滴添加原硅酸四乙酯 (1.25μl) 与 FITC-APTES 混合物 (250μl)。获得 FITC 标记的纳米机器人的功能化步骤如上所述。
AuNPs的合成
AuNPs 使用报道的方法合成33。简而言之,所有材料均使用新鲜制备的王水清洗,用水彻底冲洗,并风干。随后,1 mM AuCl4 将溶液在集成到回流系统中的圆底烧瓶中加热至沸点,同时搅拌。随后,加入10ml柠檬酸钠溶液(30.8mM),并将溶液煮沸20分钟,产生红色。然后将溶液冷却至室温,同时搅拌1小时。所得金纳米粒子储存在黑暗中,并使用透射电子显微镜进行表征。
酶活性
纳米机器人的酶活性, 18F-纳米机器人和 131I-nanobots 使用酚红进行测量。为此,需要 2 μl 纳米机器人(1 mg ml - 1)添加到 96 孔板中,并与 200 µl 不同尿素溶液(0、50、100、200 mM)在 1.1 mM 酚红中混合。在 560°C 下随时间测量 37 nm 处的吸光度。
通过光学显微镜观察纳米机器人运动动力学
使用 Leica Thunder 显微镜、Hamamatsu 高速 CCD 相机和 ×1.25 物镜获取纳米机器人的光学视频。为此,将纳米机器人离心并重悬于 50μl PBS 中(最终浓度为 20mgml - 1)。然后,在培养皿中加入3ml PBS或300mM尿素溶液(PBS中)并在显微镜下观察。 5 μl 纳米机器人液滴(20 mg ml - 1)然后添加到充满液体的培养皿中,并以每秒 25 帧的速度录制视频。使用 ImageJ 软件以 15 秒的间隔分析 ROI 中的视频像素强度分布。
纳米机器人的放射性标记[18F]F-PyTFP
合成[18F]F-PyTFP
[18F]F-PyTFP 按照先前报道的方法在 Neptis xSeed 模块(优化放射化学应用)中合成33.
合成 18F标记的纳米机器人
纳米机器人被标记为[18F]F-PyTFP,基于先前建立的程序并进行了少量修改33。简而言之,200 μl 纳米机器人溶液(1 mg ml - 1)离心(10分钟,13,853g),重悬于 10 μl PBS(1 mM,pH 8)中,并与 4 μl [18F]F-PyTFP 于乙腈(约 37MBq)中,室温反应 35 分钟。温育后,反应混合物用水(200μl)稀释并通过离心纯化(5分钟,13,853g)。然后用水冲洗所得沉淀三次,然后在剂量校准器(CPCRC-25R,Capintec)中进行测量。放射化学产率计算为洗涤后纳米机器人中存在的放射性量与初始放射性量之间的比率。纯化后的放射化学纯度≥99%,通过放射薄层色谱 (radio-TLC) 测定,使用 iTLC-SG 层析纸 (Agilent Technologies) 和二氯甲烷和甲醇 (2:1) 分别作为固定相和流动相。使用TLC读数器(MiniGITA,Raytest)对TLC板进行分析。
稳定性 18F-纳米机器人
的稳定性 18F标记的纳米机器人使用以下介质测定:(1)300mM尿素,(2)水,和(3)来自荷瘤动物的尿液。 18F标记的纳米机器人(10μl)与相应的溶液(100μl)在室温下孵育1小时。然后,通过离心分离并收集纳米机器人和上清液,并在剂量校准器(CPCRC-25R)中测量放射性。
纳米机器人的放射性标记 131I
脲酶纳米机器人的放射性碘化是通过将纳米机器人与可注射的[131I]NaI 溶液 (925 MBq ml - 1; GE 医疗保健)。简而言之,400 μl 脲酶纳米机器人溶液(1 mg ml - 1)被离心(13,853g,5分钟),重悬于100μl PBS(10mM,pH 7.4)中,并与25μl或185μl注射液一起孵育[131I]NaI(分别约为 42.55 或 277.5MBq)30 分钟,具体取决于所需的最终活性。孵育后,通过离心纯化反应混合物(13,853g, 5分钟)。用水(100μl)洗涤所得沉淀25次。使用剂量校准器 (CPCRC-XNUMXR) 测定上清液和沉淀物中的放射性,并且通过放射 TLC 分析两个级分, 18F-纳米机器人。
动物模型开发
根据欧洲理事会指令 2010/63/UE 和内部指南对小鼠进行维护和处理。所有实验程序均得到 CIC biomaGUNE 伦理委员会和地方当局 (Diputación Foral de Guipuzcoa, PRO-AE-SS-276) 的批准。图像分析(PET 和 MRI)对动物的群体分布不知情。
通过向 C49BL/57JRj 雌性小鼠(6 周龄,Janvier)膀胱内注射 MB8 细胞(小鼠膀胱癌细胞系)产生膀胱癌原位小鼠模型。对于旨在确定肿瘤积累的实验(四组;详细信息如下),每组接种六只动物,根据精度分析确定,假设如下:所需精度为 20%;预期标准差,±20%;信心,95%;动物损失,20%。对于治疗效果实验(六组;详细信息如下),每组包括 XNUMX 只动物,使用单尾学生计算 t-检验,两个独立平均值之间的差异,假设如下:原假设,治疗不影响肿瘤生长; α, 0.05; 1 − β, 0.95;标准差,±50%;组间预期差异,50%;动物损失,20%。由于操作原因,实验分两批进行,两批均包含一个对照组(表 2),然后将所有动物合并。为了建立肿瘤,通过吸入纯 O3 中的 XNUMX% 异氟烷麻醉小鼠2 并在 1.0% O 中维持 1.5–100% 异氟烷2。然后,排空膀胱,并通过膀胱内滴注 50μl 聚-尿路上皮诱导化学损伤。l-赖氨酸 (Sigma-Aldrich) 通过 24 号导管 15 分钟。随后,再次排空膀胱并取出MB49细胞(105 细胞)在高糖DMEM(100μl)中滴注1小时,然后拔除导管并通过腹部按摩排空膀胱。在整个实验过程中,对小鼠进行监测和称重,以进行健康和福利监测。如果体重减轻超过 20% 或根据临床症状,根据负责兽医的标准,则应用人类终点。
肿瘤大小追踪
MRI 研究在肿瘤诱导后 7 天和 14 天进行,使用配备 7 mT m 梯度 BGA-70S 的 30 T Bruker BioSpec USR 12/440 扫描仪 (Bruker BioSpin) - 1 和一个用于射频的 112/086 QSN 谐振器 (T12053V3)14 传输和用于射频接收的大鼠脑表面线圈(T11205V3)(均工作在 300MHz)。动物用异氟烷麻醉(4% 用于诱导,1.5% 用于维持在 50% OXNUMX 中)2/50%氮2 混合物)并放置在兼容 MR 的支架上。使用与 MR 兼容的监测设备(型号 1030 SA,小动物仪器)连续监测体温和呼吸速率,该设备连接到小型啮齿动物空气加热器系统以维持体温。获取参考图像后,使用基于自旋回波的扩散加权成像序列对肿瘤进行成像,使用以下参数:回波时间(TE) = 22.3 ms, 重复时间 (TR) = 2,500 毫秒, n = 2 个平均值,一张 A0 图像(基础图像 b = 0 秒 毫米 - 2)和一张使用 (1, 0, 0) 方向上的扩散梯度(具有梯度持续时间)获取的 DW 图像 δ = 4.5 ms 和梯度分离 Δ = 10.6 ms,给出 b = 650 秒 毫米 - 2, 16 × 16 mm2 视场,图像矩阵大小为 160 × 160 点,20 个厚度为 0.5mm 的连续切片(无间隙,以交错模式采集),每像素带宽为 192.9Hz。为了可视化肿瘤,使用 ImageJ 软件对图像进行后处理,划分使用扩散梯度获取的图像(b = 650 秒 毫米 - 2)由那些未经(b = 0 秒 毫米 - 2),并应用 3D 高斯滤波器(σx = σy = σz = 0.7) 的结果。手动描绘肿瘤以确定其体积。
体内生物分布
肿瘤诱导后第15天,将小鼠随机分为四组,以获得组间均匀的平均肿瘤体积分布。膀胱内注射 3μl 的 100 小时后进行 PET-CT 扫描(MOLECUBES β 和 X-CUBE 扫描仪) 18F-BSA(第 1 组和第 2 组)或 18F-脲酶(第 3 组和第 4 组)纳米机器人,浓度为 200 μg ml - 1,使用水(第 1 组和第 3 组)或 300 mM 尿素水溶液(第 2 组和第 4 组)作为载体(表 1)。为了采集图像,对动物进行麻醉(纯氧中的 5% 异氟醚)诱导,并将其置于仰卧位,然后按摩腹部区域以排空膀胱。紧接着,对应的 18F标记的纳米机器人(18F-BSA/18通过24号导管将F-脲酶(水/尿素溶液)滴注到膀胱中并孵育1小时,然后移除导管,排空膀胱并使小鼠从麻醉中恢复。在 t 给药后3小时,将动物重新麻醉并采集10分钟静态全身PET图像,然后进行CT扫描。使用具有随机、散射和衰减校正的 3D 有序子集期望最大化重建算法重建 PET 图像。使用 PMOD 图像处理工具对同一只小鼠的 PET-CT 图像进行共同配准和分析。通过使用 3D 轮廓工具在上膀胱区域创建感兴趣的体积并测量每个器官的活动(经过衰减校正),获得放射性浓度与时间的关系图。通过应用校准因子对结果进行校正,然后通过 MRI 得出的肿瘤体积进行标准化。
离体研究
组织病理学分析
完成所有成像后,选择膀胱(n 在无菌条件下从荷瘤动物和健康动物中取出(每组= 3)并立即固定在4%甲醛中。然后,将膀胱包埋在石蜡中,然后取出 2-3μm 切片进行苏木精-伊红染色。从组织病理学检查的所有条件下获得代表性图像。
ICP-MS分析
测量在 Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) 和 ASX-560 自动进样器 (CETAC Tech) 上进行。完成所有成像后,处死动物,并选择膀胱(n = 每组2个;四组)收集并在 1 ml HNO 中消化3:HCl(4:1 混合物)。将分散体煮沸直至器官完全溶解。然后,将溶液冷却至室温,并使用 ICP-MS 进行分析,以确定每个样品中 Au 的浓度,将结果转换为每克组织注射剂量的百分比 (%ID g - 1).
免疫组织化学和共焦显微镜成像
对于免疫组织化学分析,荷瘤动物接受了水或 300 mM 尿素中的 FITC 标记的纳米机器人(n = 4 每组),如上所述,用于 PET-CT 研究。此外,没有纳米机器人的荷瘤动物作为对照组(n = 2)。在所有情况下,收集膀胱,冷冻并切成 10 µm 切片,立即在 10% 甲醛中固定 15 分钟,用 10 mM PBS 洗涤,然后在 50 mM NH 中孵育4Cl 在 PBS 中浸泡 5 分钟,然后再次用 PBS 冲洗。使用甲醇:丙酮(1:1)在室温下进行透化5分钟,并使用PBS中的0.1%Triton进行5分钟。 PBS 清洗后,样品用 5% BSA–0.5% Tween 的 PBS 溶液在室温下饱和 15 分钟,并与小鼠抗 FITC(1:1,Abcam)在 100% BSA 中的溶液一起在室温下孵育 5 小时–0.5% 吐温。用 10 mM PBS 清洗切片 5 次,每次 30 分钟,并用二抗 Alex Fluor 647 驴抗小鼠 IgG(Molecular Probes,Life Technologies,1:1,000)在 5% BSA–0.5% Tween 中室温孵育 3 分钟在 PBS 中,再次在 PBS 中洗涤(5 × 4,6分钟),并使用带有 2-二脒基-5-苯基吲哚(DAPI;Molecular Probes,Life Technologies)的 ProLong 抗淬灭试剂盒进行固定。使用 Leica STELLARIS 10 共焦显微镜(UPV/EHU Scientific Park)采集图像,所有切片的设置均相同:×4 放大倍数,平铺成像和拼接(通常为 5 × 405 视野)。 DAPI 的激光线和检测窗口为 440 nm 和 503–489 nm,FITC 白色激光的激光线和检测窗口为 494 nm 和 602–653 nm,Alexa660 白色激光的激光线和检测窗口为 836 nm 和 647–XNUMX nm。
光学清算
用4%多聚甲醛和PBS灌注后,取出膀胱样本,在4%多聚甲醛中4℃固定过夜,然后用5%低熔点琼脂糖包埋在0.8ml注射器中,形成圆柱块,方便安装在石英比色皿中。使用甲醇:H 使整个块逐渐脱水2O,4°C(30%:70% 1小时,50%:50% 1小时,70%:30% 1小时,100%:0% 1小时,然后100%甲醇过夜,再次4小时),最后浸入苯甲醇-苯甲酸苄酯(BABB)作为折射率匹配溶液中进行成像。为了对绿色 FITC 纳米机器人与商业红色颗粒进行体外比较,我们使用 DiagNano (Creative Diagnostics) 红色荧光二氧化硅纳米颗粒,直径为 1 µm,耐 BABB 清除。
自发荧光和偏振 sLS 成像
光片成像在 MacroSPIM 上进行,MacroSPIM 是巴塞罗那 IRB 开发的一种用于透明全器官成像的定制系统44,45。简而言之,将样品嵌入琼脂糖块中,与样品一起清洗并在石英比色皿内成像。自发荧光成像使用 488、561 或 638nm 的激光,通过 50mm 消色差双合柱面透镜(ACY254-050-A,Thorlabs)提供照明。为了减少条纹伪影,光片通过谐振扫描仪 SC-10 (EOPC) 沿着配备 G4 322288322 mm 消色差双合透镜 (QI Optic Photonics) 的 100f 望远镜旋转。通过带通或长通荧光滤光片收集组织自发荧光,并用 ORCA Flash v2 相机(Hamamatsu Photonics)记录。使用×9.6变焦、×8镜头和×2镜筒镜头以×0.6进行成像。光片在整个视场中被展平,产生 5–6μm 的轴向分辨率。 3D 成像以 2.5μm 的步长完成。全膀胱成像在2 × 3或3 × 4内进行 XY 瓷砖,取决于器官的大小。
sLS 成像是通过移除荧光滤光片或使用任何传输激光的滤光片来实现的。光片旋转减少了激光散斑噪声,从而导致激光相干性的时间平均,如前所述52。照明中线性光片偏振的方向是通过旋转枢轴扫描仪之前的半波片(AHWP05M-600,Thorlabs)来控制的。在检测中滤光轮之前使用旋转线性偏振器(LPVISC100,Thorlabs)对检测到的信号进行偏振选择,在荧光检测中引入> 50%的强度损失。虽然 sLS 信号分布通常会随着偏振器的方向而变化,但组织自发荧光信号仍然不受偏振器旋转的影响。 sLS 在 BABB 中产生 2.4±0.3μm 的空间分辨率,与荧光光片成像的分辨率相当(通过将高斯函数拟合到 XY 单个粒子的图像响应,补充图。 8l–米)并且接近空气中的理论分辨率(1.53 μm,最大微距变焦×0.2时数值孔径(NA) = 8)。
图像处理和 3D 分析
光片数据集的图像处理、分割和分析是使用 ImageJ/Fiji 完成的,而图 3 和 4 是用 Imaris Viewer 9.9 生成的(https://imaris.oxinst.com/imaris-viewer)和补充视频 3 是用 Imaris 9 生成的(https://imaris.oxinst.com/)(位平面,牛津仪器)。使用 MosaicExplorerJ 拼接平铺光片数据集53。使用自定义 ImageJ/Fiji 宏执行膀胱组织 3D 分割,以在虚拟模式下对大体积进行半自动 3D 注释。简而言之,第一个脚本“Macro1”加载 3D 图像堆栈,使用户能够在多个平面中对 ROI 进行注释,并自动对 ROI 进行插值以生成和导出 3D 掩模。每 15 个平面(每 37.5 µm)绘制 ROI,以促进良好的分割连续性,同时将注释保持在合理的最低限度。第二个脚本“Macro2”在 3D 掩模之间或 3D 掩模与原始数据之间逐个平面执行数学或布尔运算,而不将整个堆栈加载到内存中,并将结果保存为新堆栈。所有掩模都是通过注释自发荧光图像生成的。
肿瘤和健康组织表层(图 1) 3)是使用斐济的魔杖和套索工具在面罩中的膀胱腔上描绘出来的。将此第一次迭代称为 BC1,Macro1 的后续运行会自动将该 3D 轮廓膨胀指定的像素量,以产生新的掩模迭代 BC2、BC3 等,膨胀不断增加。包含肿瘤和健康组织的第一层掩模 L1 是通过从 BC1 中减去掩模 BC2 等获得的,产生作为同心层的 L2 和 L3。通过使用魔杖和套索工具注释肿瘤以创建掩模 T1 来获得最接近腔的肿瘤体积,同时在掩模 U3 中单独检测健康尿路上皮 1D 层。从 L1 中减去 U1 得到肿瘤的表面层,依此类推:L2 − U1,L3 − U1。相反,从 L1 中减去 T1 即可获得尿路上皮的第一层。图中所有层 3 被定义为具有33微米的厚度。
使用相同的宏和程序套件(ImageJ 魔杖工具、500μm 数字侵蚀等)来描绘和分割膀胱组织的内部部分,然后估计膀胱的内部组织体积(图 XNUMX)。 4,详情请参阅上文)。在斐济,通过结合散射信号和掩模创建了散射信号强度的直方图。
RNT 使用 131纳米机器人
肿瘤植入后第 8 至 15 天,将动物分为六组(第 1-6 组),试图在各组之间实现相似的平均肿瘤体积(表 2)。在实验中,对动物进行麻醉(纯 O 中 5% 异氟烷)2)并在通过按摩腹部区域排空膀胱之前保持仰卧位。随后立即加入 100 μl 浓度为 400 μg ml 的适当处理剂 - 1 (表 2)使用 24 号导管注入膀胱。拔除导管前,治疗剂和媒介物(水或尿素)在膀胱中保留 1 小时。通过腹部按摩再次排空膀胱,将笼中的小鼠从麻醉中苏醒,治疗后24小时更换动物笼锯末以去除放射性污染。
通过 MRI 确定治疗效果
对每只小鼠进行两项 MRI 研究:(1)在肿瘤接种后第 7 天至 14 天之间,将动物随机分组并测量初始(治疗前)肿瘤体积; (2)在肿瘤接种后(治疗后)第16天至21天之间评价治疗效果。根据可用性,使用 7T Bruker BioSpec 和 11.7T Bruker BioSpec 扫描仪(均配有 ParaVision 7 软件)进行 MRI。这不会影响结果,因为外场对于解剖成像并不重要14。使用与上述相同的成像参数和处理进行成像实验(肿瘤大小追踪)。就 11.7 T 扫描仪而言,其设置包括用于接收的小鼠心脏表面线圈和用于传输的体积线圈。每个切片中的肿瘤体积是根据手动绘制的覆盖肿瘤区域的感兴趣体积来确定的。
统计分析
在 PET 成像研究中,注射剂量的百分比 (% ID) 和单位肿瘤体积的注射剂量 (% ID cm - 3)使用单向方差分析进行比较。使用 Tukey 的多重比较测试确定组之间的差异。 RNT 部分中的 NTV 是从 t- 未配对值的测试。假设数据分布是正态的,但这没有经过正式测试。使用 GraphPad Prism v.8 进行统计分析。
报告摘要
有关研究设计的更多信息,请参阅 自然投资组合报告摘要 链接到这篇文章。
- :是
- :不是
- ][p
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- 关于
- 以上
- 按照
- 积累
- 实现
- 后天
- 收购
- 获得
- 横过
- 活性
- 要积极。
- 活动
- 添加
- 添加
- 另外
- 管理
- 影响
- 后
- 之后
- 再次
- 针对
- 加拿大航空
- AL
- 亚历克斯
- 算法
- 所有类型
- 允许
- 沿
- 阿尔茨海默氏症
- 其中
- 量
- 淀粉样蛋白
- an
- 分析
- 分析
- 锚
- 和
- 动物
- 动物
- 抗体
- 任何
- 应用领域
- 应用的
- 应用
- 适当
- 批准
- 旱厕
- 保健
- 国家 / 地区
- 刊文
- AS
- 假定
- 假设
- At
- 当局
- 自动
- 可用性
- 可使用
- 平均
- b
- BABB
- 带宽
- 基础
- BE
- before
- 行为
- 作为
- 如下。
- 之间
- 阻止
- 身体
- 煮沸
- 都
- 大脑
- 负担
- 但是
- by
- 笼子
- 计算
- 调用
- 相机
- 癌症预防
- 案件
- 例
- 防治荒漠化公约
- 细胞
- 细胞
- 更改
- 充
- 化学
- 清除
- 点击
- 临床资料
- 关闭
- 盘
- 组合
- 结合
- 商业的
- 委员会
- 可比
- 相比
- 比较
- 完全
- 完成
- 浓度
- 流程条件
- 条件
- 进行
- 信心
- CONFIRMED
- 连续
- 连续性
- 一直
- 控制
- 受控
- 反过来
- Cool
- 更正
- 矫正
- 相应
- 评议会
- 再加
- 覆盖
- 创建信息图
- 创建
- 创造
- 创意奖学金
- 标准
- 危急
- CT扫描
- 习俗
- 切
- 黑暗
- data
- 数据集
- 天
- 一年中的
- de
- 定义
- 交付
- 根据
- 描述
- 设计
- 期望
- 详情
- 检测
- 检测
- 确定
- 决心
- 确定
- 发达
- 设备
- 诊断
- DID
- 差异
- 差异
- 不同
- 扩散
- 数字
- 稀
- 方向
- 疾病
- 碟
- 分散
- 分配
- 分布
- 分
- do
- 不
- 完成
- 剂量
- 画
- 下降
- 为期
- 动态
- 动力学
- e
- Ë&T
- 每
- 易
- 回音
- 功效
- 或
- 嵌入式
- enable
- 使
- 端点
- 增强
- 整个
- 酶促的
- 配备
- 成熟
- 编制
- 评估
- 醚(ETH)
- 伦理
- 欧洲
- 评估
- 所有的
- 检查
- 突破
- 除
- 期望
- 预期
- 实验
- 试验
- 实验
- 解释
- 出口
- 外部
- 促进
- 因素
- 女
- 部分
- 无花果
- 数字
- 满
- 过滤
- 过滤器
- 最后
- 终于
- (名字)
- 配件
- 固定
- Flash
- 其次
- 以下
- 针对
- 申请
- 甲醛
- 正式地
- 向前
- 四
- 止
- 冻结
- 功能
- 进一步
- 差距
- ge
- GE医疗集团
- 其他咨询
- 生成
- 产生
- 给予
- 非常好
- 渐变
- 克
- 绿色
- 团队
- 组的
- 事业发展
- 方针
- 有
- he
- 健康管理
- 医疗保健
- 健康
- 胸襟
- HTTPS
- 黄
- 人
- ICAP
- ID
- 相同
- if
- 图片
- 图像分析
- 图片
- 同步成像
- 立即
- 沉浸
- 提高
- in
- 包括
- 结合
- 增加
- 孵化
- 孵化
- 孵化
- 独立
- 指数
- 感应
- 信息
- 初始
- 内
- 内
- 文书
- 集成
- 互动
- 兴趣
- 内部
- 成
- 介绍
- 迭代
- 迭代
- 它的
- KDA
- 保持
- 试剂盒
- l2
- 大
- 激光器是如何工作的
- 激光器
- 层
- 层
- 离开
- 左
- 光学棱镜
- 镜头
- 生活
- 光
- Line
- 友情链接
- 链接
- 装载
- 负载
- 本地
- 离
- 宏
- 宏
- 保持
- 保养
- 手动
- 面膜
- 面膜
- 匹配
- 材料
- 物料
- 数学的
- 矩阵
- 最多
- 手段
- 衡量
- 测量
- 测量
- 测量
- 媒体
- 内存
- 美利奴
- 甲醇
- 方法
- 小鼠
- 显微镜
- 显微镜
- 分钟
- 最低限度
- 未成年人
- 杂
- 混合物
- ML
- 联络号码
- 时尚
- 模型
- 模型
- 改性
- 模块
- 分子
- 监控
- 监控
- 运动
- 老鼠
- MRI
- MS
- MT
- 多
- 纳米技术
- 自然
- 网络
- 一般
- 全新
- 没有
- 噪声
- 正常
- 目标
- 观察
- 获得
- 获得
- of
- 老
- on
- 一
- 操作
- 操作
- 运营
- 优化
- or
- Orca
- 原版的
- 超过
- 过夜
- 牛津
- 氧
- 纸类
- 参数
- 地形公园
- 部分
- 粒子
- PBS
- 衣夹
- 渗透
- 为
- 执行
- 施行
- 宠物
- Petri网
- 阶段
- 枢
- 像素
- 放置
- 平面
- 飞机
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 点
- 点
- 个人档案
- 位置
- 定位的
- 平台精度
- 准备
- 当下
- 先前
- 程序
- 程序
- 处理
- 逐步
- 协议
- Qi
- 量
- 广播电台
- 随机
- 随机化
- RAT
- 率
- 比
- 应对
- 反应
- 读者
- 合理
- 原因
- 收到
- 招待会
- 记录
- 恢复
- 红色
- 减少
- 减少
- 减少
- 参考
- 地区
- 保持
- 遗迹
- 去掉
- 去除
- 删除
- 报道
- 报告
- 代表
- 必须
- 研究
- 耐
- 分辨率
- 分别
- 响应
- 导致
- 导致
- 成果
- 机器人
- Room
- 运行
- s
- SA
- 同
- 保存
- 扫描
- 零落
- SCI
- .
- 脚本
- 其次
- 次
- 部分
- 部分
- 看到
- 段
- 分割
- 选
- 序列
- 已服务
- 设置
- 几个
- 片
- 如图
- 信号
- 信号分布
- 类似
- 自
- 单
- SIX
- 尺寸
- 切片
- 小
- So
- 钠
- 软件
- 方案,
- 解决方案
- 空间的
- 稳定性
- 堆
- 堆栈
- 统计
- 矢
- 步骤
- 存储
- 条纹
- 学生
- 研究
- 随后
- 后来
- 套房
- 磁化面
- 症状
- 合成
- 系统
- T
- T1
- 表
- 服用
- 科技
- 技术
- 望远镜
- 模板
- 十
- test
- 测试
- 这
- 其
- 他们
- 然后
- 理论
- 治疗
- 治疗
- Free Introduction
- 透
- 那些
- 三
- 三维
- 通过
- 始终
- 次
- 时
- 组织
- 至
- 一起
- 工具
- 工具
- 合计
- 对于
- 向
- 转型
- 治疗
- 海卫一
- 试图
- 肿瘤
- 二
- 类型
- 一般
- 不受影响
- 下
- 直到
- 上
- 用过的
- 用户
- 运用
- 价值观
- 汽车
- 与
- 通过
- 视频
- 视频
- 查看
- 在线会议
- 想像
- 体内
- 体积
- 卷
- 容积
- 沃克
- 魔杖
- 是
- 洗涤
- 水
- we
- 周
- 重量
- 福利
- 为
- 轮
- 这
- 而
- 白色
- 窗户
- 中
- 也完全不需要
- X
- 产量
- 生产
- 产量
- 和风网
- 放大