美国国家标准与技术研究院(NIST)8月XNUMX日发布指南,就March in Rights的使用征求意见。 SpicyIP 实习生 Jyotpreet Kaur 撰写了有关这些权利、指南中提议的变更以及印度对类似安排的立场的文章。这篇文章是根据 Swaraj 的意见撰写的。 Jyotpreet 是德里国家法律大学法学院三年级学生,他对知识产权和竞争法感兴趣,并希望研究它们之间的相互作用。她以前的帖子可以访问 相关信息.

美国对介入权的审查以及对印度同行的一些问题
作者:乔特普雷特·考尔
正如许多读者所知,美国政府,特别是通过其美国贸易代表办公室,在印度获得单一强制许可并经过严格司法审查后,多年来一直对印度进行骚扰。直到 COVID-19 期间 这种压力不再如此明目张胆地施加 (改为“商业秘密”)。事情发生了一个非常有趣的转变,看起来美国现在正在推动制定指导方针,以扩大美国如何在国内应用自己版本的强制许可,即“进入”权利!医疗保健成本不断增加所带来的国内压力似乎已经达到了最终需要重新审视其专利制度如何影响成本的程度。 8月XNUMX日,美国国家标准技术研究院(NIST)发布了草案 方针 邀请人们就利用“进军”权促进拜登政府降低药品价格的目标发表评论。据 NIST 称,美国政府通过各大学、非营利组织和企业在研发方面投资约 115 亿美元。介入权是允许政府在满足某些条件的情况下要求对该投资产生的发明授予许可的条款。值得注意的是,尽管之前就曾提出过“介入权”的“威胁”,但自该法案出台以来的 44 年来,这些权利并未得到实际行使。这些准则草案的目标似乎是扩大行使介入权的标准。美国卫生与公众服务部部长 被誉为 这是“确保美国纳税人的投资获得公平回报的有力工具”,
平衡创新与公共利益:《拜杜法案》相对于权利进军的目标
1980 年颁布的拜杜法案 (Bayh-Dole Act) 突出了联邦政府的“游行”权利。如上所述,介入权类似于政府可以采取的固有措施,以防那些通过政府资助的研究开发知识产权的人未能充分将知识产权商业化。在行使这一权力时,政府可以干预和指导知识产权的使用或将其许可给第三方。专利的所有权仍然属于该研究所——它只是向第三方许可的权利,如果政府选择行使这项权利,则该权利将有利于政府。这项权利的目的是使政府能够在发明人机构未充分利用相关公共资助知识产权的情况下充分发挥其潜力。
《Bayh-Dole 法案》下的“游行权”的行使是根据《美国法典》第 35 条设想的。 § 203,要求满足 4 项法定标准。 (一)未能有效实现学科创新; (ii) 需要缓解未解决的健康或安全需求; (iii) 不满足公众使用该发明的要求; (iv) 未履行合同义务,尤其是第 s 条规定的义务。 204.,要求专利产品在美国大量生产,直到其在商业上不可行。
迄今为止,尽管有人请愿,但美国政府尚未行使游行权。第一次提出行使游行权的请愿书是在 细胞再生素 政府拒绝行使这项权利。从以下数据可以看出,这一趋势一直持续至今 八份请愿书 已向 NIH 提交并已处理。
改革入场权:灾难的秘诀还是成功的秘诀?
该指南引入的变化之一是澄清了在行使介入权之前机构与承包商的非正式磋商流程,并增加了机构在非正式磋商后必须对承包商做出回应的允许时间范围,从 60天到120天。
除此之外,新指南还引入了三步法,似乎澄清了调用介入权的流程(见图)。首先,要看看《拜杜法案》是否适用于相关发明——这里检查所述发明是否是“主题发明”以及是否是政府资助的。其次,上述四项法定标准是否适用于本案,最后,行使介入权是否符合拜杜立法的整体精神及其目标。
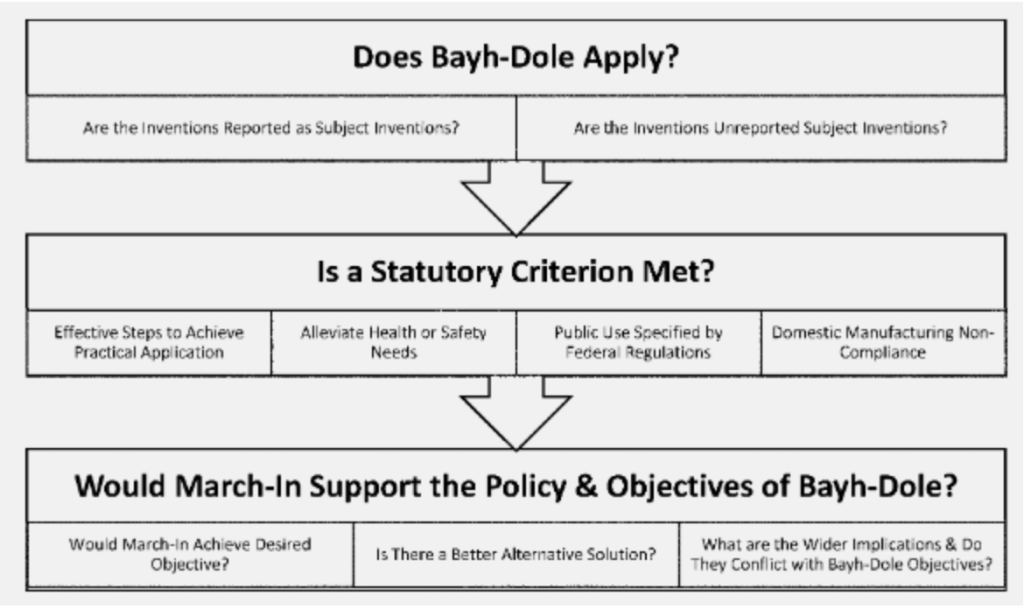
也许最重要的变化出现在第二步,同时援引第一个法定标准,即专利权人未能或将未能采取有效措施在其使用领域实现“主题创新”。该指南增加了对可能“不合理地限制公众发明的可用性”的因素的考虑。在此,指导方针引入了合理定价的要求,而这一要求此前并未被视为行使“介入”权的标准。该指南提出了这样一个问题:“承包商或被许可人是否因为价格过高而仅向少数消费者或客户提供产品”。
这与政府先前的立场形成鲜明对比,这可以从政府之前以高定价作为介入的基础的互动中得到证明。 2004年,请愿者提议美国国立卫生研究院援引这项措施,因为一种名为“ 诺维尔 和一种青光眼治疗药物,名为 夏拉坦。 2012年,人们对高价格的担忧 诺维尔 在 NIH 之前再次被提出。 2016年,请愿者再次对高价提出了担忧。 坦迪 与其他高收入国家相比,该药物每粒成本约为 98 美元。然而,在所有这些案例中,NIH 都仅仅以定价为由拒绝行使其介入权,并给出了其他拒绝这样做的理由。
当指导方针谈到合理定价时,他们未能解决什么是“合理”价格,从而将其留给联邦政府自行决定。
支持者称赞这些指导方针是进步的措施,使美国公众更容易获得昂贵的药物,并将“理应”属于他们的东西归还给公众,因为联邦政府资助的研究基本上是用纳税人的钱来支付的。
另一方面,那些反对这些指导方针的人认为,这些指导方针与《拜杜法案》的目标背道而驰,因为定价从未被设想为行使“介入”权利的基础。美国商会称这些指导方针是“政府没收”的一种形式。其他人则认为这样的条款会抑制创新和竞争——这是该法案的主要目标。 有人认为 该法案的目标是鼓励公共和私营部门之间的合作,以将新颖的想法引入市场,这与当前指南所寻求的目标不同,即缓解药物准入问题和市场效率低下。 约瑟夫艾伦 还认为这些指导方针是“毒丸”,因为虽然它的目标是“大型制药公司”,但最终会伤害实际上受到《拜杜法案》保护的小发明家,因为大多数“大型制药公司” ' 研究不是政府资助的。与此同时,他认为,这些指导方针的制定仅考虑了高昂的药品价格,而忽略了拜杜法案还涵盖能源、农业和环境保护等其他行业,这些行业现在将受到新冠病毒疫情的影响。这些指导方针的缺点。
印度前线发生了什么?
既然这场辩论在美国得到了更加严肃的对待,这会对印度产生溢出效应吗?尽管印度的纸面专利灵活性相当强大,并且有些条款(例如第 3(d) 条)已经显现出来,但我们尚未看到许多其他条款转化或实践为现实世界的效果。例如,尽管已经讨论了其他几种药物的强制许可,但这些讨论没有任何结果。目前尚不清楚其中有多少是由于外部压力,例如各种自由贸易协定,当然还有美国贸易代表办公室;其中有多少可能是由于其他原因造成的。例如,尽管印度在 Covid-19 大流行期间处于要求知识产权豁免的前沿,但讽刺的是,在国内层面,尽管政府有 它可以采取的选项数量,没有采取太多行动。例如,政府未能提供 知识产权归属清晰 (Covaxin)及其向哈夫金研究所“授予批准”的行为本应受到“健康权”公共利益的损害,正如人们所争论的那样 相关信息 和 相关信息。同样,印度政府拒绝通过 RTI 披露临床试验数据,援引第 8(1)(d) 和 (e) 条规定,知识产权作为豁免披露的理由。国家在拒绝公布数据时援引了知识产权保护,但没有采取权衡这种保护与所涉公众利益的平衡行为(TRIPS 第 39(3) 条也对此进行了规定)。因此,与国际立场相反,国家未能以开放的方式行使自己的知识产权。
无论如何,美国对迄今为止他们在国际上采取强硬立场反对的事情进行的内部讨论是一个值得关注的有趣进展。在国内,生物技术系最近发布了自己的一套针对 DBT 资助产生的发明的知识产权指南。进展如何?这是否标志着另一次尝试复兴失败的《公共资助知识产权保护和利用法案》的开始?与此同时,政府也出台了 国家医药医疗技术领域研发与创新政策 (见政策草案 相关信息)于 2023 年 XNUMX 月“改造”印度制药行业,并以双重方式“促进”这些行业的研发——加强研究基础设施和促进制药行业的研究。值得注意的是,该政策根本没有解决有关知识产权的问题。也许这些都是值得思考的问题,我们将尝试将这些问题放在一个单独的帖子中!
- :具有
- :是
- :不是
- :在哪里
- $UP
- 1
- 120
- 1
- 20
- 2012
- 2016
- 2023
- 203
- 35%
- 41
- 60
- 8
- 8日
- a
- 关于
- 以上
- ACCESS
- 访问
- 无障碍
- 根据
- 法案
- 操作
- 通
- 添加
- 地址
- 充分
- 影响
- 后
- 再次
- 驳
- 机构
- 农业
- 针对
- 类似的
- 所有类型
- 缓和
- 让
- 还
- 尽管
- 美国人
- 其中
- 其中包括
- an
- 和
- 另一个
- 任何
- 出现
- 相应
- 应用的
- 适用
- 使用
- 约
- 保健
- 争论
- 争论
- 主张
- 围绕
- 安排
- AS
- 问
- At
- 尝试
- 创作
- 可用性
- 可使用
- 背部
- 平衡
- BE
- 因为
- 很
- before
- 开始
- 作为
- 之间
- 拜登
- 亿
- 带
- 企业
- by
- 被称为
- 来了
- CAN
- 案件
- 例
- 一定
- 房间
- 更改
- 更改
- 检查
- 情况
- 引用
- 临床资料
- 合作
- 如何
- 注释
- 商业
- 商业
- 相比
- 竞争
- 关心
- 关注
- 条件
- 考虑
- 咨询
- 消费者
- 继续
- 承包商
- 合同
- 对比
- 价格
- 成本
- 对口
- 国家
- 情侣
- 课程
- 覆盖
- 占地面积
- Covid-19
- COVID-19大流行
- 标准
- 合作伙伴
- data
- 日期
- 一年中的
- 辩论
- 十二月
- 德里
- 问题类型
- 尽管
- 发展
- 研发支持
- 直接
- 灾害
- 透露
- 泄露
- 酌处权
- 讨论
- 讨论
- do
- 不
- 运输(国内)
- 草案
- 准则草案
- 药物
- 毒品
- 两
- ,我们将参加
- 在COVID-19期间
- e
- 每
- 此前
- 有效
- 只
- 影响
- enable
- 鼓励
- 结束
- 能源
- 从事
- 确保
- 环境
- 特别
- 本质上
- 醚(ETH)
- 事件
- 不断增加
- 证明
- 例子
- 锻炼
- 扩大
- 扩张
- 外部
- 因素
- 失败
- 失败
- 失败
- 失败
- 公平
- 联邦
- 联邦政府
- 联邦政府
- 毡
- 部分
- 提交
- 终于
- (名字)
- 第一次
- 遵循
- 以下
- 针对
- 前面
- 第一线
- 申请
- 公式
- 向前
- 四
- FRAME
- 止
- 前
- 充分
- 受资助
- 资金
- 其他咨询
- 越来越
- 给
- 目标
- 治理
- 政府
- 各国政府
- 官立
- 授予
- 陆运
- 方针
- 民政事务总署
- 手
- 事件
- 伤害
- 有
- he
- 健康管理
- 医疗保健
- 这里
- 相关信息
- 于此
- 高
- 艾滋病毒
- 主页
- 创新中心
- 但是
- HTML
- HTTPS
- 人
- i
- 思路
- if
- ii
- 三
- 图片
- 影响
- 重要
- in
- 增加
- 印度
- 印度
- 印度政府
- 行业
- 效率低下
- 非正式的
- 基础设施
- 固有
- 創新
- 输入
- 例
- 代替
- 研究所
- 知识分子
- 知识产权
- 相互作用
- 互动
- 兴趣
- 有兴趣
- 有趣
- 内部
- 国际
- 干预
- 成
- 介绍
- 介绍
- 介绍
- 发明
- 发明
- 发明者
- 投资
- 投资
- 诱人的
- 调用
- IP
- 讽刺地
- 问题
- 问题
- IT
- 它的
- 司法
- 保持
- 知道
- 法律
- 离开
- 立法
- Level
- 执照
- 许可证
- 执照
- 喜欢
- 极限
- LOOKS
- 降低
- 制成
- 使
- 方式
- 制成的
- 许多
- 三月
- 标记
- 市场
- 最大宽度
- 可能..
- 衡量
- 措施
- 满足
- 提到
- 方法
- 介意
- 钱
- 更多
- 最先进的
- 移动
- 许多
- National
- 需求
- 需要
- 决不要
- 全新
- 美国国立卫生研究院
- NIST
- 非营利组织
- 特别是
- 没什么
- 小说
- 现在
- 目标
- 目标
- 债券
- of
- 办公
- on
- 那些
- 仅由
- 打开
- 反对
- 附加选项
- or
- 其他名称
- 其它
- 输出
- 超过
- 最划算
- 己
- 所有权
- 流感大流行
- 各方
- 党
- 专利
- 专利
- 为
- 也许
- 制药
- 制药
- 柏拉图
- 柏拉图数据智能
- 柏拉图数据
- 点
- 政策
- 位置
- 职位
- 或者
- 帖子
- 帖子
- 潜力
- 功率
- 在练习上
- 存在
- 当下
- 压力
- 以前
- 车资
- 价格
- 价格
- 小学
- 先
- 私立
- 过程
- 产品
- 核心产品
- 进步
- 促进
- 财产
- 财产权
- 建议
- 保护
- 提供
- 提供
- 国家
- 出版物
- 目的
- 推动
- 放
- 题
- 有疑问吗?
- 相当
- 研发
- 凸
- 达到
- 读者
- 真实的世界
- 合理
- 原因
- 最近
- 食谱
- 灾难的秘诀
- 确认
- 拒绝
- 发布
- 遗迹
- 要求
- 需求
- 岗位要求
- 需要
- 研究
- 研究和开发
- 回应
- 导致
- 回报
- 检讨
- 右
- 权利
- 健壮
- RTI
- s
- 实现安全
- 说
- 同
- 审查
- 其次
- 秘书
- 部分
- 扇形
- 行业
- 看到
- 寻找
- 寻求
- 似乎
- 看到
- 分开
- 九月
- 认真地
- 特色服务
- 集
- 转移
- 应该
- 显著
- 类似
- 同样
- 只是
- 自
- 单
- 小
- So
- 一些
- 东西
- 说话
- 精神
- 股权
- 姿态
- 标准
- 州/领地
- 步
- 步骤
- 停止
- 强化
- 强烈
- 学生
- 学习
- 主题
- 成功
- 这样
- SUPPORT
- 周围
- 系统
- 采取
- 拍摄
- 瞄准
- 纳税人
- 专业技术
- 这
- 国家
- 其
- 那里。
- 博曼
- 他们
- 事
- 第三
- 第三者
- Free Introduction
- 那些
- 虽然?
- 三步
- 通过
- 从而
- 次
- 至
- 一起
- 工具
- 向
- 贸易
- 翻译
- 治疗
- 趋势
- 试用
- 尝试
- 转
- 双重
- 我们
- 不明
- 下
- 大学合作伙伴
- 大学
- 不像
- 直到
- 上
- us
- 美国政府
- 用法
- 使用
- 运用
- 动用
- 各个
- 版本
- 非常
- 是
- we
- 衡
- 什么是
- 什么是
- ,尤其是
- 是否
- 这
- 而
- WHO
- 将
- 也完全不需要
- 价值
- 将
- 年
- 但
- 和风网