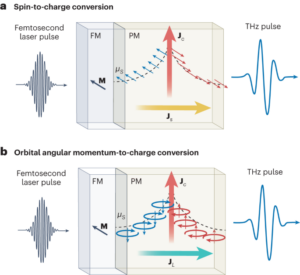
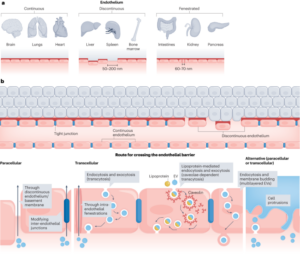
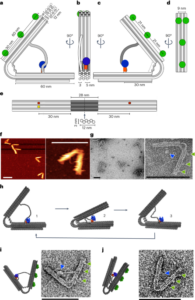
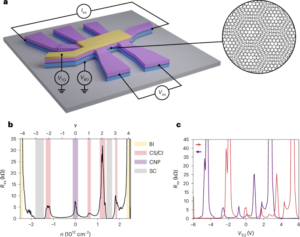
تمام ریجنٹس موصول ہونے کے طور پر استعمال کیے گئے تھے جب تک کہ دوسری صورت میں بیان نہ کیا جائے۔ تمام کیمیکل سگما ایلڈرچ سے خریدے گئے تھے سوائے گنتی کے موتیوں کے (کاؤنٹ برائٹ مطلق گنتی موتیوں، انویٹروجن) کے۔ ζZetasizer NanoZS90 (Malvern Instruments) کا استعمال کرتے ہوئے پوٹینشل کی پیمائش کی گئی۔ بنیادی تجزیہ فراہم کرنے کے لیے انٹیگریٹڈ EDS کے ساتھ JEOL JSM 7800F پرائم مائکروسکوپ میں SEM کے ذریعے ذرات کے سائز اور شکل کا مطالعہ کیا گیا۔ ذرہ کا سائز 50 آزاد ذرات کی پیمائش کرکے طے کیا گیا تھا۔ ریڈیو انسٹنٹ تھن لیئر کرومیٹوگرافی (ITLC) کو Agilent Technologies کے گلاس مائیکرو فائبر کرومیٹوگرافی پیپر پر تیار کیا گیا تھا جس میں سلیکک ایسڈ کا رنگ لگایا گیا تھا اور اس کا تجزیہ لیبلوجک فلو کاؤنٹ TLC سکینر اور BioScan B-FC-3200 فوٹو ملٹی پلیئر ٹیوب (PMT سافٹ ویئر ڈیٹیکٹر) کا استعمال کرتے ہوئے کیا گیا تھا۔ ITLC موبائل مرحلہ پانی میں 0.175 M سائٹرک ایسڈ اور 0.325 M ٹرائیسوڈیم سائٹریٹ پر مشتمل تھا جب تک کہ دوسری صورت میں بیان نہ کیا جائے۔ تابکار نمونوں کی پیمائش Capintec CRC-25R (Capintec) یا LKB Wallac 1282 Compugamma CS (PerkinElmer) کے ذریعے کی گئی جس کے لیے EdenTerm سافٹ ویئر کا استعمال کرتے ہوئے ڈیٹا اکٹھا کیا گیا۔ BD FACSChorus سافٹ ویئر کا استعمال کرتے ہوئے BD FACSMelody سیل سارٹر میں فلو سائٹومیٹری تجربات کیے گئے تھے۔ PET/CT امیجز کو NanoPET/CT سکینر (Mediso) کا استعمال کرتے ہوئے حاصل کیا گیا، Nucline v.0.21 سافٹ ویئر کا استعمال کرتے ہوئے دوبارہ تشکیل دیا گیا، اور VivoQuant سافٹ ویئر (ورژن 3.5، InviCRO) کا استعمال کرتے ہوئے تصاویر کا تجزیہ کیا گیا۔ لسٹ موڈ ڈیٹا میڈیسو کے تیار کردہ ایک مخصوص MATLAB سافٹ ویئر ٹول کے ذریعے حاصل کیا گیا تھا۔ آٹوراڈیوگرافی جی ای ایمرشام ٹائفون آلے میں کی گئی۔
ذیلی مائیکرو میٹر سائز سلیکا ذرات کی ترکیب
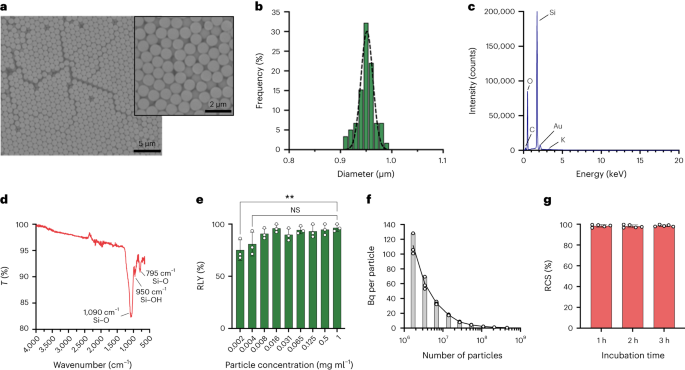
ذرات کو Stöber طریقہ استعمال کرتے ہوئے ترکیب کیا گیا تھا۔ یہ طریقہ مونوڈسپرس، کروی سلکا کے ذرات پیدا کرنے کے لیے سلکان الکوکسائیڈز کے ہائیڈولیسس اور لگاتار گاڑھا ہونے پر مبنی ہے۔27. Tetraethyl orthosilicate (TEOS) کو سلکان ماخذ کے طور پر، امونیا کو بیس کیٹالسٹ کے طور پر اور پوٹاشیم کلورائیڈ کو الیکٹرولائٹ کے طور پر استعمال کیا گیا۔ ایتھنول میں TEOS کا ایک محلول مسلسل ایک محلول میں شامل کیا گیا جس میں کیٹالسٹ اور الیکٹرولائٹ شامل تھے۔ ری ایجنٹ کی ابتدائی مقدار یا اضافے کی شرح میں ترمیم ذرہ کے سائز میں فرق فراہم کرتی ہے جیسا کہ پہلے بتایا گیا تھا۔28. یہاں، ذرات کی ترکیب سے پہلے دو حل تیار کیے گئے تھے: حل 1 جس میں 19.0 ملی لیٹر EtOH میں 33.3 mmol TEOS پر مشتمل ہے اور حل 2 جس میں 0.23 ملی لیٹر امونیا میں 9 mmol KCl، 65 ملی لیٹر EtOH اور 6.75 ملی لیٹر H۔2O. ترکیب کے لیے، حل 2 کو 250 ملی لیٹر کے گول نیچے فلاسک میں رکھا گیا تھا جسے 50 ° C پر 300 rpm پر 15 منٹ تک ہلایا جاتا تھا۔ پھر، حل 1 کو حل 2 میں ڈراپ وائز شامل کیا گیا (سپلائی کی شرح 0.2 ملی لیٹر منٹ1-)۔ حل 1 کے اضافے کے بعد، حاصل کردہ ذرات کو سینٹرفیوگریشن کے ذریعے 18,300 پر صاف کیا گیا۔g 3 منٹ کے لیے اور EtOH سے پانچ بار دھوئے۔ آخر میں، SiO2 مائکرو پارٹیکلز کو ویکیوم کے نیچے خشک کیا گیا تھا۔
سائلین – پی ای جی کے ساتھ ذیلی مائکرو میٹر سائز کے ذرات کی گرافٹنگ5k
ایک 20 ملی گرام ملی لیٹر1- سائلین – پی ای جی کا حل5k (Sigma Aldrich) EtOH میں 98% smSiP کے حل پر 5 ملی گرام ملی لیٹر پر شامل کیا گیا تھا۔1- EtOH میں 98% اور 2.8% امونیا۔ اس مرکب کو کمرے کے درجہ حرارت پر رات بھر ہلایا گیا، اور ذرات کو سینٹرفیوگریشن کے ذریعے 18,300 پر بازیافت کیا گیا۔g 3 منٹ کے لیے آخر میں، ذرات کو آست پانی سے تین بار دھویا گیا اور رات بھر ویکیوم کے نیچے خشک کر دیا گیا۔ دھونے کے محلولوں کو راتوں رات منجمد کر کے خشک کر دیا گیا اور غیر منسلک سائلین کی مقدار – پی ای جی5k رد عمل کی پیداوار کے حساب کتاب کے لیے وزنی ہے۔ ایک 0.05 ملی گرام ملی لیٹر1- smSiP – PEG کا حل5k آست پانی میں مزید ریڈیو لیبلنگ رد عمل کے لیے استعمال کیا گیا تھا۔
[68Ga] GaCl3
Gallium-68 کو بطور ایلوٹ کیا گیا تھا۔68Ga] GaCl3 ایکرٹ اور زیگلر سے 68جی جے /68الٹرا پیور ایچ سی ایل (4 ملی لیٹر، 0.1 ایم) میں گا جنریٹر اچھی مینوفیکچرنگ پریکٹس کی ضروریات (ABX) کے مطابق تیار کیا گیا ہے۔
کا ارتکاز [68Ga] GaCl3 کیشن ایکسچینج کی طرف سے elution
ضمیمہ انجیر میں بیان کردہ سیٹ اپ کا استعمال کرتے ہوئے اخراج کا ارتکاز کیا گیا تھا۔ 1. سب سے پہلے، 4 ملی لیٹر [68Ga] GaCl3 elution کو Strata-XC 33u کارتوس (Phenomenex) پر لوڈ کیا گیا تھا اور eluate کو ضائع کر دیا گیا تھا۔ اس کے بعد، کارتوس کو 5 ملی لیٹر ایسٹون/0.1 ایم ایچ سی ایل (80:20) محلول سے دھویا گیا اور ایلویٹ کو ضائع کر دیا گیا۔ آخر میں، مرکوز [68Ga] GaCl3 700 µl ایک ایسیٹون/0.05 M HCl (98:2) محلول شامل کرکے جمع کیا گیا تھا، جسے N کے نیچے خشک کیا گیا تھا۔2 50 M HEPES بفر، (pH 0.5) کے 4.9 μl میں سٹریم اور دوبارہ معطل کر دیا گیا۔ کوالٹی کنٹرول کے لیے ریڈیو-TLC کو مختلف مراحل پر انجام دیا گیا۔ پروٹوکول میں تقریباً 20 منٹ لگتے ہیں جو 86.2 ± 8.5% کی بحالی کی پیداوار فراہم کرتا ہے۔
کے ساتھ مختلف ارتکاز پر سلکا کے ذرات کی ریڈیو لیبلنگ 68Ga
سلکا کے ذرات کو مختلف ارتکاز پر دوبارہ معطل کیا گیا تھا (1 سے 0.002 ملی گرام ملی لیٹر تک1-) 0.5 M HEPES بفر میں (pH 4.9)۔ اس کے بعد، 50 µl محلول کو ایک رد عمل ٹیوب میں شامل کرنے سے پہلے شامل کیا گیا تھا۔68Ga] GaCl3 50 M HEPES بفر (pH 0.5) کے 4.9 µl میں اخراج۔ رد عمل 90 ° C پر 30 منٹ تک کیے گئے، اور ریڈیو کیمیکل پیداوار کا حساب لگانے کے لیے ریڈیو-TLC کیا گیا۔
بہاؤ سائٹومیٹری کے ذریعہ ذرہ کی حراستی کی پیمائش
کارخانہ دار کی ہدایات پر عمل کرتے ہوئے گنتی موتیوں (CountBright Absolute Counting Beads، Invitrogen) کا استعمال کرتے ہوئے بہاؤ cytometry کے ذریعے ذرات کے ارتکاز کا حساب لگایا گیا۔ سلکا کے ذرات کو 0.05 ملی گرام ملی لیٹر پر دوبارہ معطل کیا گیا۔1-، 10 منٹ کے لئے سونیکیٹ کیا گیا اور 10 µm کٹ آف سائز فلٹر (KX سرنج فلٹر، نایلان، 25 ملی میٹر، 10 µm) سے گزرا۔ CountBright Absolute Counting Beads کو کمرے کے درجہ حرارت پر گرم کیا گیا اور 30 سیکنڈ تک گھمایا گیا۔ اس کے بعد، 50 µl سلیکا کے ذرات میں 300 µl موتیوں کی مالا شامل کی گئیں اور یکساں محلول حاصل کرنے کے لیے مرکب کو 30 منٹ تک گھمایا گیا۔ نمونہ فلو سائٹو میٹر پر چلایا گیا تھا اور فارورڈ سکیٹر (FSC) کی حد مقرر کی گئی تھی جس میں لکیری-FSC بمقابلہ لکیری-ایف ایس سی پر موتیوں اور ذرات کو شامل کیا گیا تھا۔ اس کے بعد، گنتی کے موتیوں کے لیے فلوروسینس ڈیٹیکٹر وولٹیج کو ایڈجسٹ کیا گیا اور سلیکا کے ذرات اور گنتی موتیوں کی آبادی کو الگ کرنے کے لیے گیٹنگ کی حکمت عملی کی گئی۔ آخر میں، ذرات اور مطلق گنتی کے موتیوں پر دروازے بنائے گئے اور ہر نمونے کے لیے 1,000 موتیوں کے واقعات ریکارڈ کیے گئے۔ اس حکمت عملی کا استعمال کرتے ہوئے، حل میں ذرات کی تعداد درج ذیل مساوات کا استعمال کرتے ہوئے شمار کی گئی:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ ذرّات}}،{mathrm{count}},times,{mathrm{counting}},{mathrm{beads}},{mathrm{volume}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{particles}},{mathrm{volume}})} اوقات,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}left(frac {{mathrm{Beads}}}{{{upmu l}}}دائیں) اختتام{array}$$
500 smSiP کی ریڈیو لیبلنگ
پانچ سو ایس ایم ایس آئی پی کو 50 μl میں شامل کیا گیا68Ga] GaCl3 0.5 M HEPES بفر pH 4.9 میں اخراج۔ اس کے بعد، پولیسوربیٹ 5.6 کا 80 µl شامل کیا گیا اور مرکب کو تھرمل مکسر میں 90 rpm پر 30 منٹ کے لیے 900 ° C پر گرم کیا گیا۔ اس کے بعد، ایک حتمی ملٹی سٹیپ پیوریفیکیشن پروٹوکول کو غیر رد عمل/کولائیڈل کو دور کرنے کے لیے ڈیزائن کیا گیا تھا۔ 68Ga. 10 mM EDTA کے پچاس مائیکرو لٹر شامل کیے گئے، اور مرکب کو کمرے کے درجہ حرارت پر 5 منٹ تک انکیوبیٹ کیا گیا۔ پھر، ذرات کو 3،18,300 پر XNUMX منٹ کے لیے سینٹرفیوج کیا گیا۔g500 mM EDTA + 1% polysorbate 0.1 پر مشتمل PBS کے 80 µl میں دوبارہ معطل کیا گیا اور 10 سیکنڈ کے لیے آہستہ سے گھمایا گیا۔ ذرات کو دوبارہ سینٹرفیوج کیا گیا، PBS میں 0.1 mM EDTA + 0.1% polysorbate 80 کے محلول سے دھویا گیا اور آہستہ سے 10 s تک گھمایا گیا۔ آخر میں، ذرات کو سینٹرفیوج کیا گیا اور PBS + 0.1% polysorbate 80 کے ساتھ مزید پانچ بار دھویا گیا اور 500 μl PBS میں دوبارہ معطل کر دیا گیا۔ ریڈیو لیبلنگ ری ایکشن کی نگرانی ریڈیو-TLC کے ذریعے مسلسل رد عمل کے اقدامات کے دوران کی گئی تاکہ کولائیڈز کی موجودگی کا اندازہ کیا جا سکے (جو صحیح طریقے سے نہ ہٹائے جانے پر ذرات کے ساتھ الجھن میں پڑ سکتے ہیں)، ذرات کی ریڈیو لیبلنگ اور حتمی مصنوع کی پاکیزگی۔ دھونے کے مراحل کے بعد ذرات میں تابکاری کی مقدار اور سپرنٹنٹس کے درمیان موازنہ کرکے RLY کا حساب لگایا گیا۔
فریکشن
فریکشن کی حکمت عملی کے لیے، حجم 0.5 µl سے 20 µl تک 681 ذرہ µl کی نظریاتی حراستی پر Ga-smSiP1- 1 µl مراحل (0.5, 1, 2, 3…) میں مختلف نمونے والی ٹیوبوں میں شامل کیے گئے اور حتمی حجم کو 50 µl تک لانے کے لیے PBS کو شامل کیا گیا۔ پھر، پہلی ٹیوب سے 37.5 µl دوسری سیمپل ٹیوب میں، دوسری ٹیوب کے 25 µl کو تیسری ٹیوب میں اور آخر میں تیسری ٹیوب کے 12.5 µl کو چوتھی ٹیوب میں ڈالا گیا۔ یہ حکمت عملی 12.5 μl فی ٹیوب کے حتمی حجم کے ساتھ فی نمونہ چار ٹیوبیں فراہم کرتی ہے۔ ہر ٹیوب میں ریڈیو ایکٹیویٹی کو گاما کاؤنٹر میں ماپا گیا تھا اور مزید موازنہ اور تجزیہ کے لیے کیلیبریشن کریو کا استعمال کرتے ہوئے قدروں کو kBq میں شمار کیا گیا تھا۔ صرف ایک ٹیوب میں زیادہ تر ریڈیو ایکٹیویٹی پر مشتمل نمونے کمرے کے درجہ حرارت پر 30 سیکنڈ کے لیے سونیکیٹ کیے گئے تھے اور دوسرے فریکشن کے مرحلے کا نشانہ بنے تھے۔ پھر، وہ نمونے جن میں تمام ریڈیو ایکٹیویٹی ایک ہی ٹیوب میں پائی گئی تھی (دیگر تین ٹیوبوں میں نہ ہونے کے برابر سرگرمی کے ساتھ) ویوو/سابق ویوو تجربات میں مزید استعمال کیے گئے تھے۔
PET/CT فینٹم امیجنگ
ایک کے ساتھ ایک پریت امیجنگ تجربہ کیا گیا تھا۔ 68Ga-smSiP۔ ایک کینولا کا استعمال ذرہ کو نمونے کی ٹیوب میں پہنچانے کے لیے کیا گیا تھا تاکہ اس بات کا اندازہ کیا جا سکے کہ آیا انتظامیہ کے دوران ایک بھی ذرہ کینول ٹیوب میں پھنسا رہ سکتا ہے۔ مختصراً، فینٹم ٹیوب کو نینو پی ای ٹی/سی ٹی سکینر میں ٹیوب کے ساتھ منسلک کینولا ٹپ کے آخر میں رکھا گیا تھا۔ PET کا حصول شروع کرنے کے بعد، PBS کے 100 µl میں دوبارہ معطل شدہ ذرہ کینولا کے شروع میں منسلک انسولین سرنج کے ساتھ پہنچایا گیا۔ اس کے بعد، کینول کو 50 μl PBS کے ساتھ دھویا گیا تاکہ پریت ٹیوب میں ذرہ کی ترسیل کو یقینی بنایا جا سکے۔ پی ای ٹی کا حصول 2 گھنٹے کے لیے کیا گیا جس کے بعد معیاری سی ٹی اسکین کیا گیا۔
Vivo PET/CT امیجنگ میں
اینیمل امیجنگ اسٹڈیز کا اخلاقی طور پر جائزہ لیا گیا اور جانوروں (سائنسی طریقہ کار) ایکٹ 1986 (ASPA) یو کے ہوم آفس کے قواعد و ضوابط کے مطابق کیا گیا جو جانوروں کے تجربات کو کنٹرول کرتا ہے۔ Vivo میں امیجنگ 8 ہفتے پرانے BALB/c چوہوں میں کی گئی۔ جانوروں کو isoflurane (2–3% آکسیجن) کے ساتھ بے ہوشی کی گئی، کینول کیا گیا اور اسکینر بیڈ پر اینستھیزیا کے تحت رکھا گیا۔ بستر کو اندرونی ہوا کے بہاؤ کے ذریعے 37 ° C تک گرم کیا گیا تاکہ جانور کو جسم کے عام درجہ حرارت پر رکھا جا سکے، اور سانس لینے کی شرح کو 60-80 سانس منٹ پر مانیٹر کیا گیا اور اسے برقرار رکھا گیا۔1- پورے اسکین میں۔ جانوروں کے درجہ حرارت پر کنٹرول برقرار رکھنا ضروری ہے، کیونکہ درجہ حرارت میں غیر متوقع کمی خون میں ذرہ کی رفتار میں کمی کا باعث بن سکتی ہے۔ ایک 68Ga-smSiP (n = 4) یا 68Ga-smSiP–PEG5k ذرہ (n = 2) پی بی ایس کے 100 μl میں کینول کے ذریعے چلایا گیا تھا، اس کے بعد پی ای ٹی کے حصول کو شروع کرنے کے بعد 50 μl پی بی ایس کے ساتھ دھویا گیا تھا (1:5 اتفاقی موڈ؛ 5 این ایس اتفاق ٹائم ونڈو)۔ پی ای ٹی کو 2 گھنٹے کے لیے ریکارڈ کیا گیا، اور پھر ایک نیم سرکلر سی ٹی اسکین کیا گیا۔ پورے عمل کے دوران جانوروں کے جسم کے درجہ حرارت اور سانس کی شرح کی نگرانی کی گئی۔ متحرک PET/CT امیجز کو Tera-Tomo 3D تعمیر نو (400–600 keV انرجی ونڈو، 1:5 اتفاق موڈ، 20 تکرار اور 1 سب سیٹ) کا استعمال کرتے ہوئے 0.4 × 0.4 × 0.4 ملی میٹر کے ووکسیل سائز پر دوبارہ تعمیر کیا گیا تھا۔3 اور کشندگی، بکھرنے اور کشی کے لیے درست کیا گیا۔ تمام PET/PEPT حصول کے لیے لسٹ موڈ ڈیٹا تلاش کیا جا سکتا ہے۔ 68Ref پر Ga-smSiP۔ 29 اور کے لئے 68Ga-smSiP–PEG5k ریفری میں 30.
ریئل ٹائم ٹریکنگ
سب سے پہلے، سکینر سے لسٹ موڈ فارمیٹ میں ڈیٹا ایکسپورٹ کیا گیا تھا (یعنی ٹائم اسٹیمپ اور کرسٹل انڈیکس کے ساتھ ایک فارمیٹ کا پتہ چلنے والے اتفاقی فوٹونز کے لیے)۔ کرسٹل انڈیکس سے ملی میٹر یونٹس میں پوزیشن میں تبدیل کرنے کے لیے ایک ہندسی تبدیلی کا اطلاق کیا گیا تھا۔ برمنگھم کا طریقہ تمام LoRs کے ذیلی سیٹ سے MDP کا حساب لگاتا ہے۔ یہ ایسا LoRs کو مسترد کر کے کرتا ہے جو MDP سے ایک مقررہ فاصلے سے زیادہ ہیں کیونکہ یہ ممکنہ طور پر جھوٹے LoRs سے پیدا ہوتے ہیں، مثال کے طور پر، LoRs جو بکھرنے سے پیدا ہو سکتے ہیں۔ MDP ہر تکرار کے ساتھ بہتر ہوتا ہے۔ تکرار کی تعداد مؤثر طریقے سے مقرر کی جاتی ہے۔ f-فیکٹر اور LoRs کی کل تعداد سے متعلق ہے جو اس ذیلی سیٹ کے اندر ذرہ کی آخری پوزیشن کا اندازہ لگانے کے لیے استعمال ہوتے ہیں (مثال کے طور پر، ایک f0.5 کے فیکٹر کا مطلب ہے کہ جب سب سیٹ میں 50% LoRs باقی رہیں گے تو تکرار لوپ ختم ہو جائے گا)۔ سب سیٹ میں استعمال ہونے والے LoRs کی تعداد کو وقتی نمونوں کو بہتر بنانے کے لیے کم کیا جا سکتا ہے (سب سیٹ بغیر کسی اوورلیپ کے لگاتار ہوتے ہیں) پوزیشن میں غیر یقینی صورتحال کو بڑھانے کی قیمت پر (الگورتھم کی مزید تفصیلات پارکر ایٹ ال میں مل سکتی ہیں۔5) برمنگھم کا طریقہ پی ای ٹی سکینر سے لسٹ موڈ ڈیٹا کا تجزیہ کرنے کے لیے استعمال کیا گیا تھا۔ چوہوں میں ذرہ کو ٹریک کرنے کے لئے ایک انکولی نمونہ کا سائز استعمال کیا گیا تھا۔ نمونے کا سائز پوزیشننگ کی غلطیوں کو کم کرتے ہوئے کافی وقتی نمونے لینے کے توازن کو حاصل کرنے کے لیے مقرر کیا گیا تھا۔ 100 اور 200 LoRs کے درمیان ایک نمونہ سائز سکین کے ابتدائی مراحل میں استعمال کیا گیا تھا (اسکین شروع ہونے سے 60 سیکنڈ) f = 0.1، تقریباً 1–5 سیکنڈ کے وقفوں کی پیداوار۔ اسکیننگ کے اوقات> 60 s میں، نمونے کے سائز 1,000 اور 2,000 کے درمیان مختلف تھے، جس میں Vivo تجربے کے لحاظ سے 30 s اور 60 s کے درمیان وقت کا وقفہ ملتا ہے۔ ایم ڈی پی کا حساب لگانے کے لیے استعمال ہونے والی گنتی کی تعداد (آخری تکرار میں) نمونے کے سائز کو f- عنصر کی قدر یہ پیرامیٹرز سابقہ تجربے پر مبنی تھے اور پچھلی اشاعتوں کے ذریعے مطلع کیے گئے تھے۔1.
کے طور پر رفتار حاصل کی گئی تھی (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) کہاں ({v}_{m}^{2}) میں رفتار ہے x, y اور z سمتوں.
ایکس ویوو آرگن اپٹیک
گاما گنتی کے ذریعے مختلف اعضاء میں جذب کا اندازہ لگایا گیا۔ ان ویوو پی ای ٹی/سی ٹی امیجنگ کے بعد، جانوروں کو سروائیکل ڈس لوکیشن کی وجہ سے ہلاک کیا گیا اور گاما کاؤنٹر (LKB Wallac 1282 Compugamma CS) میں ریڈیو ایکٹیویٹی گنتی کے لیے اعضاء کو نکالا اور وزن کیا گیا۔ اعداد و شمار کو فی گرام ٹشو (%ID g1-).
آٹوراڈیوگرافی
پھیپھڑوں میں تابکاری کا پتہ لگانے والے تابکاری کا پتہ لگانے والے (EP15 پروب، مورگن) کے ذریعے کیا گیا، اور پھیپھڑوں کو اسکالپل کے ساتھ چھوٹے حصوں میں کاٹ دیا گیا جب تک کہ تابکار سگنل کے ساتھ ٹشو کا ایک چھوٹا سا حصہ حاصل نہ ہو جائے۔ ٹشو کو −80 ° C isopropanol میں منجمد کر دیا گیا تھا۔ منجمد ہونے کے فوراً بعد، ٹشو کو بہترین کٹنگ ٹمپریچر میڈیم میں سرایت کر دیا گیا اور 20 µm سلائسس میں کریوسٹیٹ میں کاٹا گیا۔ تابکار ٹکڑا ملنے تک ہر ٹکڑے کا ڈیٹیکٹر کے ساتھ سروے کیا گیا۔ پچھلا (نیچے پس منظر)، تابکار اور اگلا (پس منظر کے نیچے) سلائس سپر فراسٹ مائکروسکوپ سلائیڈ (ایپریڈیا) پر رکھا گیا تھا۔ باقی باقی ٹشو بھی پس منظر کے نیچے تھے۔ تین حصوں کے ساتھ مائکروسکوپ سلائیڈ کلنگ فلم سے ڈھکی ہوئی تھی اور راتوں رات جی ای آٹوراڈیوگرافی پلیٹ کے مخالف تھی۔ پلیٹ کا تجزیہ GE Amersham Typhoon کے ساتھ 25 µm ریزولوشن اور PMT سیٹنگ 4,000 کے ساتھ کیا گیا۔ آٹوراڈیوگرافی امیج کو ٹشو کی تصویر پر سپرد کیا گیا تھا، جس میں تابکار سلائس میں تابکاری کا ایک مقام دکھایا گیا تھا۔ مقدار کے تعین کے لیے، مختلف معلوم سرگرمیوں میں معیارات تیار کیے گئے تھے، اور ہر ایک کو کاغذ میں 1 µl پنکھ کے طور پر دیکھا گیا تھا۔ دھبوں کو اسی سٹوریج فاسفر اسکرین میں انکیوبیٹ کیا گیا تھا، GE سے BAS-IP MS (ملٹی پرپز اسٹینڈرڈ) جیسا کہ واحد ذرات کی مقدار درست ہے۔ تصویر Amersham Typhoon 5 کے ساتھ کنٹرول سافٹ ویئر ورژن 2.0 کے ساتھ فاسفر موڈ میں 100 µm کے پکسل سائز اور 4,000 کی حساسیت کے ساتھ حاصل کی گئی تھی۔ تصاویر کو سافٹ ویئر ImageQantTL v10.0-261 کے ساتھ جیل کوانٹیفیکیشن ٹول باکس کا استعمال کرتے ہوئے مقدار درست کیا گیا۔ دھبوں کو مستقل پس منظر کے طور پر اسپاٹ سے فوراً پہلے یا بعد کے علاقے کا انتخاب کرکے درست کیا گیا۔ اسپاٹ کے نتیجے کے حجم کو انشانکن وکر کی بنیاد پر ذرہ میں Bq کا حساب لگانے کے لیے استعمال کیا گیا تھا۔
شماریات اور تولیدی صلاحیت
مقداری تجزیے کے لیے، کم از کم تین حیاتیاتی نقلوں کا تجزیہ کیا گیا، اس کے ان ویوو ڈیٹا کو چھوڑ کر 68Ga-smSiP–PEG5k (n = 2)۔ ڈیٹا کا تجزیہ ڈنیٹ کے ایک سے زیادہ موازنہ ٹیسٹ اور طالب علم کے ویریئنس (ANOVA) کے عام یک طرفہ تجزیہ کے ذریعے کیا گیا۔ t-پرکھ. اے P قدر <0.05 کو شماریاتی لحاظ سے اہم سمجھا جاتا تھا۔
- SEO سے چلنے والا مواد اور PR کی تقسیم۔ آج ہی بڑھا دیں۔
- پلیٹو ڈیٹا ڈاٹ نیٹ ورک ورٹیکل جنریٹو اے آئی۔ اپنے آپ کو بااختیار بنائیں۔ یہاں تک رسائی حاصل کریں۔
- پلیٹوآئ اسٹریم۔ ویب 3 انٹیلی جنس۔ علم میں اضافہ۔ یہاں تک رسائی حاصل کریں۔
- پلیٹو ای ایس جی۔ کاربن، کلین ٹیک، توانائی ، ماحولیات، شمسی، ویسٹ مینجمنٹ یہاں تک رسائی حاصل کریں۔
- پلیٹو ہیلتھ۔ بائیوٹیک اینڈ کلینیکل ٹرائلز انٹیلی جنس۔ یہاں تک رسائی حاصل کریں۔
- ماخذ: https://www.nature.com/articles/s41565-023-01589-8
- : ہے
- : نہیں
- :کہاں
- ][p
- 000
- 1
- 10
- 100
- 12
- 15٪
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- مطلق
- مطابق
- حاصل
- حاصل
- حصول
- حصول
- ایکٹ
- سرگرمیوں
- سرگرمی
- انکولی
- شامل کیا
- انہوں نے مزید کہا
- اس کے علاوہ
- ایڈجسٹ
- انتظامیہ
- انتظامیہ
- ترقی
- کے بعد
- بعد
- پھر
- AIR
- AL
- یلگورتم
- تمام
- بھی
- امونیا
- رقم
- an
- تجزیہ
- تجزیہ
- لنگر
- اور
- جانور
- جانوروں
- اطلاقی
- تقریبا
- کیا
- اٹھتا
- AS
- At
- b
- پس منظر
- متوازن
- بیس
- کی بنیاد پر
- بنیاد
- BD
- BE
- اس سے پہلے
- شروع
- نیچے
- کے درمیان
- برمنگھم
- خون
- جسم
- مختصر
- لانے
- بفر
- by
- حساب
- حساب
- حساب کرتا ہے
- حساب سے
- کر سکتے ہیں
- کیا ہوا
- عمل انگیز
- سیل
- کیمیکل
- منتخب کریں
- کلک کریں
- اتفاق
- موازنہ
- موازنہ
- پر مشتمل
- مرکوز
- دھیان
- منعقد
- الجھن میں
- مسلسل
- سمجھا
- مسلسل
- مسلسل
- کنٹرول
- کنٹرول
- تبدیل
- درست کیا
- قیمت
- سکتا ہے
- مقابلہ
- گنتی
- احاطہ کرتا ہے
- کرسٹل
- cs
- وکر
- کٹ
- کاٹنے
- اعداد و شمار
- نجات
- ڈیلیور
- ترسیل
- منحصر ہے
- بیان کیا
- ڈیزائن
- تفصیلات
- پتہ چلا
- کا تعین
- ترقی یافتہ
- اختلافات
- مختلف
- ہدایات
- سندچیوتی
- فاصلے
- کرتا
- خوراک
- مواقع
- چھوڑ
- کے دوران
- متحرک
- e
- ای اینڈ ٹی
- ہر ایک
- ابتدائی
- مؤثر طریقے
- الیکٹرولائٹ
- ایمبیڈڈ
- اخراج
- ملازم
- آخر
- توانائی
- انجنیئرنگ
- کو یقینی بنانے کے
- کا سامان
- نقائص
- تخمینہ
- Ether (ETH)
- اندازہ
- اندازہ
- واقعات
- مثال کے طور پر
- اس کے علاوہ
- چھوڑ کر
- تجربہ
- تجربہ
- تجربات
- اظہار
- جھوٹی
- انجیر
- فلم
- فلٹر
- فائنل
- آخر
- پہلا
- پانچ
- بہاؤ
- پیچھے پیچھے
- کے بعد
- کے لئے
- فارمیٹ
- آگے
- ملا
- چار
- چوتھے نمبر پر
- برفیلی
- سے
- منجمد
- ایف ایس سی
- مزید
- گیٹس
- ge
- جنریٹر
- گلاس
- اچھا
- گورننگ
- گرام
- ترقی
- صحت مند
- یہاں
- ہوم پیج (-)
- وزارت داخلہ
- HTTPS
- if
- تصویر
- تصاویر
- امیجنگ
- فوری طور پر
- اہم
- کو بہتر بنانے کے
- in
- شامل
- اضافہ
- انکیوبیٹڈ
- آزاد
- انڈکس
- Indices
- مطلع
- فوری
- ہدایات
- آلہ
- آلات
- ضم
- انٹرفیس
- اندرونی
- میں
- IT
- تکرار
- تکرار
- رکھیں
- جانا جاتا ہے
- Kx
- قیادت
- امکان
- LINK
- پھیپھڑوں
- برقرار رکھنے
- تیار
- مینوفیکچرنگ
- مواد
- مئی..
- کا مطلب ہے کہ
- ماپا
- پیمائش
- درمیانہ
- طریقہ
- طریقوں
- چوہوں
- مائکرون
- خوردبین
- منٹ
- کم سے کم
- کم سے کم
- مکسر
- مرکب
- ML
- موبائل
- موڈ
- نگرانی کی
- زیادہ
- مورگن
- سب سے زیادہ
- MS
- ایک سے زیادہ
- ضرب لگانا
- نےنو
- فطرت، قدرت
- اگلے
- نہیں
- عام
- تعداد
- حاصل
- حاصل کی
- of
- دفتر
- on
- ایک
- صرف
- مخالفت کی
- زیادہ سے زیادہ
- or
- عام
- دیگر
- دوسری صورت میں
- باہر
- پر
- رات بھر
- آکسیجن
- کاغذ.
- پیرامیٹرز
- ذرہ
- منظور
- PBS
- فی
- فیصد
- کارکردگی
- پالتو جانوروں کی
- پریت
- مرحلہ
- فوٹون
- تصویر
- دانہ
- رکھ دیا
- پلاٹا
- افلاطون ڈیٹا انٹیلی جنس
- پلیٹو ڈیٹا
- آبادی
- حصہ
- پوزیشن
- پوزیشننگ
- positron
- پریکٹس
- تیار
- کی موجودگی
- پچھلا
- پہلے
- وزیر اعظم
- پہلے
- تحقیقات
- طریقہ کار
- عمل
- پیدا
- مصنوعات
- مناسب طریقے سے
- پروٹوکول
- فراہم
- فراہم کرتا ہے
- فراہم کرنے
- خریدا
- معیار
- مقدار کا تعین
- مقدار کی
- مقدار
- R
- تابکاری
- ریڈیو
- رینج
- شرح
- رد عمل
- رد عمل
- اصل وقت
- موصول
- حال ہی میں
- درج
- وصولی
- کم
- کمی
- حوالہ
- بہتر
- خطے
- ضابطے
- سے متعلق
- رہے
- باقی
- ہٹا
- ہٹا دیا گیا
- نقل
- ضروریات
- قرارداد
- باقی
- نتیجے
- کا جائزہ لینے کے
- -جائزہ لیا
- کمرہ
- رن
- s
- اسی
- اسکین
- سکیننگ
- اسکین کرتا ہے
- ایس سی آئی
- سائنسی
- سکرین
- دوسری
- سیکنڈ
- سیکشنز
- SEM
- حساسیت
- مقرر
- قائم کرنے
- سیٹ اپ
- ظاہر
- سگما
- اشارہ
- اہم
- سلیکن
- ایک
- سائز
- سائز
- سلائس
- سلائیڈ
- چھوٹے
- سنیپ
- سافٹ ویئر کی
- حل
- حل
- ماخذ
- مخصوص
- کمرشل
- مقامات
- مراحل
- معیار
- معیار
- شروع کریں
- شروع
- نے کہا
- اعداد و شمار
- مرحلہ
- مراحل
- ذخیرہ
- حکمت عملی
- سٹریم
- تعلیم حاصل کی
- مطالعہ
- مطالعہ
- کافی
- فراہمی
- سروے
- ترکیب
- لیتا ہے
- تکنیک
- ٹیکنالوجی
- ٹیسٹ
- سے
- کہ
- ۔
- تو
- نظریاتی
- تھرمل
- یہ
- تھرڈ
- اس
- تین
- حد
- کے ذریعے
- بھر میں
- وقت
- اوقات
- ٹائمسٹیمپ
- ٹپ
- ٹشو
- کرنے کے لئے
- کے آلے
- آلات
- کل
- ٹریک
- ٹریکنگ
- تبدیلی
- پھنس گیا
- دو
- Uk
- غیر یقینی صورتحال
- کے تحت
- غیر متوقع
- یونٹس
- جب تک
- استعمال کیا جاتا ہے
- کا استعمال کرتے ہوئے
- ویکیوم
- قیمت
- اقدار
- VeloCity
- ورژن
- بنام
- vivo
- وولٹیج
- حجم
- جلد
- ووکسیل
- W
- تھا
- دھلائی
- پانی
- تھے
- جب
- چاہے
- جس
- جبکہ
- پوری
- گے
- ونڈو
- ساتھ
- کے اندر
- پیداوار
- نکلا
- اپج
- زیفیرنیٹ
- زپ