نانوبوٹ ترکیب
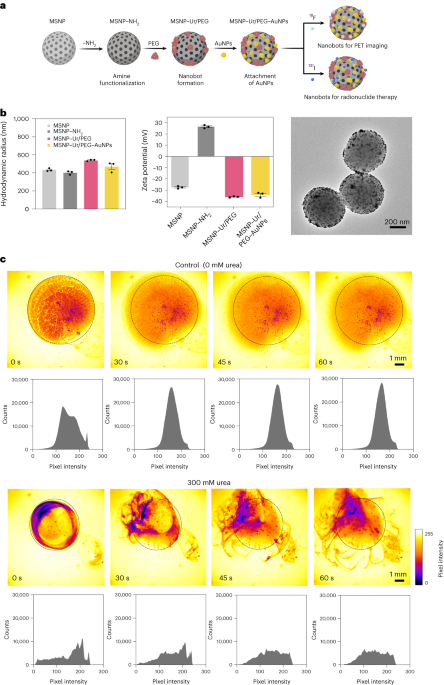
نانوبوٹس تیار کیے گئے تھے جیسا کہ پہلے بیان کیا گیا ہے۔33. مختصراً، MSNPs کو ایک ترمیم شدہ Stöber طریقہ استعمال کرتے ہوئے ترکیب کیا گیا تھا۔4135 منٹ کے لیے 20 °C پر ٹرائیتھانولامین (570 g)، الٹرا پیور واٹر (95 ml) اور hexadecyltrimethylammonium bromide (CTAB; 30 mg) کا رد عمل ظاہر کرتے ہوئے Tetraethyl orthosilicate (1.5 ml) بعد میں ڈراپ وائز شامل کیا گیا تھا۔ مرکب کو 2 °C پر 95 h کے لیے رد عمل ظاہر کرنے کے لیے چھوڑ دیا گیا تھا اور نتیجے میں MSNPs کو سینٹرفیوگریشن کے ذریعے اکٹھا کیا گیا تھا اور ایتھنول میں دھویا گیا تھا (تین بار، 2,500g، 5 منٹ)۔ CTAB ٹیمپلیٹ کو ہٹانے کے لیے، MSNPs کو تیزابی میتھانول (1.8 ml HCl، 30 ml methanol) میں 24 h کے لیے ریفلکس کے نیچے رکھا گیا تھا۔ پھر، MSNPs کو سینٹرفیوگریشن کے ذریعے اکٹھا کیا گیا اور تین بار ایتھنول میں دھویا گیا (2,500g، 5 منٹ) MSNPs (6 mg ml) میں APTES (1 µl per mg of MSNP) کو شامل کر کے امائن ترمیم کو شامل کرنے سے پہلے1-) 70% ایتھانولک محلول میں 70 °C پر، 1 h کے لیے زور سے ہلاتے رہیں۔ MSNPs-NH2 تین بار ایتھنول میں اور تین بار پانی میں سینٹرفیوگریشن کے ذریعے جمع اور دھوئے گئے (تین بار، 1,150g، 5 منٹ)۔ MSNPs-NH2 PBS میں 1 mg ml کے ارتکاز پر دوبارہ معطل کر دیا گیا تھا۔1- اور کل حجم 900 µl، اور کمرے کے درجہ حرارت پر 100 h کے لیے glutaraldehyde (2.5 µl) کے ساتھ فعال۔ فعال MSNPs-NH2 پی بی ایس میں تین بار سینٹرفیوگریشن (1,150g، 5 منٹ)، urease (3 mg ml) کے محلول میں دوبارہ معطل1-) اور heterobifunctional PEG (1 μg PEG فی mg 5 kDa HS-MSNPs-NH2PBS میں، اور کمرے کے درجہ حرارت پر 24 h کے لیے رد عمل ظاہر کیا۔ اس کے بعد نینو بوٹس کو جمع کیا گیا اور پی بی ایس میں تین بار سینٹرفیوگریشن (1,150) کے ذریعے دھویا گیا۔g، 5 منٹ) انہیں اے یو این پی کی بازی میں دوبارہ معطل کرنے سے پہلے، جیسا کہ پہلے بیان کیا گیا ہے51، انہیں 10 منٹ تک رد عمل کا اظہار کرتے ہوئے چھوڑ دیں، اور سینٹرفیوگریشن کے ذریعے اچھی طرح دھوئیں (تین بار، 1,150g، 5 منٹ)۔
ہائیڈروڈینامک سائز کی تقسیم اور MSNPs، MSNPs-NH کی سطحی چارج2، نانو بوٹس اور اے یو این پی سے سجے ہوئے نانوبوٹس کا تعین بالترتیب وائٹ موبیئس ڈائنامک لائٹ سکیٹرنگ سسٹم اور مالورن زیٹاسائزر کا استعمال کرتے ہوئے کیا گیا تھا۔ تمام معاملات میں، ارتکاز 20 µg ml تھا۔1- اور حصول کا وقت 5 s، فی تجربہ تین رنز کا استعمال کرتے ہوئے۔ فی ذرہ قسم کی تین پیمائشیں کی گئیں۔
FITC MSNPs کی ترکیب
FITC (2 mg)، ایتھنول (5 ml) اور APTES (400 µl) کا مرکب تیار کیا گیا اور 30 منٹ کے لیے ہلایا گیا۔ پھر، MSNP ترکیب کے لیے پہلے بیان کردہ پروٹوکول کی پیروی کی گئی، سوائے اس کے کہ ہم نے FITC–APTES مرکب (1.25 µl) کے ساتھ مل کر ٹیٹراتھیل آرتھوسیلیکیٹ (250 ml) ڈراپ وائز شامل کیا۔ ایف آئی ٹی سی کے لیبل والے نانوبوٹس کو حاصل کرنے کے فنکشنلائزیشن کے اقدامات جیسا کہ مذکورہ بالا تھے۔
AUNPs کی ترکیب
اے یو این پی کو ایک اطلاع شدہ طریقہ کا استعمال کرتے ہوئے ترکیب کیا گیا تھا۔33. مختصراً، تمام مواد کو تازہ تیار کردہ ایکوا ریجیا کا استعمال کرتے ہوئے صاف کیا گیا، پانی سے اچھی طرح دھویا گیا، اور ہوا سے خشک کیا گیا۔ اس کے بعد، ایک 1 mM AuCl4 ریفلوکس سسٹم میں ضم شدہ گول نیچے فلاسک میں ہلچل کے دوران محلول کو اس کے ابلتے مقام پر گرم کیا جاتا تھا۔ اس کے بعد، 10 ملی لیٹر سوڈیم سائٹریٹ محلول (30.8 mM) شامل کیا گیا، اور محلول کو 20 منٹ کے لیے ابالا گیا، جس کے نتیجے میں اس کا رنگ سرخ ہو گیا۔ اس کے بعد محلول کو کمرے کے درجہ حرارت پر ٹھنڈا ہونے دیا گیا اور 1 گھنٹہ ہلاتے رہے۔ نتیجے میں آنے والے اے این پیز کو اندھیرے میں محفوظ کیا گیا تھا اور ٹرانسمیشن الیکٹران مائکروسکوپی کا استعمال کرتے ہوئے خصوصیت کی گئی تھی۔
انزیمیٹک سرگرمی
نانوبوٹس کی انزیمیٹک سرگرمی، 18ایف نانوبوٹس اور 131I-nanobots کو فینول ریڈ کا استعمال کرتے ہوئے ماپا گیا۔ ایسا کرنے کے لیے، 2 µl نانوبوٹس (1 mg ml1-) کو 96 کنویں کی پلیٹ میں شامل کیا گیا اور 200 µl مختلف یوریا محلول (0, 50, 100, 200 mM) کے ساتھ 1.1 mM فینول ریڈ میں ملایا گیا۔ 560 nm پر جذب کو وقت کے ساتھ 37 °C پر ناپا گیا۔
آپٹیکل مائکروسکوپی کے ذریعے نانوبوٹ موشن ڈائنامکس
نانو بوٹس کی آپٹیکل ویڈیوز لائیکا تھنڈر مائکروسکوپ کا استعمال کرتے ہوئے حاصل کی گئیں، جس میں ہماتسو ہائی اسپیڈ سی سی ڈی کیمرہ اور ایک × 1.25 مقصد تھا۔ اس کے لیے، نینو بوٹس کو سینٹرفیوج کیا گیا تھا اور PBS کے 50 µl میں دوبارہ معطل کیا گیا تھا (20 mg ml کی حتمی حراستی1-)۔ اس کے بعد، ایک پیٹری ڈش میں 3 ml PBS یا 300 mM یوریا (PBS میں) کے محلول سے بھرا گیا اور اسے خوردبین کے نیچے دیکھا گیا۔ نانوبوٹس کے ساتھ 5 µl ڈراپ (20 mg ml1-اس کے بعد مائع سے بھری پیٹری ڈش میں شامل کیا گیا اور 25 فریم فی سیکنڈ کی رفتار سے ویڈیوز ریکارڈ کی گئیں۔ ROIs میں ویڈیو پکسل کی شدت کی تقسیم کا امیج جے سافٹ ویئر کا استعمال کرتے ہوئے 15 کے وقفوں پر تجزیہ کیا گیا۔
نینو بوٹس کی ریڈیو لیبلنگ کے ساتھ [18F]F-PyTFP
کی ترکیب [18F]F-PyTFP
[18F]F-PyTFP کو ایک Neptis xSeed ماڈیول (آپٹمائزڈ ریڈیو کیمیکل ایپلی کیشنز) میں ترکیب کیا گیا تھا، جو پہلے بتائے گئے طریقہ کے بعد تھا۔33.
ترکیب کی 18ایف لیبل والے نانوبوٹس
نانوبوٹس پر [18F]F-PyTFP، معمولی ترمیم کے ساتھ پہلے سے قائم کردہ طریقہ کار کی بنیاد پر33. مختصراً، 200 µl نانوبوٹ محلول (1 mg ml)1-) کو سینٹرفیوج کیا گیا تھا (10 منٹ، 13,853g)، PBS کے 10 µl میں دوبارہ معطل کیا گیا (1 mM، pH 8)، اور 4 µl کے ساتھ انکیوبیٹڈ18F]F-PyTFP acetonitrile میں (تقریباً 37 MBq) کمرے کے درجہ حرارت پر 35 منٹ کے لیے۔ انکیوبیشن کے بعد، رد عمل کے مرکب کو پانی (200 µl) سے پتلا کیا گیا اور سینٹرفیوگریشن (5 min، 13,853) سے پاک کیا گیا۔g)۔ نتیجے میں گولی کو خوراک کیلیبریٹر (CPCRC-25R، Capintec) میں ماپا جانے سے پہلے تین بار پانی سے دھویا گیا۔ ریڈیو کیمیکل پیداوار کو دھونے کے بعد نینو بوٹس میں موجود تابکاری کی مقدار اور تابکاری کی ابتدائی مقدار کے درمیان تناسب کے طور پر شمار کیا گیا تھا۔ طہارت کے بعد ریڈیو کیمیکل طہارت ≥99% تھی، جیسا کہ ریڈیو پتلی پرت کی کرومیٹوگرافی (ریڈیو-TLC) کے ذریعے iTLC-SG کرومیٹوگرافی پیپر (ایجیلنٹ ٹیکنالوجیز) اور ڈائیکلورومیتھین اور میتھانول (2:1) کو بطور اسٹیشنری اور موبائل فیزز استعمال کرتے ہوئے طے کیا گیا ہے۔ TLC پلیٹوں کا تجزیہ TLC ریڈر (MiniGITA، Raytest) کا استعمال کرتے ہوئے کیا گیا۔
کی استحکام 18ایف نانوبوٹس
کا استحکام 18ایف لیبل والے نانوبوٹس کا تعین درج ذیل میڈیا کا استعمال کرتے ہوئے کیا گیا تھا: (1) 300 mM یوریا، (2) پانی، اور (3) ٹیومر والے جانوروں کا پیشاب۔ 18F- لیبل والے نانوبوٹس (10 µl) کو کمرے کے درجہ حرارت پر 100 h کے لیے اسی محلول (1 µl) کے ساتھ انکیوبیٹ کیا گیا تھا۔ اس کے بعد، نانوبوٹس اور سپرنٹنٹ کو سینٹرفیوگریشن کے ذریعے الگ کیا گیا اور اکٹھا کیا گیا، اور تابکاری کو خوراک کیلیبریٹر (CPCRC-25R) میں ماپا گیا۔
نینو بوٹس کی ریڈیو لیبلنگ کے ساتھ 131I
یوریس نانوبوٹس کی ریڈیو آئوڈنیشن نانوبوٹس کو انجیکشن ایبل کے ساتھ انکیوبیٹ کرکے انجام دیا گیا تھا۔131I]NaI حل (925 MBq ml1-; جی ای ہیلتھ کیئر)۔ مختصراً، 400 µl urease nanobot محلول (1 mg ml1-) کو سینٹرفیوج کیا گیا تھا (13,853g5 min)، PBS کے 100 µl (10 mM, pH 7.4) میں دوبارہ معطل کیا گیا اور 25 µl یا 185 µl انجیکشن کے ساتھ انکیوبیٹ کیا گیا [131I]NaI (تقریباً 42.55 یا 277.5 MBq، بالترتیب) 30 منٹ کے لیے، مطلوبہ حتمی سرگرمی پر منحصر ہے۔ انکیوبیشن کے بعد، رد عمل کے مرکب کو سینٹرفیوگریشن (13,853) سے پاک کیا گیا تھا۔g، 5 منٹ)۔ اس کے نتیجے میں آنے والے پانی کو تین بار پانی (100 µl) سے دھویا گیا۔ سپرنٹنٹ اور پریسیپیٹیٹ میں ریڈیو ایکٹیویٹی کا تعین ڈوز کیلیبریٹر (CPCRC-25R) کے ذریعے کیا گیا تھا، اور دونوں حصوں کا تجزیہ ریڈیو-TLC کے ذریعے کیا گیا تھا، جیسا کہ 18ایف نانوبوٹس۔
جانوروں کے ماڈل کی ترقی
چوہوں کی دیکھ بھال اور دیکھ بھال یورپی کونسل کی ہدایت 2010/63/UE اور داخلی رہنما خطوط کے مطابق کی گئی۔ تمام تجرباتی طریقہ کار CIC biomaGUNE اخلاقیات کمیٹی اور مقامی حکام (Diputación Foral de Guipuzcoa, PRO-AE-SS-276) کے ذریعے منظور کیے گئے تھے۔ تصویری تجزیہ (PET اور MRI دونوں) جانوروں کی گروپ تقسیم کی طرف اندھا کردیا گیا تھا۔
مثانے کے کینسر کا آرتھوٹوپک مورائن ماڈل MB49 خلیات (مورائن کارسنوما مثانے کی سیل لائن) کی انٹراویسیکل ایڈمنسٹریشن کے ذریعہ C57BL/6JRj مادہ چوہوں (8 ہفتے پرانا، جانویئر) کو تیار کیا گیا تھا۔ ٹیومر کے جمع ہونے کا تعین کرنے کے لیے کیے گئے تجربات کے لیے (چار گروپ؛ تفصیلات ذیل میں)، چھ جانوروں کو فی گروپ ٹیکہ لگایا گیا، جیسا کہ درست تجزیہ کا استعمال کرتے ہوئے، درج ذیل مفروضوں کے ساتھ طے کیا گیا: مطلوبہ درستگی، 20%؛ متوقع s.d., ±20%؛ اعتماد، 95٪؛ جانوروں کا نقصان، 20٪ علاج کی افادیت کے تجربات کے لیے (چھ گروپ؛ تفصیلات ذیل میں)، فی گروپ دس جانور شامل کیے گئے، جیسا کہ ایک دم والے طالب علم کا استعمال کرتے ہوئے حساب کیا گیا ہے۔ t-ٹیسٹ، دو آزاد ذرائع کے درمیان فرق، درج ذیل مفروضوں کے ساتھ: کالعدم مفروضہ، علاج ٹیومر کی نشوونما کو متاثر نہیں کرتا ہے۔ α، 0.05; 1 - β0.95; s.d.، ±50%؛ گروپوں کے درمیان متوقع اختلافات، 50%؛ جانوروں کا نقصان، 20٪ چونکہ تجربہ آپریشنل وجوہات کی بناء پر دو بیچوں میں کیا گیا تھا، دونوں بیچوں میں ایک کنٹرول گروپ شامل کیا گیا تھا (ٹیبل 2)، اور پھر تمام جانوروں کو جمع کیا گیا۔ ٹیومر کے قیام کے لیے، چوہوں کو خالص O میں 3% isoflurane کے سانس کے ذریعے بے ہوشی کی گئی۔2 اور 1.0% O میں 1.5–100% isoflurane کے ذریعے برقرار رکھا جاتا ہے۔2. اس کے بعد، مثانے کو خالی کر دیا گیا، اور 50 µl پولی- کے داخلے کے ذریعے یوروتھیلیم پر کیمیائی زخم پیدا ہوئے۔l-لائسین (سگما-الڈرچ) 24 گیج کیتھیٹر کے ذریعے 15 منٹ تک۔ اس کے بعد، مثانہ دوبارہ خالی کر دیا گیا اور MB49 خلیات (105 خلیات) ہائی گلوکوز DMEM (100 µl) میں کیتھیٹر کو ہٹانے اور پیٹ کی مالش کے ذریعے مثانے کو خالی کرنے سے پہلے 1 µl کے لیے ڈالے گئے تھے۔ تمام تجربات کے دوران صحت اور بہبود کی نگرانی کے لیے چوہوں کی نگرانی کی گئی اور ان کا وزن کیا گیا۔ ایک انسانی اختتامی نقطہ لاگو کیا گیا تھا اگر وزن میں کمی 20٪ سے زیادہ ہو یا طبی علامات کی بنیاد پر، انچارج جانوروں کے ڈاکٹر کے معیار کے تحت۔
ٹیومر کے سائز سے باخبر رہنا
ٹیومر انڈکشن کے 7 اور 14 دن بعد MRI اسٹڈیز 7 T Bruker BioSpec USR 70/30 سکینر (Bruker BioSpin) کا استعمال کرتے ہوئے کی گئیں جو BGA-12S گریڈینٹ انسرٹ 440 mT m سے لیس تھی۔1- اور ریڈیو فریکونسی کے لیے 112/086 QSN ریزونیٹر (T12053V3)14 ٹرانسمیشن، اور RF ریسپشن کے لیے چوہے کے دماغ کی سطح کا کوائل (T11205V3) (دونوں 300 MHz پر کام کر رہے ہیں)۔ جانوروں کو isoflurane کے ساتھ بے ہوشی کی گئی تھی (4% شامل کرنے کے لیے اور 1.5% دیکھ بھال کے لیے 50% O میں2/50% N2 مرکب) اور MR-مطابقت رکھنے والے جھولا پر رکھا۔ جسم کے درجہ حرارت اور سانس کی شرح کو MR-مطابقت رکھنے والے مانیٹرنگ ڈیوائس (ماڈل 1030 SA، Small Animal Instruments) کا استعمال کرتے ہوئے مسلسل مانیٹر کیا جاتا تھا، جو جسم کے درجہ حرارت کو برقرار رکھنے کے لیے ایک چھوٹے چوہا ایئر ہیٹر سسٹم سے جڑا ہوا تھا۔ حوالہ جات کی تصاویر حاصل کرنے کے بعد، مندرجہ ذیل پیرامیٹرز کا استعمال کرتے ہوئے ٹیومر کی تصویر کشی کے لیے ایک اسپن-ایکو پر مبنی ڈفیوژن-ویٹڈ امیجنگ ترتیب کا استعمال کیا گیا: echo time (TE) = 22.3 ms، تکرار کا وقت (TR) = 2,500 ms، n = 2 اوسط، ایک A0 تصویر (کے ساتھ بنیادی تصویر b = 0 s ملی میٹر2-) اور ایک DW تصویر (1, 0, 0) سمت میں پھیلاؤ کے میلان کا استعمال کرتے ہوئے ایک تدریجی مدت کے ساتھ حاصل کی گئی δ = 4.5 ms اور ایک تدریجی علیحدگی Δ = 10.6 ms، دینا b = 650 s ملی میٹر2-، ایک 16 × 16 mm2 فیلڈ آف ویو، 160 × 160 پوائنٹس کا امیج میٹرکس سائز، 20 mm موٹائی کے 0.5 لگاتار سلائس (کوئی گیپ نہیں، انٹرلیویڈ موڈ میں حاصل کیا گیا) اور 192.9 Hz فی پکسل کی بینڈوتھ۔ ٹیومر کا تصور کرنے کے لیے، امیج جے سافٹ ویئر کے ساتھ تصاویر کو پوسٹ پروسیس کیا گیا تھا، جس میں ایک ڈفیوژن گریڈینٹ کے ساتھ حاصل کردہ تصاویر کو تقسیم کیا گیا تھا۔b = 650 s ملی میٹر2-) بغیر حاصل کیے گئے لوگوں کے ذریعے (b = 0 s ملی میٹر2-)، اور 3D گاوسی فلٹر لگانا (σx = σy = σz = 0.7) نتیجہ تک۔ ٹیومر کو دستی طور پر ان کے حجم کا تعین کرنے کے لئے تیار کیا گیا تھا۔
ویوو بائیو ڈسٹری بیوشن میں
ٹیومر شامل کرنے کے بعد 15 ویں دن، چوہوں کو چار گروپوں میں بے ترتیب بنایا گیا تاکہ گروپوں کے درمیان ٹیومر کے حجم کی یکساں اوسط تقسیم حاصل کی جا سکے۔ PET-CT اسکین (MOLECUBES β اور X-CUBE اسکینرز) 3 µl کے داخلی طور پر انتظام کرنے کے بعد 100 h بعد حاصل کیے گئے تھے۔ 18F-BSA (گروپ 1 اور 2) یا 18F-urease (گروپ 3 اور 4) نانوبوٹس 200 µg ml کے ارتکاز میں1-یا تو پانی (گروپ 1 اور 3) یا 300 mM یوریا پانی میں استعمال کریں (گروپ 2 اور 4) بطور گاڑی (ٹیبل 1)۔ امیج کے حصول کے لیے، جانوروں کو اینستھیزیا (خالص آکسیجن میں 5% isoflurane) کے ساتھ آمادہ کیا گیا اور مثانے کے انخلاء کے لیے پیٹ کے علاقے کی مالش کرنے سے پہلے انہیں سوپائن پوزیشن میں رکھا گیا۔ اس کے فوراً بعد، متعلقہ 18ایف لیبل والے نانوبوٹس (18F-BSA/18پانی/یوریا میں ایف یوریا) کو 24 گیج کیتھیٹر کے ذریعے مثانے میں ڈالا گیا اور کیتھیٹر کو ہٹانے، مثانے کو خالی کرنے اور چوہوں کو اینستھیزیا سے صحت یاب ہونے کے لیے چھوڑنے سے پہلے 1 گھنٹے کے لیے انکیوبیٹ کیا گیا۔ پر t = 3 h انتظامیہ کے بعد، جانوروں کو دوبارہ بے ہوشی کی گئی اور 10 منٹ جامد پورے جسم کی PET تصاویر حاصل کی گئیں، جس کے بعد CT سکین کیے گئے۔ پی ای ٹی امیجز کو 3D آرڈرڈ سب سیٹ ایکپیکشن میکسمائزیشن ری کنسٹرکشن الگورتھم کا استعمال کرتے ہوئے رینڈم، سکیٹر اور اٹینیویشن تصحیح کے ساتھ دوبارہ بنایا گیا تھا۔ اسی ماؤس کی PET-CT تصاویر کو PMOD امیج پروسیسنگ ٹول کا استعمال کرتے ہوئے شریک رجسٹر اور تجزیہ کیا گیا تھا۔ وقت کے مقابلے میں ریڈیو ایکٹیویٹی کے ارتکاز کے پلاٹ ایک 3D کونٹور ٹول کا استعمال کرتے ہوئے اوپری مثانے کے علاقے میں دلچسپی کا حجم پیدا کرکے اور فی عضو کلو بیککرلز میں سرگرمی کی پیمائش (سڑنا درست) کرکے حاصل کیا گیا۔ انشانکن عنصر کو لاگو کرکے نتائج کو درست کیا گیا اور پھر MRI سے حاصل کردہ ٹیومر کے حجم کے ذریعہ معمول بنایا گیا۔
سابق Vivo مطالعہ
ہسٹوپیتھولوجک تجزیہ
تمام امیجنگ مکمل کرنے کے بعد، مثانے کا انتخاب کیا گیا (n ٹیومر والے اور صحت مند جانوروں سے = 3 فی گروپ) کو ایسپٹک حالات میں ہٹا دیا گیا اور فوری طور پر 4% فارملڈہائیڈ میں طے کیا گیا۔ اس کے بعد، ہیماتوکسیلین – eosin سٹیننگ کے لیے 2–3 µm حصے لینے سے پہلے مثانے پیرافین میں سرایت کر گئے تھے۔ ہسٹوپیتھولوجک امتحان کے لئے تمام شرائط سے نمائندہ تصاویر حاصل کی گئیں۔
ICP-MS تجزیہ
پیمائش تھرمو iCAP Q ICP-MS (تھرمو فشر سائنٹیفک) پر ASX-560 آٹو سیمپلر (سی ای ٹی اے سی ٹیک) کے ساتھ کی گئی۔ تمام امیجنگ مکمل کرنے کے بعد، جانوروں کو مار دیا گیا، اور مثانے کا انتخاب کیا گیا (n = 2 فی گروپ؛ چار گروپ) HNO کے 1 ml میں جمع اور ہضم ہوتے ہیں۔3:HCl (4:1 مرکب)۔ بازی کو اس وقت تک ابالا جاتا تھا جب تک کہ اعضاء مکمل طور پر تحلیل نہ ہو جائیں۔ اس کے بعد، محلول کو کمرے کے درجہ حرارت پر ٹھنڈا کیا گیا اور ICP-MS کا استعمال کرتے ہوئے تجزیہ کیا گیا تاکہ ہر نمونے میں Au کے ارتکاز کا تعین کیا جا سکے، جس سے نتائج کو فی گرام ٹشو (%ID g) انجکشن شدہ خوراک کے فیصد میں تبدیل کیا گیا۔1-).
امیونو ہسٹو کیمسٹری اور کنفوکل مائکروسکوپی امیجنگ
امیونو ہسٹو کیمسٹری کے تجزیوں کے لیے، ٹیومر والے جانوروں کو پانی میں FITC کے لیبل والے نانوبوٹس یا 300 mM یوریا (n = 4 فی گروپ)، جیسا کہ اوپر بیان کیا گیا ہے، PET-CT مطالعہ کے لیے۔ مزید برآں، نانوبوٹس کے بغیر ٹیومر والے جانور ایک کنٹرول گروپ کے طور پر کام کرتے ہیں (n = 2)۔ تمام صورتوں میں، مثانے جمع کیے گئے، منجمد کیے گئے اور 10 µm حصوں میں کاٹ دیے گئے جنہیں فوری طور پر 10% formaldehyde میں 15 min کے لیے طے کیا گیا، 10 mM PBS سے دھویا گیا اور پھر 50 mM NH میں انکیوبیٹ کیا گیا۔4PBS کے ساتھ دوبارہ کلی کرنے سے پہلے 5 منٹ کے لیے PBS میں Cl لگائیں۔ پارمیبلائزیشن میتھانول کے ساتھ کی گئی تھی: ایسیٹون (1:1) کمرے کے درجہ حرارت پر 5 منٹ کے لیے اور PBS میں 0.1% ٹریٹن 5 منٹ کے لیے۔ پی بی ایس دھونے کے بعد، نمونوں کو پی بی ایس میں 5٪ BSA–0.5٪ Tween کے محلول کے ساتھ کمرے کے درجہ حرارت پر 15 منٹ کے لیے سیر کیا گیا اور 1٪ BSA میں ماؤس اینٹی FITC (1:100، Abcam) کے ساتھ کمرے کے درجہ حرارت پر 5 h کے لیے انکیوبیٹ کیا گیا۔ -0.5% درمیان۔ حصوں کو 10 mM PBS کے ساتھ 5 منٹ کے لیے تین بار دھویا گیا اور 30 منٹ کے لیے کمرے کے درجہ حرارت پر سیکنڈری اینٹی باڈی Alex Fluor 647 گدھا اینٹی ماؤس IgG (مالیکیولر پروبس، لائف ٹیکنالوجیز، 1:1,000) کے ساتھ 5% BSA-0.5 میں انکیوبیٹ کیا گیا۔ PBS میں، PBS (3 × 5 min) میں دوبارہ دھویا گیا اور 4,6-diamidino-2-phenylindole (DAPI؛ مالیکیولر پروبس، لائف ٹیکنالوجیز) کے ساتھ ایک پرو لانگ اینٹی فیڈ کٹ کے ساتھ نصب کیا گیا۔ تصاویر کو Leica STELLARIS 5 confocal microscope (UPV/EHU سائنٹیفک پارک) کے ساتھ تمام حصوں کے لیے ایک جیسی ترتیبات کے ساتھ حاصل کیا گیا تھا: ×10 ٹائل امیجنگ اور سلائی کے ساتھ میگنیفیکیشن (عام طور پر 4 × 5 فیلڈ آف ویو)۔ لیزر لائن اور ڈیٹیکشن ونڈوز DAPI کے لیے 405 nm اور 440–503 nm، FITC وائٹ لیزر کے لیے 489 nm اور 494–602 nm اور la Alexa653 کے لیے 660 nm اور 836–647 nm تھیں۔
آپٹیکل کلیئرنگ
4% paraformaldehyde اور PBS کے ساتھ پرفیوژن کے بعد، مثانے کے نمونے ہٹا دیے گئے اور مزید 4% paraformaldehyde میں راتوں رات 4 °C پر طے کیے گئے، پھر 5 ml کی سرنج میں 0.8% کم پگھلنے والے پوائنٹ ایگرز کے ساتھ سرایت کر کے ایک بیلناکار بلاک بنانے اور آسانی سے قابل بنایا۔ کوارٹج کیویٹ میں بڑھتے ہوئے. میتھانول کا استعمال کرتے ہوئے پورے بلاک کو آہستہ آہستہ پانی کی کمی کی گئی تھی: ایچ2O 4 °C پر (30%:70% 1 h کے لیے، 50%:50% 1 h کے لیے، 70%:30% 1 h کے لیے، 100%:0% 1 h کے لیے، پھر 100% میتھانول رات بھر اور دوبارہ 4 h) اور آخر میں امیجنگ کے لیے ریفریکٹیو انڈیکس مماثل حل کے طور پر بینزائل الکحل – بینزائل بینزویٹ (BABB) میں ڈوبا گیا۔ تجارتی سرخ ذرات کے ساتھ سبز FITC نانوبوٹس کے وٹرو موازنہ کے لیے، ہم نے DiagNano (تخلیقی تشخیص) سرخ فلوروسینٹ سلیکا نینو پارٹیکلز، 1 µm قطر، BABB کلیئرنگ کے خلاف مزاحم استعمال کیا۔
آٹو فلوروسینس اور پولرائزڈ ایس ایل ایس امیجنگ
لائٹ شیٹ امیجنگ میکرو ایس پی آئی ایم پر کی گئی تھی، جو کہ IRB بارسلونا میں تیار کردہ مکمل اعضاء کی امیجنگ کے لیے ایک کسٹم سسٹم ہے۔44,45. مختصراً، نمونے ایک ایگروز بلاک میں سرایت کیے جاتے ہیں، نمونے کے ساتھ صاف کیے جاتے ہیں اور کوارٹج کیویٹ کے اندر امیج کیے جاتے ہیں۔ آٹو فلوروسینس امیجنگ نے 488، 561 یا 638 nm پر لیزرز کا استعمال کیا جس میں 50 mm کی رنگین ڈبلٹ سلنڈریکل لینس (ACY254-050-A، Thorlabs) کے ذریعے روشنی فراہم کی جاتی ہے۔ پٹی کے نوادرات کو کم کرنے کے لیے، لائٹ شیٹ کو 10f دوربین کے ساتھ ایک گونجنے والے اسکینر SC-4 (EOPC) کے ساتھ G322288322 100 mm achromatic doublet lenses (QI Optic Photonics) کے ساتھ محور کیا جاتا ہے۔ ٹشو آٹو فلوروسینس کو بینڈ یا لانگ پاس فلوروسینس فلٹرز کے ذریعے جمع کیا جاتا ہے اور اسے ORCA فلیش v2 کیمرے (Hamamatsu Photonics) کے ساتھ ریکارڈ کیا جاتا ہے۔ امیجنگ ×9.6 پر ×8 زوم، ×2 لینس اور ×0.6 ٹیوب لینس کے ساتھ کی گئی۔ لائٹ شیٹ کو منظر کے میدان میں چپٹا کر دیا گیا، جس سے 5–6 µm محوری ریزولوشن حاصل ہوا۔ 3D امیجنگ 2.5 µm کے مراحل میں کی گئی تھی۔ پورے مثانے کی امیجنگ 2 × 3 یا 3 × 4 میں کی گئی تھی۔ XY ٹائلیں، عضو کے سائز پر منحصر ہے.
ایس ایل ایس امیجنگ فلوروسینس فلٹر کو ہٹا کر یا لیزر کو منتقل کرنے والے کسی بھی فلٹر کا استعمال کرکے حاصل کیا گیا تھا۔ لائٹ شیٹ پیوٹنگ نے لیزر اسپیکل شور کو کم کیا، جس کے نتیجے میں لیزر ہم آہنگی کی عارضی اوسط ہوتی ہے جیسا کہ پہلے دکھایا گیا ہے۔52. الیومینیشن میں لکیری لائٹ شیٹ پولرائزیشن کی واقفیت کو پیوٹ سکینر سے پہلے نصف لہر پلیٹ (AHWP05M-600، Thorlabs) کو گھما کر کنٹرول کیا گیا تھا۔ پتہ لگانے والے سگنل کو پولرائزیشن میں ایک گھومنے والے لکیری پولرائزر (LPVISC100، Thorlabs) کا استعمال کرتے ہوئے فلٹر وہیل کا پتہ لگانے سے پہلے منتخب کیا گیا تھا، جس سے فلوروسینس کا پتہ لگانے میں >50% شدت کا نقصان ہوتا ہے۔ جبکہ پولرائزر کی سمت بندی کے ساتھ sLS سگنل کی تقسیم عام طور پر تبدیل ہوتی ہے، ٹشو آٹو فلوروسینس سگنل پولرائزر کی گردش سے متاثر نہیں ہوتا ہے۔ sLS BABB میں 2.4 ± 0.3 µm کی مقامی ریزولوشن دیتا ہے، جو فلوروسینس لائٹ شیٹ امیجنگ میں ریزولوشن سے موازنہ ہے XY ایک ذرہ کا تصویری ردعمل، ضمنی تصویر۔ 8l–m) اور ہوا میں نظریاتی ریزولوشن کے قریب (1.53 µm عددی یپرچر کے ساتھ (NA) = 0.2 زیادہ سے زیادہ میکرو زوم ×8 پر)۔
تصویری پروسیسنگ اور 3D تجزیہ
امیج پروسیسنگ، سیگمنٹیشن اور لائٹ شیٹ ڈیٹاسیٹس کا تجزیہ امیج جے/فجی کے ساتھ کیا گیا تھا، جبکہ انجیر۔ 3 اور 4 Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) اور ضمنی ویڈیو 3 Imaris 9 کے ساتھ تیار کیا گیا تھا (https://imaris.oxinst.com/) (بٹ پلین، آکسفورڈ آلات)۔ ٹائل شدہ لائٹ شیٹ ڈیٹاسیٹس MosaicExplorerJ کے ساتھ سلے ہوئے تھے۔53. ورچوئل موڈ میں بڑی مقداروں کی نیم خودکار 3D تشریح کے لیے کسٹم امیج جے/فجی میکروز کا استعمال کرتے ہوئے مثانے کے ٹشو تھری ڈی سیگمنٹیشن کی گئی۔ مختصراً، ایک پہلا اسکرپٹ، 'Macro3'، 1D امیج اسٹیک کو لوڈ کرتا ہے، متعدد طیاروں میں ROIs کی صارف تشریح کو قابل بناتا ہے اور ROIs کو 3D ماسک بنانے اور برآمد کرنے کے لیے خود بخود انٹرپولیٹ کرتا ہے۔ ROIs ہر 3 طیاروں (ہر 15 µm) پر کھینچے گئے تھے تاکہ تشریحات کو کم سے کم مناسب رکھتے ہوئے اچھی سیگمنٹیشن تسلسل کو آسان بنایا جاسکے۔ دوسرا اسکرپٹ، 'Macro37.5' ریاضیاتی یا بولین آپریشنز کرتا ہے، ہوائی جہاز کے ذریعے پورے اسٹیک کو میموری میں لوڈ کیے بغیر، یا تو 2D ماسک کے درمیان یا 3D ماسک اور اصل ڈیٹا کے درمیان، نتیجہ کو ایک نئے اسٹیک کے طور پر محفوظ کرتا ہے۔ تمام ماسک آٹو فلوروسینس امیجز کی تشریح کرکے تیار کیے گئے تھے۔
دونوں ٹیومر اور صحت مند بافتوں کی سطح کی پرتیں (تصویر 2)۔ 3) کو ایک ماسک میں مثانے کی گہا پر فجی کی چھڑی اور لاسو ٹولز کا استعمال کرتے ہوئے خاکہ بنایا گیا تھا۔ اس پہلی تکرار کو BC1 کہتے ہوئے، میکرو 1 کے بعد کے رن پھر خود بخود اس 3D کونٹور کو ایک متعین پکسل کی رقم سے ڈائلٹ کر دیتے ہیں تاکہ نئے ماسک کی تکرار، BC2، BC3 اور اسی طرح، بڑھتی ہوئی بازیوں کے ساتھ حاصل ہو سکے۔ پہلی تہہ جس میں ٹیومر اور صحت مند ٹشو دونوں ہوتے ہیں، ماسک L1، ماسک BC1 کو BC2 سے گھٹا کر حاصل کیا جاتا ہے، جس سے L2 اور L3 متمرکز تہوں کے طور پر حاصل ہوتے ہیں۔ گہا کے قریب ترین ٹیومر کا حجم ماسک T1 بنانے کے لیے چھڑی اور لاسو ٹولز کے ساتھ ٹیومر کی تشریح کرکے حاصل کیا گیا تھا، جبکہ صحت مند یوروتھیلیم 3D پرت کو ماسک U1 میں الگ سے دریافت کیا گیا تھا۔ L1 سے U1 کو گھٹانے سے ٹیومر کی سطحی تہہ نکلتی ہے، اور اسی طرح: L2 − U1، L3 − U1۔ اس کے برعکس، urothelium کی پہلی تہہ T1 کو L1 سے گھٹا کر حاصل کی جاتی ہے۔ تصویر میں تمام پرتیں 3 33 µm موٹائی کی تعریف کی گئی تھی۔
میکرو اور طریقہ کار کا ایک ہی مجموعہ (ImageJ وانڈ ٹول، 500 µm کا ڈیجیٹل کٹاؤ اور اسی طرح) مثانے کے بافتوں کے اندرونی حصے کو بیان کرنے اور تقسیم کرنے اور پھر مثانے کے اندرونی بافتوں کے حجم کا تخمینہ لگانے کے لیے استعمال کیا گیا تھا (تصویر XNUMX)۔ 4تفصیلات کے لیے اوپر دیکھیں)۔ بکھرے ہوئے سگنل کی شدت کے ہسٹوگرامس فجی میں بکھرے ہوئے سگنل اور ماسک کو ملا کر بنائے گئے تھے۔
RNT کا استعمال کرتے ہوئے 131آئی نانوبوٹس
ٹیومر امپلانٹیشن کے بعد 8 اور 15 دنوں کے درمیان، جانوروں کو چھ گروپوں (گروپ 1-6) میں تقسیم کیا گیا، گروپوں میں ٹیومر کی اوسط مقدار کو حاصل کرنے کی کوشش کی گئی (ٹیبل 2)۔ تجربات کے لیے، جانوروں کو اینستھیزیا (خالص O میں 5% isoflurane) کے ساتھ آمادہ کیا گیا۔2) اور پیٹ کے علاقے کی مالش کرکے مثانے کو خالی کرنے سے پہلے supine کی پوزیشن میں رکھا۔ اس کے فوراً بعد، 100 µl 400 µg ml کی حراستی میں مناسب علاج1- (ٹیبل 2) کو 24 گیج کیتھیٹر کا استعمال کرتے ہوئے مثانے میں داخل کیا گیا تھا۔ کیتھیٹر کو ہٹانے سے پہلے علاج اور گاڑی (پانی یا یوریا) مثانے میں 1 گھنٹے تک رہا۔ پیٹ کی مالش کے ذریعے مثانے کو دوبارہ خالی کر دیا گیا تھا اور چوہوں کو ان کے پنجروں میں اینستھیزیا سے برآمد کیا گیا تھا، تابکار آلودگی کو دور کرنے کے لیے علاج کے بعد جانوروں کے پنجرے کے چورا کو 24 h کے بعد تبدیل کیا گیا تھا۔
علاج کی افادیت کا تعین ایم آر آئی سے ہوتا ہے۔
ہر ماؤس پر دو ایم آر آئی مطالعہ کیے گئے: (1) ٹیومر کے ٹیکے لگانے کے بعد 7 اور 14 دنوں کے درمیان جانوروں کو گروپوں میں بے ترتیب بنانے اور ابتدائی (پریٹریٹمنٹ) ٹیومر کی مقدار کی پیمائش کرنے کے لیے؛ (2) ٹیومر ٹیکہ لگانے کے بعد 16 اور 21 دنوں کے درمیان (علاج کے بعد) علاج کی افادیت کا اندازہ کرنے کے لیے۔ MRI دستیابی کے لحاظ سے 7 T Bruker BioSpec اور 11.7 T Bruker BioSpec سکینرز (دونوں ParaVision 7 سافٹ ویئر کے ساتھ) کا استعمال کرتے ہوئے کیا گیا تھا۔ اس نے نتائج کو متاثر نہیں کیا کیونکہ بیرونی فیلڈ جسمانی امیجنگ کے لئے اہم نہیں ہے۔14. امیجنگ کے تجربات اسی امیجنگ پیرامیٹرز اور پروسیسنگ کا استعمال کرتے ہوئے کیے گئے جیسا کہ اوپر بیان کیا گیا ہے (ٹیومر کے سائز سے باخبر رہنا)۔ 11.7 T سکینر کے معاملے میں سیٹ اپ استقبالیہ کے لیے ماؤس ہارٹ سرفیس کوائل اور ٹرانسمیشن کے لیے ایک والیومیٹرک کوائل پر مشتمل تھا۔ ہر سلائس میں ٹیومر کی مقدار کا تعین ٹیومر کے علاقے کو ڈھکنے والی دلچسپی کی دستی طور پر تیار کردہ جلدوں سے کیا گیا تھا۔
شماریاتی تجزیہ
پی ای ٹی امیجنگ اسٹڈیز میں، انجکشن شدہ خوراک کی فیصد (% ID) اور انجکشن شدہ خوراک فی ٹیومر حجم (% ID cm)-3) کا یک طرفہ انووا کا استعمال کرتے ہوئے موازنہ کیا گیا۔ ٹوکی کے متعدد موازنہ ٹیسٹ کا استعمال کرتے ہوئے گروپوں کے درمیان اختلافات کا تعین کیا گیا تھا۔ RNT سیکشن میں NTV ایک سے حاصل کیا گیا تھا۔ t- بغیر جوڑ والی اقدار کا ٹیسٹ۔ ڈیٹا کی تقسیم کو عام سمجھا جاتا تھا، لیکن اس کا باقاعدہ تجربہ نہیں کیا گیا تھا۔ گراف پیڈ پرزم v.8 کے ساتھ شماریاتی تجزیے کیے گئے۔
رپورٹنگ کا خلاصہ۔
تحقیقاتی ڈیزائن کے بارے میں مزید معلومات اس میں دستیاب ہے۔ نیچر پورٹ فولیو رپورٹنگ کا خلاصہ اس مضمون سے منسلک
- SEO سے چلنے والا مواد اور PR کی تقسیم۔ آج ہی بڑھا دیں۔
- پلیٹو ڈیٹا ڈاٹ نیٹ ورک ورٹیکل جنریٹو اے آئی۔ اپنے آپ کو بااختیار بنائیں۔ یہاں تک رسائی حاصل کریں۔
- پلیٹوآئ اسٹریم۔ ویب 3 انٹیلی جنس۔ علم میں اضافہ۔ یہاں تک رسائی حاصل کریں۔
- پلیٹو ای ایس جی۔ کاربن، کلین ٹیک، توانائی ، ماحولیات، شمسی، ویسٹ مینجمنٹ یہاں تک رسائی حاصل کریں۔
- پلیٹو ہیلتھ۔ بائیوٹیک اینڈ کلینیکل ٹرائلز انٹیلی جنس۔ یہاں تک رسائی حاصل کریں۔
- ماخذ: https://www.nature.com/articles/s41565-023-01577-y
- : ہے
- : نہیں
- ][p
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15٪
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35٪
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95٪
- a
- ہمارے بارے میں
- اوپر
- مطابق
- جمع کو
- حاصل
- حاصل کیا
- حاصل
- حاصل کرنا
- حصول
- کے پار
- چالو
- فعال
- سرگرمی
- شامل کیا
- انہوں نے مزید کہا
- اس کے علاوہ
- انتظامیہ
- پر اثر انداز
- کے بعد
- بعد
- پھر
- مقصد
- AIR
- AL
- یلیکس
- یلگورتم
- تمام
- کی اجازت
- ساتھ
- الزائمر
- کے درمیان
- رقم
- امییلوڈ
- an
- تجزیہ کرتا ہے
- تجزیہ
- لنگر
- اور
- جانور
- جانوروں
- مائپنڈ
- کوئی بھی
- ایپلی کیشنز
- اطلاقی
- درخواست دینا
- مناسب
- کی منظوری دے دی
- ایکوا
- کیا
- رقبہ
- مضمون
- AS
- فرض کیا
- مفروضے
- At
- حکام
- خود کار طریقے سے
- دستیابی
- دستیاب
- اوسط
- نگرانی
- b
- بی بی بی
- بینڈوڈتھ
- بنیاد
- BE
- اس سے پہلے
- رویے
- کیا جا رہا ہے
- نیچے
- کے درمیان
- بلاک
- جسم
- ابلا ہوا
- دونوں
- دماغ
- بوجھ
- لیکن
- by
- کیجئے
- حساب
- بلا
- کیمرہ
- کینسر
- کیس
- مقدمات
- سیسیڈی
- سیل
- خلیات
- تبدیلیاں
- چارج
- کیمیائی
- صاف کرنا
- کلک کریں
- کلینکل
- کلوز
- کنڈلی
- مجموعہ
- امتزاج
- تجارتی
- کمیٹی
- موازنہ
- مقابلے میں
- موازنہ
- مکمل طور پر
- مکمل کرنا
- دھیان
- شرط
- حالات
- منعقد
- آپکا اعتماد
- منسلک
- مسلسل
- تسلسل
- مسلسل
- کنٹرول
- کنٹرول
- اس کے برعکس
- ٹھنڈی
- درست کیا
- اصلاحات
- اسی کے مطابق
- کونسل
- مل کر
- ڈھکنے
- تخلیق
- بنائی
- تخلیق
- تخلیقی
- معیار
- اہم
- CT سکین
- اپنی مرضی کے
- کٹ
- گہرا
- اعداد و شمار
- ڈیٹاسیٹس
- دن
- دن
- de
- کی وضاحت
- ترسیل
- منحصر ہے
- بیان کیا
- ڈیزائن
- مطلوبہ
- تفصیلات
- پتہ چلا
- کھوج
- اس بات کا تعین
- کا تعین
- کا تعین کرنے
- ترقی یافتہ
- آلہ
- تشخیص
- DID
- فرق
- اختلافات
- مختلف
- براڈ کاسٹننگ
- ڈیجیٹل
- پتلا
- سمت
- بیماری
- پکوان
- بازی
- تقسیم
- تقسیم
- تقسیم
- do
- کرتا
- کیا
- خوراک
- مواقع
- چھوڑ
- مدت
- متحرک
- حرکیات
- e
- ای اینڈ ٹی
- ہر ایک
- آسان
- یاد آتی ہے
- افادیت
- یا تو
- ایمبیڈڈ
- کو چالو کرنے کے
- کے قابل بناتا ہے
- اختتام پوائنٹ
- بہتر
- پوری
- انزیمیٹک
- لیس
- قائم
- قیام
- تخمینہ
- Ether (ETH)
- اخلاقیات
- یورپی
- اندازہ
- ہر کوئی
- امتحان
- حد سے تجاوز کر
- اس کے علاوہ
- امید
- توقع
- تجربہ
- تجرباتی
- تجربات
- وضاحت کی
- برآمد
- بیرونی
- سہولت
- عنصر
- خواتین
- میدان
- انجیر
- اعداد و شمار
- بھرے
- فلٹر
- فلٹر
- فائنل
- آخر
- پہلا
- فٹنگ
- مقرر
- فلیش
- پیچھے پیچھے
- کے بعد
- کے لئے
- فارم
- formaldehyde پر
- باضابطہ طور پر
- آگے
- چار
- سے
- منجمد
- تقریب
- مزید
- فرق
- ge
- GE صحت کا خیال
- جنرل
- پیدا
- پیدا
- دے
- اچھا
- میلان
- گرام
- سبز
- گروپ
- گروپ کا
- ترقی
- ہدایات
- ہے
- he
- صحت
- صحت کی دیکھ بھال
- صحت مند
- ہارٹ
- HTTPS
- ہانگ
- انسانی
- شبیہیں
- ID
- ایک جیسے
- if
- تصویر
- تصویری تجزیہ
- تصاویر
- امیجنگ
- فوری طور پر
- ڈوبی
- بہتر ہے
- in
- شامل
- شامل کرنا
- اضافہ
- انکیوبیٹڈ
- انکیوبیٹنگ
- انکیوبیشن
- آزاد
- انڈکس
- انڈکشن
- معلومات
- ابتدائی
- اندرونی
- کے اندر
- آلات
- ضم
- انٹرایکٹو
- دلچسپی
- اندرونی
- میں
- متعارف کرانے
- تکرار
- تکرار
- میں
- کے ڈی اے
- رکھتے ہوئے
- کٹ
- l2
- بڑے
- لیزر
- lasers
- پرت
- تہوں
- چھوڑ کر
- چھوڑ دیا
- لینس
- لینس
- زندگی
- روشنی
- لائن
- LINK
- منسلک
- لوڈ کر رہا ہے
- بوجھ
- مقامی
- بند
- میکرو
- میکرو
- برقرار رکھنے کے
- دیکھ بھال
- دستی طور پر
- ماسک
- ماسک
- کے ملاپ
- مواد
- مواد
- ریاضیاتی
- میٹرکس
- زیادہ سے زیادہ
- کا مطلب ہے کہ
- پیمائش
- ماپا
- پیمائش
- پیمائش
- میڈیا
- یاد داشت
- مرینو
- میتھانول
- طریقوں
- چوہوں
- خوردبین
- خوردبین
- منٹ
- کم سے کم
- معمولی
- مخلوط
- مرکب
- ML
- موبائل
- موڈ
- ماڈل
- ماڈل
- نظر ثانی کی
- ماڈیول
- آناخت
- نگرانی کی
- نگرانی
- تحریک
- ماؤس
- یمآرآئ
- MS
- MT
- ایک سے زیادہ
- نےنو
- فطرت، قدرت
- نیٹ ورک
- غیر جانبدار
- نئی
- نہیں
- شور
- عام
- مقصد
- مشاہدہ
- حاصل
- حاصل کی
- of
- پرانا
- on
- ایک
- کام
- آپریشنل
- آپریشنز
- اصلاح
- or
- شاک
- اصل
- پر
- رات بھر
- آکسفورڈ
- آکسیجن
- کاغذ.
- پیرامیٹرز
- پارک
- حصہ
- ذرہ
- PBS
- پت
- رسائی
- فی
- کارکردگی
- کارکردگی کا مظاہرہ
- پالتو جانوروں کی
- پیٹرری
- مراحل
- محور
- دانہ
- رکھ دیا
- ہوائی جہاز
- ہوائی جہاز
- پلاٹا
- افلاطون ڈیٹا انٹیلی جنس
- پلیٹو ڈیٹا
- پوائنٹ
- پوائنٹس
- پورٹ فولیو
- پوزیشن
- پوزیشن میں
- صحت سے متعلق
- تیار
- حال (-)
- پہلے
- طریقہ کار
- طریقہ کار
- پروسیسنگ
- آہستہ آہستہ
- پروٹوکول
- Qi
- مقدار کی
- ریڈیو
- بے ترتیب
- بے ترتیب
- چوہا
- شرح
- تناسب
- جواب دیں
- رد عمل
- ریڈر
- مناسب
- وجوہات
- موصول
- استقبالیہ
- درج
- بازیافت
- ریڈ
- کو کم
- کم
- کم
- حوالہ
- خطے
- رہے
- باقی
- ہٹا
- ہٹا دیا گیا
- کو ہٹانے کے
- اطلاع دی
- رپورٹ
- نمائندے
- ضرورت
- تحقیق
- مزاحم
- قرارداد
- بالترتیب
- جواب
- نتیجہ
- نتیجے
- نتائج کی نمائش
- میں روبوٹ
- کمرہ
- چلتا ہے
- s
- SA
- اسی
- بچت
- اسکین کرتا ہے
- بکھرے ہوئے
- ایس سی آئی
- سائنسی
- اسکرپٹ
- دوسری
- ثانوی
- سیکشن
- سیکشنز
- دیکھنا
- حصے
- انقطاع
- منتخب
- تسلسل
- خدمت کی
- ترتیبات
- کئی
- شیٹ
- دکھایا گیا
- اشارہ
- سگنل کی تقسیم
- اسی طرح
- بعد
- ایک
- چھ
- سائز
- سلائس
- چھوٹے
- So
- سوڈیم
- سافٹ ویئر کی
- حل
- حل
- مقامی
- استحکام
- ڈھیر لگانا
- Stacks
- شماریات
- سٹیلارس
- مراحل
- ذخیرہ
- پٹی
- طالب علم
- مطالعہ
- بعد میں
- بعد میں
- سویٹ
- سطح
- علامات
- ترکیب
- کے نظام
- T
- T1
- ٹیبل
- لینے
- ٹیک
- ٹیکنالوجی
- دوربین
- سانچے
- دس
- ٹیسٹ
- تجربہ
- کہ
- ۔
- ان
- ان
- تو
- نظریاتی
- علاج معالجہ
- تھراپی
- اس
- اچھی طرح سے
- ان
- تین
- تین جہتی
- کے ذریعے
- بھر میں
- وقت
- اوقات
- ٹشو
- کرنے کے لئے
- مل کر
- کے آلے
- اوزار
- کل
- کی طرف
- کی طرف
- تبدیل
- علاج
- رخ
- کی کوشش کر رہے
- ٹیومر
- دو
- قسم
- عام طور پر
- متاثر نہیں ہوا
- کے تحت
- جب تک
- صلی اللہ علیہ وسلم
- استعمال کیا جاتا ہے
- رکن کا
- کا استعمال کرتے ہوئے
- اقدار
- گاڑی
- بنام
- کی طرف سے
- ویڈیو
- ویڈیوز
- لنک
- مجازی
- تصور کرنا
- vivo
- حجم
- جلد
- مقدار
- واکر
- جادو کی چھڑی
- تھا
- دھلائی
- پانی
- we
- مہینے
- وزن
- ویلفیئر
- تھے
- وہیل
- جس
- جبکہ
- سفید
- کھڑکیاں
- ساتھ
- کے اندر
- بغیر
- X
- پیداوار
- اپج
- پیداوار
- زیفیرنیٹ
- زوم