16 січня 2024 р
(Новини Nanowerk) Ключова хімічна реакція, під час якої рух протонів між поверхнею електрода та електролітом викликає електричний струм, є критичним кроком у багатьох енергетичних технологіях, зокрема в паливних елементах і електролізерах, що використовуються для виробництва газоподібного водню. Вперше хіміки Массачусетського технологічного інституту детально накреслили, як відбувається перенесення електронів із протонним зв’язком на поверхні електрода. Їх результати можуть допомогти дослідникам розробити більш ефективні паливні елементи, батареї та інші енергетичні технології. «Наш прогрес у цій статті полягав у вивченні та розумінні природи того, як ці електрони та протони з’єднуються на поверхні, що має значення для каталітичних реакцій, важливих у контексті пристроїв перетворення енергії або каталітичних реакцій», — говорить Йогеш Сурендранат, професор хімії та хімічної інженерії Массачусетського технологічного інституту та старший автор дослідження. Серед своїх висновків дослідники змогли точно простежити, як зміни рН розчину електроліту, що оточує електрод, впливають на швидкість руху протонів і потік електронів всередині електрода. Аспірант Массачусетського технологічного інституту Ной Льюїс є провідним автором статті, яка сьогодні опублікована в Хімія природи («Механістична структура на молекулярному рівні для міжфазної кінетики переносу електронів, пов’язаних із протонами»). Раян Бісбі, колишній постдоктор Массачусетського технологічного інституту; Карл Вестендорф, аспірант MIT; і Олександр Судаков, науковий співробітник Єльського університету, також є авторами статті.
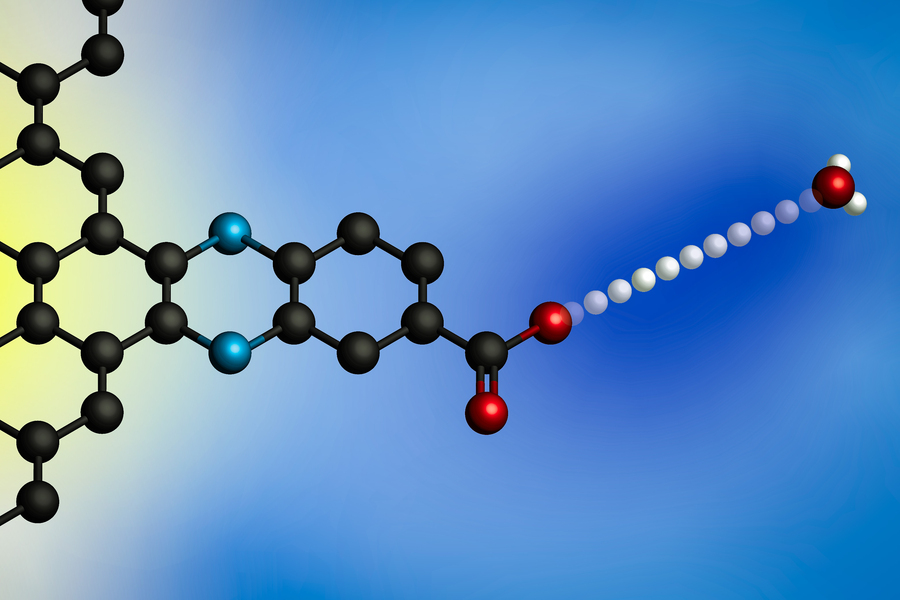 Додавання електричного потенціалу змушує протон переходити від іона гідроній (праворуч) до поверхні електрода. Використовуючи електроди з молекулярно визначеними місцями зв’язування протонів, дослідники Массачусетського технологічного інституту розробили загальну модель для цих міжфазних реакцій переносу електронів із зв’язаними протонами. (Зображення: надано дослідниками)
Додавання електричного потенціалу змушує протон переходити від іона гідроній (праворуч) до поверхні електрода. Використовуючи електроди з молекулярно визначеними місцями зв’язування протонів, дослідники Массачусетського технологічного інституту розробили загальну модель для цих міжфазних реакцій переносу електронів із зв’язаними протонами. (Зображення: надано дослідниками)
 Додавання електричного потенціалу змушує протон переходити від іона гідроній (праворуч) до поверхні електрода. Використовуючи електроди з молекулярно визначеними місцями зв’язування протонів, дослідники Массачусетського технологічного інституту розробили загальну модель для цих міжфазних реакцій переносу електронів із зв’язаними протонами. (Зображення: надано дослідниками)
Додавання електричного потенціалу змушує протон переходити від іона гідроній (праворуч) до поверхні електрода. Використовуючи електроди з молекулярно визначеними місцями зв’язування протонів, дослідники Массачусетського технологічного інституту розробили загальну модель для цих міжфазних реакцій переносу електронів із зв’язаними протонами. (Зображення: надано дослідниками)
Прохідні протони
Перенесення електрона з протонним зв’язком відбувається, коли молекула, часто вода або кислота, передає протон іншій молекулі або поверхні електрода, що стимулює акцептор протона також поглинати електрон. Цей тип реакції використовувався для багатьох енергетичних застосувань. «Ці протонно-зв’язані реакції переносу електронів є всюдисущими. Вони часто є ключовими етапами в каталітичних механізмах і особливо важливі для процесів перетворення енергії, таких як генерація водню або каталіз паливних елементів», — каже Сурендранат. У електролізері, що генерує водень, цей підхід використовується для видалення протонів із води та додавання електронів до протонів для утворення газоподібного водню. У паливному елементі електрика виробляється, коли протони й електрони видаляються з водню та додаються до кисню з утворенням води. Перенесення електронів із зв’язком протонів є поширеним у багатьох інших типах хімічних реакцій, наприклад, відновлення вуглекислого газу (перетворення вуглекислого газу в хімічне паливо шляхом додавання електронів і протонів). Вчені багато чого дізналися про те, як відбуваються ці реакції, коли акцепторами протонів є молекули, оскільки вони можуть точно контролювати структуру кожної молекули та спостерігати, як електрони та протони проходять між ними. Однак, коли пов’язаний з протонами перенесення електрона відбувається на поверхні електрода, процес набагато складніше вивчити, оскільки поверхні електрода зазвичай дуже гетерогенні, з багатьма різними ділянками, з якими потенційно може зв’язуватися протон. Щоб подолати цю перешкоду, команда Массачусетського технологічного інституту розробила спосіб проектування поверхонь електродів, який дає їм набагато точніший контроль над складом поверхні електродів. Їх електроди складаються з листів графену з органічними сполуками, що містять кільця, прикріпленими до поверхні. На кінці кожної з цих органічних молекул знаходиться негативно заряджений іон кисню, який може приймати протони з навколишнього розчину, що змушує електрон витікати з контуру на поверхню графіту. «Ми можемо створити електрод, який не буде складатися з великого розмаїття сайтів, а є однорідним масивом одного типу дуже чітко визначених сайтів, кожен з яких може зв’язувати протон з однаковою спорідненістю», — каже Сурендранат. «Оскільки ми маємо ці дуже чітко визначені ділянки, це дозволило нам справді розгадати кінетику цих процесів». Використовуючи цю систему, дослідники змогли виміряти потік електричного струму до електродів, що дозволило їм розрахувати швидкість передачі протона іону кисню на поверхні в рівноважному стані — стані, коли швидкості віддачі протонів поверхні і перенесення протона назад у розчин з поверхні однакові. Вони виявили, що pH навколишнього розчину має значний вплив на цю швидкість: найвищі показники спостерігаються на крайніх кінцях шкали pH — pH 0, найбільш кислий, і pH 14, найбільш основний. Щоб пояснити ці результати, дослідники розробили модель, засновану на двох можливих реакціях, які можуть відбуватися на електроді. 3O+), які знаходяться у високій концентрації в сильнокислих розчинах, доставляють протони до поверхневих іонів кисню, утворюючи воду. У другому випадку вода доставляє протони до поверхневих іонів кисню, утворюючи гідроксид-іони (OH-), які знаходяться у високій концентрації в сильно основних розчинах. Однак швидкість при рН 0 приблизно в чотири рази більша, ніж швидкість при рН 14, частково через те, що гідроній віддає протони швидше, ніж вода.Реакція на перегляд
Дослідники також виявили, на свій подив, що обидві реакції мають однакові швидкості не при нейтральному рН 7, де концентрації гідроній і гідроксиду рівні, а при рН 10, де концентрація іонів гідроксиду в 1 мільйон разів перевищує концентрацію гідроній. Модель припускає, що це відбувається тому, що пряма реакція, що включає віддачу протонів від гідроній або води, робить більший внесок у загальну швидкість, ніж зворотна реакція, що включає видалення протонів водою або гідроксидом. Існуючі моделі того, як ці реакції відбуваються на поверхнях електродів, припускають, що пряма і зворотна реакції однаково впливають на загальну швидкість, тому нові висновки свідчать про те, що ці моделі, можливо, потрібно буде переглянути, кажуть дослідники. «Це стандартне припущення, що пряма і зворотна реакції однаково впливають на швидкість реакції», — каже Сурендранат. «Наше відкриття дійсно відкриває очі, тому що це означає, що припущення, яке люди використовують для аналізу всього, від каталізу паливних елементів до виділення водню, може бути тим, що нам потрібно переглянути». Зараз дослідники використовують свою експериментальну установку, щоб дослідити, як додавання різних типів іонів до розчину електроліту, що оточує електрод, може прискорити або сповільнити швидкість потоку електронів, пов’язаних з протонами. «Завдяки нашій системі ми знаємо, що наші сайти постійні й не впливають одне на одного, тож ми можемо прочитати, як зміни в розчині впливають на реакцію на поверхні», — каже Льюїс.- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://www.nanowerk.com/news2/green/newsid=64425.php
- : має
- :є
- : ні
- :де
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Здатний
- МЕНЮ
- Прийняти
- додавати
- доданий
- додати
- просування
- впливати
- зачіпає
- Олександр
- дозволено
- Також
- серед
- an
- аналізувати
- та
- Інший
- з'являється
- застосування
- Застосування
- підхід
- ЕСТЬ
- масив
- AS
- припустити
- припущення
- At
- автор
- authors
- назад
- заснований
- основний
- батареї
- BE
- оскільки
- було
- між
- пов'язувати
- обов'язковий
- але
- by
- обчислювати
- CAN
- вуглець
- вуглекислий газ
- Причини
- осередок
- Клітини
- Центр
- зміна
- Зміни
- стягується
- хімічний
- хімія
- Хіміки
- загальний
- склад
- концентрація
- постійна
- контекст
- сприяти
- сприяє
- контроль
- Перетворення
- може
- Пара
- створювати
- критичний
- Поточний
- Дата
- угода
- дефолт
- певний
- доставляти
- постачає
- дизайн
- деталь
- розвиненою
- прилади
- різний
- важкий
- відкритий
- різноманітність
- do
- Ні
- справи
- пожертвування
- вниз
- диски
- кожен
- ефект
- ефективний
- електричний
- електрика
- електроліт
- електрони
- кінець
- закінчується
- енергія
- Машинобудування
- рівним
- однаково
- Рівновага
- Ефір (ETH)
- все
- еволюція
- точно
- приклад
- існуючий
- експериментальний
- Пояснювати
- екстремальний
- швидше
- виявлення
- результати
- Перший
- перший раз
- потік
- для
- форма
- Колишній
- Вперед
- знайдений
- чотири
- Рамки
- від
- Паливо
- паливні елементи
- палива
- ГАЗ
- Загальне
- генерується
- породжує
- покоління
- дає
- випускник
- Графен
- великий
- траплятися
- запряжений
- Мати
- Серце
- допомога
- Високий
- найвищий
- Як
- Однак
- HTTPS
- Гідрування
- зображення
- важливо
- in
- У тому числі
- в
- за участю
- IT
- JPG
- Карл
- ключ
- Дитина
- Знати
- вести
- вчений
- Льюїс
- багато
- Може..
- засоби
- вимір
- механізми
- Середній
- мільйона
- MIT
- Випускник MIT
- модель
- Моделі
- молекули
- більше
- більш ефективний
- найбільш
- рух
- руху
- багато
- природа
- Необхідність
- негативно
- Нейтральний
- Нові
- Ної
- зараз
- спостерігати
- перешкода
- відбуваються
- сталося
- of
- часто
- on
- or
- органічний
- Інше
- наші
- з
- над
- загальний
- Подолати
- Кисень
- Папір
- частина
- особливо
- проходити
- Люди
- plato
- Інформація про дані Платона
- PlatoData
- це можливо
- потенціал
- потенційно
- необхідність
- точно
- процес
- процеси
- виробляти
- Професор
- протони
- ставка
- ставки
- реакція
- реакції
- Читати
- насправді
- скорочення
- доречний
- видалення
- видаляти
- Вилучено
- Поновлюваний
- відновлювальна енергія
- дослідження
- Дослідники
- результати
- Виявляє
- зворотний
- право
- Райан
- s
- то ж
- say
- говорить
- шкала
- вчений
- Вчені
- другий
- старший
- установка
- значний
- один
- сайт
- сайти
- сповільнювати
- So
- рішення
- Рішення
- що в сім'ї щось
- швидкість
- стан
- Крок
- заходи
- стимулює
- сильно
- структура
- студент
- Вивчення
- вивчення
- такі
- пропонувати
- Запропонує
- поверхню
- сюрприз
- Навколо
- система
- Приймати
- команда
- Технології
- ніж
- Що
- Команда
- Держава
- їх
- Їх
- Ці
- вони
- це
- ті
- час
- times
- до
- сьогодні
- простежувати
- переклад
- переклади
- два
- тип
- Типи
- повсюдний
- розуміння
- університет
- розгадати
- us
- використовуваний
- використання
- зазвичай
- дуже
- було
- вода
- шлях..
- we
- добре визначений
- були
- Що
- коли
- який
- широкий
- з
- в
- зефірнет