15 січня 2024 року NMPA опублікував остаточну версію документа «Керівництво щодо розробки та статистичного аналізу в реальному світі медичного обладнання». Чернева версія була опублікована 28 вересня 2023 року.
Значення Керівництва
Рекомендації допоможуть закордонним виробникам глибше вивчити пілотну програму Hainan Real-world Data.
Пілотна зона Хайнань Боао дозволяє використовувати в Китаї несхвалені за кордоном медичні пристрої, IVD, ліки зі статусом клінічної невідкладності. Під час комерціалізації та продажу своєї продукції виробники можуть збирати RWD через RWS у Хайнані як місцеві клінічні докази в Китаї для підтвердження свого національного схвалення реєстрації NMPA. Спеціальна програма може скоротити їхній вихід на китайський ринок до 4 місяців.
Уряд Хайнань випустив "Положення про адміністрування імпортних ліків та медичних приладів термінового використання в пілотній зоні міжнародного медичного туризму Боао Леченг порту вільної торгівлі Хайнань” 28 березня 2023 р. У документі сказано, що він НЕ потребує місцевих типових випробувань або значного тягаря доказів, як національне схвалення.
Основні моменти керівництва
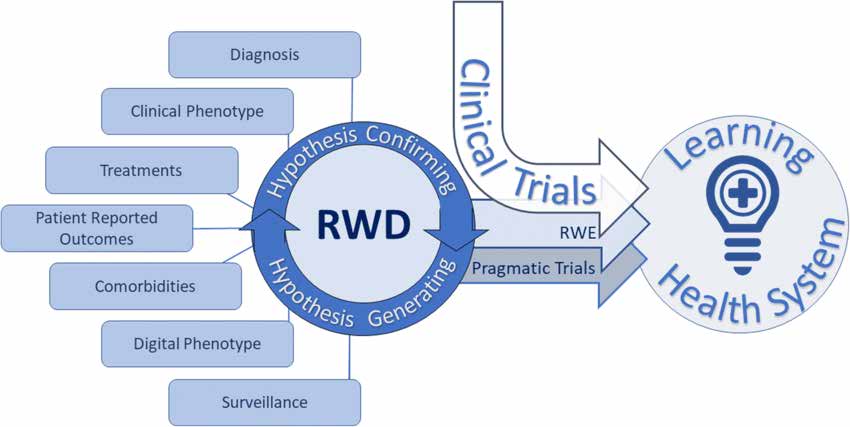
Документ про дизайн дослідження та статистичний аналіз описує різні типи реальних досліджень таким чином:
Прагматичні рандомізовані контрольовані дослідження (pRCTs) призначені для оцінки результатів лікування в реальних медичних закладах. Вони використовують рандомізацію та контрольні групи для оцінки ефективності втручання. PRCT надають високоякісні реальні докази та підходять для різних груп пацієнтів і клінічних сценаріїв.
Спостережні дослідження в реальному світі включають різні дизайни досліджень:
- Описові плани дослідження описувати характеристики пацієнта або стан здоров'я без висновку про причинно-наслідковий зв'язок.
- Когортні проекти відстежувати результати в різних групах пацієнтів на основі використання пристрою, з проспективними та ретроспективними варіантами.
- Випадок-контроль і похідні проекти порівнювати пацієнтів із використанням пристрою та без нього та включати вкладені дослідження типу «випадок-контроль» і «випадок-когорта».
- Дані реального світу як зовнішні засоби керування передбачають використання даних реального світу як контрольної групи, хоча детальні вказівки відсутні.
У документі викладено міркування щодо розробки протоколів реальних досліджень:
- Передумови та цілі: Визначте передумови дослідження, цілі та питання безпеки та ефективності на основі наявних даних.
- Техніко-економічна оцінка: Оцініть доцільність проведення досліджень у реальному світі, враховуючи доступність даних, якість і змінні, що змішують.
- Виберіть Відповідний дизайн дослідження: виберіть дизайн на основі цілей, експериментальних чи спостережних.
- Блок-схема дослідження: Створіть блок-схему з детальним описом процесу дослідження, включаючи відбір пацієнтів, втручання та обстеження.
- Визначте досліджувану популяцію: Чітко визначте критерії включення та виключення для досліджуваної популяції.
- Експозиція пристрою: Оцініть, як пацієнти піддаються впливу пристрою, враховуючи можливі упередження.
- Контрольна група: Визначте відповідні контрольні групи для обсерваційних досліджень, щоб збалансувати змішуючі змінні.
- Результат Заходи: Визначити вимірювання результатів, включаючи їхню мету, визначення та методи вимірювання.
- Збір даних: розробити форми збору даних і словники, вказавши джерела даних, якісну інформацію та методи зв’язку.
- Коригування змінної, що вводить в омануs: Визначте змінні, що змішують, і включіть/виключіть їх із зазначенням причин.
- Час спостереження: Визначте час спостереження за пацієнтом, щоб адекватно відповісти на запитання дослідження.
- Розмір вибірки та розрахунок потужності: розрахувати розмір вибірки та статистичну потужність, враховуючи різні фактори.
Він також підкреслює важливість контролю якості:
- Якість даних: оцінка якості даних з точки зору репрезентативності, повноти, точності тощо.
- Ризик упередження: Опишіть заходи контролю ризиків упередженості на різних етапах, включаючи відбір, інформацію та змішування.
- Оцінка упередженості: Розпізнавати різні типи упереджень і оцінювати їх напрямок і величину.
- Етичний огляд: Переконайтеся, що етичні перевірки та інформована згода відповідають нормам.
Порівняння двох версій
Порівняно з чорновою версією, у фінальному документі в розділі «Статистичний аналіз» згадується «Визначення змінних, що перешкоджають зміні, які потребують модифікації».
У нерандомізованих планах досліджень у реальному світі виявлення змішуючих змінних має вирішальне значення для контролю упередженості. Для їх ідентифікації використовуються три критерії: змінна має причинно-наслідковий зв’язок із результатом, пов’язана зі змінною групування (експозиція) і не є проміжною змінною в причинно-наслідковому шляху. Рекомендований підхід передбачає раціональний процес вибору змінної, заснований на професійних знаннях і клінічному досвіді, у співпраці з клінічними та статистичними експертами. Для невизначених змінних пропонується аналіз чутливості із зазначенням причин і підтверджуючими даними для включення/виключення. Рекомендується консервативний підхід до вибору змінних, уникаючи непов’язаних змінних і враховуючи такі проблеми, як мультиколінеарність і ефекти взаємодії, візуалізовані за допомогою спрямованих ациклічних графіків (DAG).
Щоб отримати копію настанови англійською мовою, будь ласка, надішліть електронну пошту info@ChinaMedDvice.com. Ми беремо номінальну плату за переклад.
Перегляд останні новини у програмі Hainan Real World Data.
Перегляд настанова щодо спілкування робота з контролюючими органами.
Переглянути наш запис вебінару про політику Хайнань.
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://chinameddevice.com/real-world-study-nmpa/
- : має
- :є
- : ні
- 15%
- 2023
- 2024
- 28
- a
- доступ
- точність
- ациклічні
- адекватно
- адміністрація
- порадив
- дозволяє
- Також
- an
- аналіз
- та
- відповідь
- підхід
- відповідний
- твердження
- ЕСТЬ
- AS
- оцінити
- асоційований
- At
- Влада
- наявність
- уникає
- фон
- Balance
- заснований
- BE
- зміщення
- упередження
- тягар
- обчислювати
- CAN
- характеристика
- заряд
- Китай
- Вибирати
- очевидно
- Клінічний
- співробітництво
- збирати
- збір
- COM
- дотримуватися
- Умови
- Проведення
- згода
- консервативний
- міркування
- беручи до уваги
- контроль
- контроль
- управління
- управління
- створювати
- Критерії
- вирішальне значення
- дані
- якість даних
- визначати
- визначення
- Отриманий
- описувати
- описує
- дизайн
- призначений
- проектування
- конструкцій
- докладно
- Деталізація
- Визначати
- розвивати
- пристрій
- прилади
- різний
- спрямований
- напрям
- Різне
- документ
- робить
- проект
- Наркотики
- ефективність
- ефекти
- підкреслює
- англійська
- забезпечувати
- етичний
- оцінювати
- докази
- існуючий
- досвід
- експериментальний
- experts
- дослідити
- піддаватися
- експонування
- зовнішній
- фасилітувати
- фактори
- здійсненність
- Інформація про оплату
- остаточний
- завершено
- після
- для
- форми
- Безкоштовна
- далі
- Уряд
- графіки
- Group
- Групи
- керівні вказівки
- здоров'я
- охорона здоров'я
- високоякісний
- Як
- HTTPS
- ідентифікувати
- ідентифікує
- значення
- in
- включати
- includes
- У тому числі
- включення
- інформація
- повідомив
- взаємодія
- Проміжний
- Міжнародне покриття
- втручання
- втручання
- включає в себе
- питання
- IT
- січня
- JPG
- знання
- не вистачає
- лідер
- як
- місцевий
- Виробники
- березня
- ринок
- вимір
- заходи
- медичний
- медичний прилад
- медичні прилади
- згадує
- методика
- може бути
- місяців
- більше
- National
- Необхідність
- цілей
- спостереження
- спостережливість
- of
- on
- Опції
- or
- наші
- Результат
- Результати
- контури
- за кордоном
- шлях
- пацієнт
- pacientes
- пілот
- plato
- Інформація про дані Платона
- PlatoData
- будь ласка
- Політика
- населення
- популяції
- потенціал
- влада
- процес
- Продукти
- професійний
- програма
- доказ
- передбачуваний
- протоколи
- забезпечувати
- забезпечення
- опублікований
- мета
- якість
- питань
- Рандомізований
- Раціональний
- реальний
- Реальний світ
- Причини
- рекомендований
- Реєстрація
- правила
- регуляторні
- відносини
- випущений
- вимагати
- дослідження
- Відгуки
- ризики
- Безпека
- говорить
- сценарії
- розділ
- вибір
- Продаж
- Чутливість
- Вересень
- налаштування
- значний
- Розмір
- Джерела
- спеціальний
- етапи
- статистичний
- Статус
- Дослідження
- Вивчення
- підходящий
- підтримка
- Підтримуючий
- terms
- Тестування
- Що
- Команда
- їх
- Їх
- вони
- хоча?
- три
- через
- times
- до
- туризм
- трек
- торгувати
- Переклад
- лікування
- випробування
- два
- тип
- Типи
- Невизначений
- терміновість
- терміново
- використання
- використовуваний
- використання
- змінна
- різний
- версія
- було
- we
- Чи
- в той час як
- волі
- з
- без
- робочий
- світ
- зефірнет