Лікування хворих на рак просторово модульованими променями випромінювання може знищити пухлини, зводячи до мінімуму пошкодження сусідніх органів і здорових тканин. Це ідея протонної мініпроменевої променевої терапії (pMBRT), нової методики лікування, яка використовує масив субміліметрових пучків випромінювання для доставки терапевтичної дози.
Міні-промені включають чергування піків високих доз і спадів низьких доз, схема, яка менш шкідлива для здорових тканин на невеликих глибинах. На більших глибинах ці промені поступово розширюються, створюючи однорідний розподіл дози в цільовому об’ємі. Дослідження на дрібних тваринах показали, що pMBRT може різко зменшити токсичність нормальної тканини, С еквівалентний або кращий контроль пухлинипорівняно зі звичайною протонною терапією.
«Протонова мініпроменева променева терапія вже показала значний приріст терапевтичного індексу в доклінічних дослідженнях», — каже Рамон Ортіс від Інститут Кюрі. «Ці багатообіцяючі результати спонукають до впровадження цієї методики в клінічну область». З цією метою Ортіс (зараз в Каліфорнійському університеті в Сан-Франциско) та його колеги з Інституту Кюрі оцінили переваги pMBRT для лікування метастазів раку, повідомили про свої висновки в Медична фізика.
Симуляція сценаріїв pMBRT
Метастатична хвороба є причиною до 90% смертей, пов’язаних із раком. Метастази зазвичай лікують за допомогою методів стереотаксичної променевої терапії (SRT), але доза, необхідна для місцевого контролю, часто обмежена ризиком токсичності для сусідніх нормальних тканин. Для метастазів у мозок, наприклад, радіаційно-індукований некроз мозку повідомляється у половини пацієнтів, які отримували СЗТ.
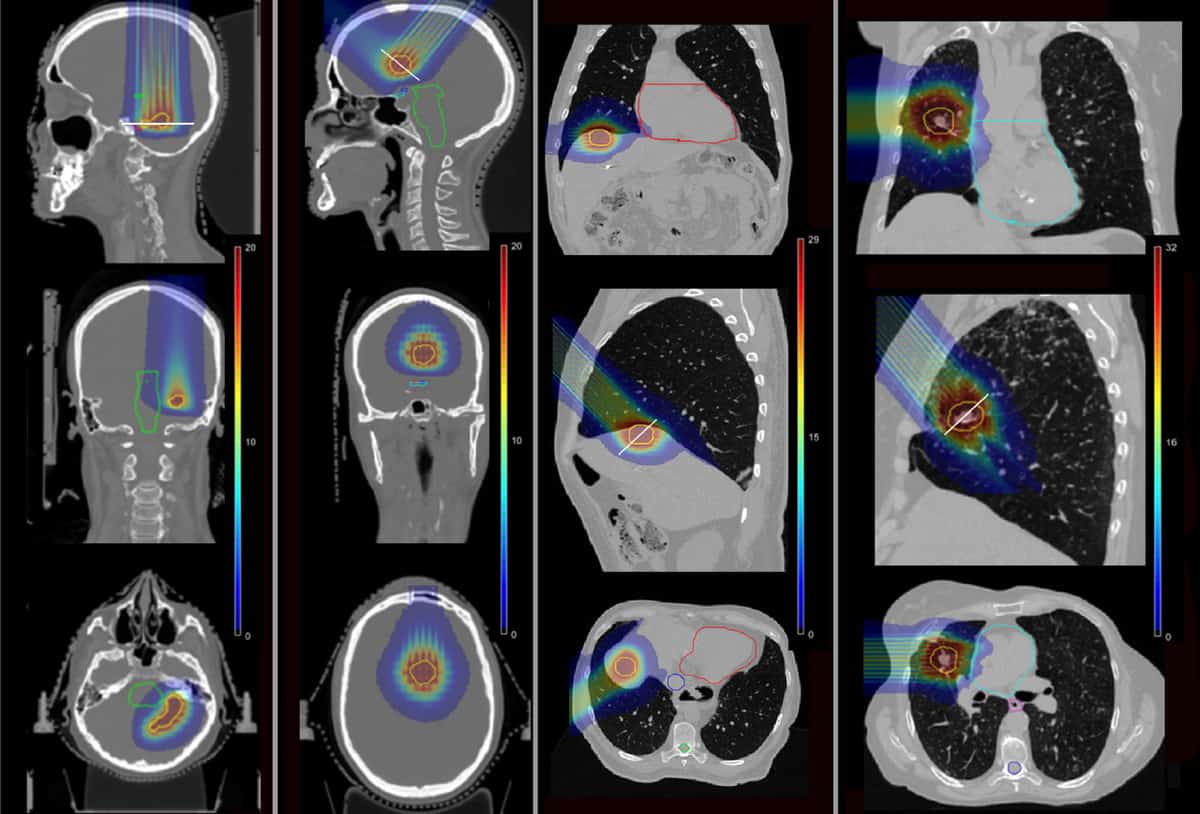
Щоб визначити, чи може pMBRT зменшити такі ускладнення, команда використовувала моделювання Монте-Карло для обчислення розподілу доз для чотирьох пацієнтів, які раніше отримували СЗТ в Інституті Кюрі. Пацієнтів лікували від метастатичних уражень скроневої частки головного мозку, лобової частки, печінки та легенів.
Дослідники змоделювали однофракційні плани pMBRT, використовуючи одне або два поля лікування для доставки такої ж біологічної еквівалентної дози (BED) до мішені пухлини, як це передбачено для SRT. Вони змоделювали латунний коліматор міні-променів, що містить щілини 400 мкм × 5.6 см на різних відстанях між центрами, щоб створити як вузькі, так і більш широкі міні-промені. Потім вони обчислили розподіл дози для чотирьох випадків пацієнтів для pMBRT, SRT і звичайної протонної терапії.
У вузьких планах pMBRT, які створюють рівномірний розподіл дози в цільовому об’ємі, охоплення пухлини було подібним або трохи кращим, ніж у планах SRT. Плани з використанням пучків pMBRT з більшим відстанню, які забезпечують квазірівномірний розподіл дози до мішені, мали нижче охоплення пухлини.
Важливо, що pMBRT суттєво знизив дозу для критичних структур порівняно з SRT. У першому випадку головного мозку pMBRT зменшив середній BED до органів ризику (OARs) від 44% (правий слуховий нерв) до 100% (лівий слуховий нерв). Під час другого лікування головного мозку pMBRT повністю позбавив OARs, включаючи зоровий тракт, стовбур мозку та хіазму.
У випадку печінки середній BED до печінки та ребер був зменшений на 25% та 75% відповідно, уникаючи опромінення верхньої порожнистої вени. А для випадку легенів дозу ОАР було зменшено на 11% (ребра) до 100% (легенева артерія та бронхи). Середнє BED до OARs було в основному подібним між pMBRT і традиційною протонною терапією.
Дослідники також досліджували можливі побічні ефекти pMBRT на нормальні тканини. Для двох випадків метастазів у мозок, наприклад, вони обчислили дозу, доставлену до здорової тканини мозку. Вони розглянули межі дози для стандартного фракціонованого опромінення, в якому нормалізована загальна доза при 2 Гр фракцій (NTD2.0) 72 Гр призводить до 5% ймовірності радіонекрозу протягом п'яти років.
Для всіх планів pMBRT максимальна долина NTD2.0 до здорового мозку (61 Гр (RBE) для скроневої частки та 47 Гр (RBE) для лобової частки) залишався нижчим цього порогу толерантності до дози, на відміну від традиційної протонної терапії. Для пацієнтів із метастазами в легенях і печінці середні дози в тканини легенів і печінки в планах pMBRT також були значно нижчими від максимально допустимих середніх доз.
Клінічні переваги
Лікування pMBRT, яке розглядалося в цьому дослідженні, проводилося за допомогою лише одного або двох масивів мініпроменів. Використання меншої кількості полів, ніж при лікуванні SRT (три-чотири дуги), потребує менше репозиції пацієнта, скорочення часу обробки фракції, а також зменшення об’єму нормальної тканини, яка піддається впливу низьких доз. Крім того, доставка pMBRT в одній фракції лікування значно скорочує загальний час лікування порівняно з планами SRT, які використовували від трьох до п’яти фракцій.

Мініпроменева терапія: від фотонів до заряджених частинок
Дослідники зазначають, що плани pMBRT, оцінені в цій роботі, можуть бути доставлені клінічно за допомогою налаштування, яке вже реалізовано в Центрі протонної терапії Орсе для доклінічних випробувань, з контрольованим рухом мішені та органів під час лікування, як у SRT та протонній терапії.
Ортіс розповідає Світ фізики що Інститут Кюрі зараз обговорює можливість клінічних випробувань I/II фази. «Це дозволить оцінити нейротоксичність і рівень контролю пухлини при лікуванні рецидивуючої мультиформної гліобластоми протонними міні-променями», — пояснює він. «Це дослідження має на меті зробити внесок у підготовку цих клінічних досліджень».
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- Платоблокчейн. Web3 Metaverse Intelligence. Розширені знання. Доступ тут.
- джерело: https://physicsworld.com/a/proton-minibeams-could-improve-treatment-of-cancer-metastases/
- 10
- a
- Рахунки
- доповнення
- несприятливий
- Цілі
- ВСІ
- вже
- та
- тварини
- масив
- уникає
- за
- нижче
- Переваги
- Краще
- між
- Brain
- латунь
- рак
- випадок
- випадків
- Центр
- стягується
- Клінічний
- клінічні випробування
- колеги
- Колони
- зазвичай
- порівняний
- повністю
- обчислення
- вважається
- контрастність
- сприяти
- контроль
- контроль
- звичайний
- може
- охоплення
- створювати
- критичний
- смерть
- доставляти
- поставляється
- надання
- Глибини
- знищити
- Визначати
- обговорення
- Захворювання
- розподіл
- Розподілу
- домен
- різко
- під час
- ефекти
- з'являються
- заохочувати
- Еквівалент
- оцінювати
- оцінюється
- приклад
- Пояснює
- піддаватися
- Поля
- Перший
- фракція
- Франциско
- від
- Отримувати
- поступово
- великий
- Половина
- шкідливий
- здоровий
- HTTPS
- ідея
- зображення
- реалізовані
- удосконалювати
- in
- В інших
- У тому числі
- індекс
- інформація
- Дослідження
- питання
- тільки один
- Веде за собою
- обмеженою
- рамки
- Печінка
- місцевий
- низький
- макс-ширина
- максимальний
- мінімізація
- рух
- природа
- нормальний
- ONE
- відкрити
- Інше
- викладені
- пацієнт
- pacientes
- Викрійки
- фаза
- Фотони
- планування
- плани
- plato
- Інформація про дані Платона
- PlatoData
- точка
- можливість
- це можливо
- раніше
- ймовірність
- перспективний
- Випромінювання
- Променева терапія
- ставки
- отримано
- зменшити
- Знижений
- знижує
- зниження
- залишився
- чудовий
- Повідомляється
- вимагається
- Вимагається
- Дослідники
- відповідно
- результати
- Risk
- то ж
- Сан -
- Сан Франциско
- говорить
- другий
- дрібний
- показаний
- істотно
- аналогічний
- невеликий
- standard
- Дослідження
- Вивчення
- такі
- чудовий
- Мета
- команда
- методи
- розповідає
- Команда
- їх
- Лікувальний
- терапія
- три
- поріг
- слайдами
- час
- тканини
- до
- терпимість
- Усього:
- Переклад
- лікування
- лікування
- випробування
- правда
- використання
- Долина
- різний
- обсяг
- Обсяги
- Чи
- який
- в той час як
- ВООЗ
- в
- Work
- б
- років
- зефірнет