Підготовка матеріалу та характеристика
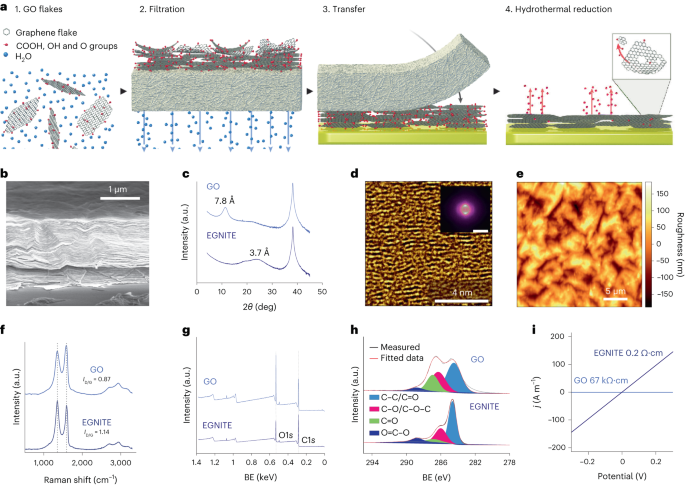
Водний розчин GO розбавляли в деіонізованій воді, щоб отримати 0.15 мг мл-1 розчин і фільтрують у вакуумі через нітроцелюлозну мембрану з порами 0.025 мкм, утворюючи тонку плівку GO. Потім тонку плівку переносили на цільову підкладку за допомогою мокрого перенесення в деіонізованій воді та подальшого термічного відпалу при 100 °C протягом 2 хв. Пакет плівка–підкладка GO був гідротермічно відновлений при 134 °C у стандартному автоклаві протягом 3 годин з утворенням EGNITE. Основним субстратом для всіх досліджень характеристики EGNITE був квадрат (1 × 1 см).2) Si/SiO2 (400 мкм/1 мкм).
XPS
XPS вимірювання проводили за допомогою аналізатора Phoibos 150 (SPECS) в умовах надвисокого вакууму (базовий тиск, 5 × 10-10 мбар) з монохроматичним джерелом рентгенівського випромінювання Al Kα (1,486.74 eV). Оглядові спектри були отримані з енергією проходження 50 eV і розміром кроку 1 eV, а спектри високої роздільної здатності були отримані з енергією проходження 20 eV і розміром кроку 0.05 eV. Загальна роздільна здатність у цих останніх умовах становить 0.58 еВ, як визначено вимірюванням повної ширини на половині максимуму Ag 3d5/2 піку напиленого срібла. XPS-аналіз показує значне зниження після гідротермічної обробки піку C–O (пов’язаного з епоксидними групами), але невеликий внесок C–OH, C=O та C(O)OH через гідроксили, карбоніли та карбоксили, які залишаються після скорочення. Деконволюція O1s пік підтверджує таку поведінку. Основний внесок у С1s сигнал після гідротермального відновлення, однак, надходить з sp2 гібридизовані C–C орбіталі34,57.
Рентгенівська дифракція
Рентгенівські дифракційні вимірювання (θ-2θ сканування) проводили на дифрактометрі Materials Research (Malvern PANalytical). Цей дифрактометр має горизонталь ω-2θ гоніометр (радіус 320 мм) у геометрії чотирьох кіл і працював із керамічною рентгенівською трубкою з анодом Cu Kα (λ = 1.540598 Å). Використовується детектор Pixcel, який є швидким рентгенівським детектором на основі технології Medipix2.
Раманова спектроскопія
Вимірювання раманівської спектроскопії проводили за допомогою спектрографа Witec, оснащеного лінією збудження лазера 488 нм. Для вимірювань спектри комбінаційного розсіювання були отримані з використанням об’єктива 50 × і решітки 600 штрихів на нм; потужність лазера підтримувалася нижче 1.5 мВт, щоб уникнути нагрівання зразка.
TEM
Ламель сфокусованого іонного пучка була підготовлена за допомогою Helios NanoLab DualBeam (LMA-INA) для дослідження поперечного перерізу зразка EGNITE. Структурний аналіз проводили за допомогою ТЕМ з використанням мікроскопа Tecnai F20, що працює при 200 кВ, включаючи методи HRTEM і висококутового кільцевого темного поля STEM. Експеримент STEM-EELS проводився в мікроскопі Tecnai F20, який працював при 200 КеВ, з апертурою 5 мм, довжиною камери 30 мм, кутом конвергенції 12.7 мрад і кутом збору 87.6 мрад. Оскільки ми використовували 0.5 eV на піксель і 250 eV як початкову енергію в отриманні втрат в серцевині, ми не отримали Si K-краю, очікуваного на 1,839 eV, Pt M-краю на 2,122 eV і Au M-краю на 2,206 еВ. Відносний атомний склад C–O був отриманий шляхом зосередження нашої уваги на зменшеному шарі GO та припущення, що проаналізовані краї (C та O у нашому випадку) становлять 100%. Це припущення справедливе в нашому випадку, як підтверджено в Додаткова інформація карти. Диференціальний переріз енергії було обчислено за допомогою моделі Хартрі–Слейтера, а фон – за моделлю низької потужності.
Електропровідність
Вимірювання електропровідності проводили з використанням сорсометра Keithley 2400 у двоточковій конфігурації. Виміряні зразки складалися з плівок EGNITE розміром 1 × 1 см2 поверх SiO2 субстрат.
Аналіз даних
Дані рентгенівської дифракції, комбінаційного розсіювання та XPS аналізували за допомогою пакетів Python 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Відстань між площинами розраховували з рентгенівських дифракційних вимірювань згідно із законом Снелла. Після того, як дані були переміщені в просторову область, максимум піків був встановлений. Відповідна відстань давала середнє значення відстані між площинами. Відхилення від цих середніх значень були розраховані за повною шириною на половині максимуму лоренціанської підгонки піків у просторовій області. Вимірювання XPS і раманівської спектроскопії були проаналізовані шляхом підгонки згортки піків на очікуваних місцях для відповідних особливостей. Значення провідності GO та EGNITE були отримані шляхом підгонки I-V криві, виміряні при вимірюванні електропровідності за законом Ома. Дані є n = 1 для кожного вимірювання.
Виготовлення гнучкого масиву
Виготовлення пристроїв показано на додатковому рис. 4. Пристрої були виготовлені на 4 дюймовому Si/SiO2 (400 мкм/1 мкм) пластини. Спочатку шар PI товщиною 10 мкм (PI-2611, HD MicroSystems) нанесли на пластину центрифугуванням і випікали в атмосфері, збагаченій азотом, при 350 °C протягом 30 хвилин. Металеві сліди були нанесені за допомогою оптичної літографії фоторезисту реверсування зображення (AZ5214, Microchemicals). Електронно-променеве випаровування було використано для осадження 20 нм титану і 200 нм золота, і було виконано відрив. Ми використовували плівку EGNITE товщиною приблизно 1 мкм як компроміс між електрохімічними характеристиками та гнучкістю масиву. Після перенесення плівки GO алюміній був випарений електронним променем, а області на верхній частині майбутніх мікроелектродів були визначені за допомогою негативного фоторезиста (nLOF 2070, Microchemicals) і знімалися. Далі плівка GO була протравлена скрізь, окрім майбутніх мікроелектродів, за допомогою кисневого реактивного іонного травлення (RIE) протягом 5 хв при 500 Вт, а захисні алюмінієві стовпчики були протравлені розведеним розчином фосфорної та азотної кислот. Потім шар PI-3 товщиною 2611 мкм наносили на пластину та випікали, як описано раніше. Потім визначали отвори PI-2611 на мікроелектроді за допомогою позитивного товстого фоторезиста (AZ9260, Microchemicals), який діяв як маска для наступного кисневого RIE. Пізніше пристрої були нанесені на шар PI, знову використовуючи фоторезист AZ9260 і RIE. Потім шар фоторезисту видаляли в ацетоні, а пластину очищали в ізопропіловому спирті та висушували. Нарешті, пристрої були відшаровані від пластини та готові до розміщення в стерилізаційних пакетах для гідротермічної обробки при 134 °C у стандартному автоклаві протягом 3 год.
Електрохімічна характеристика мікроелектродів
Електрохімічну характеристику мікроелектродів проводили за допомогою потенціостата Metrohm Autolab PGSTAT128N в 1 × PBS (Sigma-Aldrich, P4417), що містить 10 мМ фосфатний буфер, 137 мМ NaCl і 2.7 мМ KCl при рН 7.4 і з використанням триелектродної конфігурації. Електрод Ag/AgCl (FlexRef, WPI) використовували як еталон, а платиновий дріт (Alfa Aesar, 45093) використовували як протиелектрод.
Перед оцінкою ефективності електроди були імпульсно оброблені 10,000 1 імпульсами збалансованого заряду (15 ms, 100 мкА). Вплив електродів на безперервні імпульсні протоколи, що відбуваються 0.9 циклічними циклами вольтамперометрії (від -0.8 до +50 В) при XNUMX мВ с-1, 20 повторів 5,000 імпульсів (1 ms) і повторне визначення потенціалу розімкнутого ланцюга.
Аналіз даних
Дані електрохімічної характеристики аналізували за допомогою пакетів Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Дані імпедансної спектроскопії були підігнані до еквівалентної електричної моделі, що складається з опору (R) послідовно з елементом постійної фази (CPE). Звідти значення CPE було наближено до ємності та поділено на геометричну площу мікроелектрода, щоб отримати еквівалентне значення міжфазної ємності EGNITE. Ємність накопичення заряду мікроелектрода (CSC) розраховували за допомогою циклічних вольтамперометричних вимірювань шляхом інтегрування катодного та анодного режимів виміряного струму та нормалізації за швидкістю сканування. Катодна та анодна ємності зберігання заряду (cCSC і aCSC) при швидкості сканування 100 мВ EGNITE становлять 45.9 ± 2.4 і 34.6 ± 2.8 мК см-2відповідно (n = 3). Про це повідомляється за іншими матеріалами58, отримані CSC залежать від швидкості сканування (додатковий рис. 5). Щоб оцінити наявність реакцій відновлення кисню, ми виміряли форму хвилі CV під електролітом, продутим азотом59 і не спостерігав суттєвих відмінностей у формі хвилі (додаткова рис. 6). Однак наші результати не повністю розглядають вплив реакцій відновлення кисню на здатність інжекції заряду EGNITE, і для належного дослідження цього необхідно провести додаткову роботу. Ємність інжекції заряду мікроелектрода (CIC) була встановлена шляхом визначення амплітуди імпульсу струму, який викликав різницю напруги (після усунення омічного падіння), яка відповідала електрохімічному водяному вікну електрода (–0.9 В для катодного та +0.8 В для анодного проти Ag/AgCl ) (Додаткова рис. 17)60.
Статистичний аналіз
Дані є середніми ± s.d., n = 18 для EIS та n = 3 для хронопотенціометрій. Дані карти катодної ємнісної напруги є середнім значенням катодної ємнісної напруги для однієї події для кожної форми імпульсу n = 3 електроди.
Оцінка механічної стійкості
Ультразвукова обробка
Масиви електродів EGNITE поміщали в склянку, наповнену водою в ультразвуковій водяній бані (Elmasonic P 180H). Обробку ультразвуком застосовували при 37 kHz протягом 15 хв при потужності 200 W, а потім додатково 15 хв обробки ультразвуком при 37 kHz з потужністю, підвищеною до 300 W. Зображення електродів були отримані до та після етапів обробки ультразвуком.
Тест на згин
Налаштування згинання (рис. 2k) складався з трьох циліндричних стрижнів; середній (діаметр 700 мкм) опускали вниз, утворюючи кути вигину 131°. Три гнучкі масиви мікроелектродів використовували для випробування на вигин. Кожен масив містив 18 мікроелектродів діаметром 50 мкм. Два масиви вимірювали після 10 і 20 циклів, тоді як один пристрій вимірювали лише протягом 10 циклів, оскільки він був пошкоджений під час обробки після вимірювання. Цикл випробування на вигин складався з 10-секундного застосування навантаження плюс 10 с без навантаження. Пристрої були електрохімічно охарактеризовані (EIS і CV) до і після 10 і 20 циклів згинання.
Епікортикальний нейронний запис
Епікортикальна імплантація
Усі експериментальні процедури проводились відповідно до рекомендацій Ради Європейського Співтовариства та французького законодавства щодо догляду та використання лабораторних тварин. Протоколи були схвалені етичним комітетом Гренобля (ComEth) і санкціоновані міністерством Франції (номер 04815.02). Щури Sprague–Dawley (самці, віком 4 місяці, вагою ∼600 g) анестезували внутрішньом’язово кетаміном (50 мг на кг (маси тіла)) і ксилазином (10 мг на кг (маси тіла)), а потім фіксували до стереотаксичного тримача. Видалення скроневої частини черепа оголило слухову кору. Тверду мозкову оболонку зберегли, щоб уникнути пошкодження кортикальної тканини. На вершині просвердлили отвір для вставлення електрода порівняння, а другий отвір, на 7 мм вперед від першого, просвердлили для вставлення заземлюючого електрода. Електродами були штирі товщиною 0.5 мм, які використовуються для розеток інтегральних схем. Їх розмістили для встановлення електричного контакту з твердою мозковою оболонкою та закріпили на черепі стоматологічним цементом. Потім ми встановили стрічку поверхневого мікроелектрода на слухову кору, як показано на рис. 3b. Візерунки вен ідентифікують слухову кору в області 41 на карті мозку щура Кріга. Кортикальні сигнали були одночасно посилені з посиленням 1,000 і оцифровані з частотою дискретизації 33 kHz. Динамік на відстані 20 см перед вухом щура, контралатерально до відкритої кори головного мозку, подавав акустичні стимули. Стимули, що надходять, контролювали за допомогою 0.25-дюймового мікрофона (Brüel & Kjaer, 4939), розміщеного біля вуха, і відображали рівень звукового тиску (дБ SPL re 20 мкПа). Ми досліджуємо вершинно-позитивні (негативні) відповіді із середньою затримкою, викликані чергуванням клацань при 80 dB SPL і тональними імпульсами при 70 dB SPL із частотами в діапазоні від 5 до 40 kHz, часом наростання та спаду 5 ms і тривалість 200 мс.
Аналіз даних
Електрофізіологічні дані аналізували за допомогою пакетів Python 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) та спеціальної бібліотеки PhyREC (https://github.com/aguimera/PhyREC). середньоквадратичне значення значення були розраховані з ковзним вікном 20 ms на частотах вище 200 Гц. Спектрограми були розраховані для діапазону від 70 Гц до 1.1 кГц. PSD було розраховано за 60 с безперервних записів. Для даного масиву електродів було розраховано два PSD: in vivo (IV) і post mortem (PM). SNR виражається в дБ (20 × ln(r.m.s.(IV)/r.m.s.(PM))) та інтерполюється для 20 точок, логарифмічно розташованих між 10 Hz та 1 kHz.
Статистичний аналіз
Епікортикальні нейронні дані, представлені на рис. 3 беруться з індивідуальних вимірювань на одній тварині. На рис. 3cпредставлені дані з 64 електродів. На рис. 3dпредставлені дані з двох обраних електродів. На рис. 3f, PSD і SNR розраховуються з 64 електродів EGNITE і показані як середнє ± s.d. На додатковому рис. 12в,г медіанні дані представлені для 192 електродів EGNITE з n = 3 експерименти та 60 платинових електродів з n = 1 експеримент.
Інтракортикальний нейронний запис
Інтракортикальна імплантація
Тварин анестезували сумішшю кетамін/ксилазин (75:1, 0.35 мл/28 г i.p.) і цей стан підтримували за допомогою інгаляційної маски, що забезпечує 1.5% ізофлурану. Кілька мікрогвинтів вкрутили в череп, щоб стабілізувати імплантат, а той, що знаходиться на вершині мозочка, використовувався як загальна основа. Зонд імплантували в префронтальну кору (координати: AP, 1.5 мм; ML, ±0.5 мм; DV, −1.7 мм від брегми). Імплантацію проводили шляхом покриття зонда мальтозою (див. протокол нижче), щоб забезпечити тимчасову жорсткість зонда та полегшити введення зонда. Зонд був запломбований стоматологічним цементом. З'єднувачі TDT-ZifClip використовувалися для підключення зонда до електрофізіологічної системи за допомогою мініатюрного кабелю. Після операції миша пройшла період відновлення протягом 1 тижня, отримуючи знеболювальне (бупренорфін) і протизапальне (мелоксикам) лікування. Нейронну активність реєстрували за допомогою багатоканальної системи Open Ephys з частотою дискретизації 30 kHz з підсилювачем Intan RHD2132. Експерименти зі слуховими завданнями проводилися в звукоізольованій коробці з двома динаміками всередині з використанням протоколів, заснованих на раніше описаній роботі61. Звуковий стимул складався з клацання білого шуму тривалістю 15 мс, повторюваного 100 разів (циклів), кожен розділений 5 s (міжстимульний інтервал). Під час виконання завдання тварина могла вільно пересуватися.
Мальтозний протокол жорсткості
Водний розчин мальтози нагрівають до температури склування (Tg), від 130 до 160 °C, використовуючи плиту або мікрохвильову піч. Коли мальтоза стає в’язкою, тильна сторона зонда контактує лише з мальтозою. Коли мальтоза охолоджується, вона твердіє та робить зонд жорсткішим.
Аналіз даних
Нейронні сигнали від кожного електрода фільтрувалися в автономному режимі для виділення SUA та LFP. SUA оцінювали шляхом фільтрації сигналу між 450 і 6,000 Гц, а спайки від окремих нейронів сортували за допомогою аналізу головних компонентів за допомогою Offline Sorter v.4 (Plexon). Щоб отримати LFP, сигнали були зменшені до 1 kHz, усунені тренди та режекторно-фільтровані для видалення артефактів лінії шуму (50 Hz та його гармоніки) за допомогою спеціально написаних сценаріїв на Python. AEP SNR розраховували як відношення пікової амплітуди N1 до s.d. періоду 20 мс до подразника.
Статистичний аналіз
Дані, наведені на рис. 3h,i є середнім ± s.d., n = 30 як кількість усереднених випробувань. Дані, записані з одного електрода, показані на 30, 60 і 90 дні. Представлені дані для однієї тварини.
Хронічна епікортикальна біосумісність
Хірургічна імплантація пристроїв
Для цього дослідження було використано 27 дорослих самців щурів Sprague–Dawley (Charles River). Тварин утримували при температурі навколишнього середовища 21 ± 2 °C і вологості 40–50%, при циклі 12 h світло/12 h темнота. Щурів розміщували групами та мали вільний доступ до їжі та води протягом усього періоду експерименту. Експериментальні процедури проводилися відповідно до Закону про добробут тварин (1998) за схваленням Міністерства внутрішніх справ Великобританії та місцевого органу етичної перевірки добробуту тварин (AWERB). Тварин під час операції анестезували ізофлураном (2–3%), а глибину анестезії контролювали за допомогою тесту на щипковий рефлекс. Тварин поміщали в стереотаксичну раму (Kopf, 900LS), розташовану над термоковдрою для підтримки температури тіла. Краніотомічний отвір (∼5 мм ×4 мм) було зроблено на відстані 1 мм від середньої лінії за допомогою стоматологічного бормашини зі свердлом 0.9 мм, тверду мозкову оболонку було видалено, а епікортикальний пристрій розміщено на кортикальній поверхні мозку. Краніотомічний отвір був заклеєний Kwik-sil, потім зубним цементом для закріплення, а шкіра була закрита швами. Були зроблені підшкірні ін’єкції фізіологічного розчину (1 мл на кг (маси тіла)) і бупренорфіну (0.03 мг на кг (маси тіла)), щоб заповнити втрачену рідину та зменшити післяопераційний біль, а анестезію було скасовано.
Збір та обробка тканин
Тварин припиняли через 2, 6 або 12 тижнів після імплантації за допомогою відповідного методу для типу аналізу, який необхідно виконати.
Гістологія та імуногістохімія
Через 2, 6 або 12 тижнів після імплантації щурам припиняли серцеву перфузію гепаринізованим (10 U мл)-1, Sigma-Aldrich) PBS, а потім 4% параформальдегіду (PFA, Sigma-Aldrich) у PBS. Мозок постфіксували в 4% PFA протягом 24 годин, потім переносили в 30% сахарозу в PBS щонайменше на 48 годин перед заморожуванням в ізопентані. Потім мозок зберігали при -80 °C до кріозрізу при 25 мкм. Потім тканину фарбували на іонізовану молекулу-адаптер зв’язування кальцію 1 (Iba-1), щоб визначити рівень активації мікроглії. Коротко, зрізи тканини блокували 5% козячої сироватки в PBS з 0.1% Triton-X протягом 1 год перед нічною інкубацією при 4 °C з первинним антитілом проти Iba-1 (1:1,000, 019-19741; Wako). Потім зрізи фарбували вторинним антитілом, анти-кролячим Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) протягом 1 год при кімнатній температурі. Скела монтували з покривними скельцями з використанням середовища Prolong Gold проти вицвітання з 4,6-діамідіно-2-феніліндолом (Thermo Fisher). Зонд охоплював площу 3 × 3.7 мм2 на кірковій поверхні головного мозку; зрізи тканини, відібрані для фарбування, охоплювали 3.2 мм у довжину цієї області. Скела були зображені за допомогою мікроскопічного сканера 3DHistech Pannoramic-250 із збільшенням 20×, а зображення були проаналізовані за допомогою CaseViewer v.2.4 (3DHistech). Для оцінки активації мікроглії була покрита область 3.2 мм, з аналізом одного зображення кожні 100 мкм. Зображення були зроблені зі збільшенням 8.5×, на яких детально описано ділянку епікортикального зонда, 3 мм від середньої лінії мозку, охоплюючи область безпосередньо під зондом.
Обробка зображень
Дані мікроскопії були оброблені за допомогою алгоритму для характеристики фенотипу мікроглії (додаткова рис. 13). Активацію мікроглії аналізували за допомогою спеціального CellProfiler* (Broad Institute, v.3.1.9 від https://cellprofiler.org/) трубопровід. По-перше, модуль EnhanceOrSuppressFeatures використовувався для покращення ниткоподібних структур, таких як нейрити, шляхом застосування методу покращення трубчастості. З покращених зображень клітини були сегментовані за допомогою модуля IdentifyPrimaryObjects. Попередні вимірювання комірок показали, що відповідний діапазон діаметра об’єкта становив 3–40 пікселів. Об’єкти за межами цього діапазону діаметрів або торкалися краю зображення були відкинуті. Комірки були сегментовані з використанням двокласової адаптивної порогової стратегії Otsu з адаптивним розміром вікна 50 пікселів. Об’єкти, ідентифіковані модулем IdentifyPrimaryObjects, були введені в модуль MeasureObjectSizeShape для обчислення необхідних властивостей для класифікації комірок. У модулі ClassifyObjects категорією, на якій базуються класифікації, було визначено AreaShape, а Extent було вибрано як відповідне вимірювання. Клітини були класифіковані як "активовано» або «неактивовано» на основі їх властивості Extent, яка є відношенням площі, зайнятої коміркою, до площі, зайнятої її обмежувальною рамкою. Цей класифікаційний підхід був раціоналізований тим фактом, що активована мікроглія має великі клітинні тіла і не має відростків, і, таким чином, займає набагато більшу частку своїх обмежувальних рамок, ніж їх неактивовані аналоги. Нарешті, модулі CalculateMath і ExportToSpreadsheet були використані для обчислення та виведення бажаної статистики.
Статистичний аналіз
Набори даних є n = 3 для кожного типу пристрою (імплантат лише PI (PI); PI з відкритим мікрофабрикованим золотом (золото); і PI з мікрофабрикованим золотом та EGNITE (EGNITE) у всі моменти часу), за винятком 6 тижневого золота, яке n = 2 для даних ELISA. Контралатеральні півкулі об'єднували в кожен момент часу для отримання n = 9 через 2 та 12 тижнів після імплантації та n = 8 через 6 тижнів після імплантації. Аналіз даних проводили за допомогою програмного забезпечення GraphPad Prism v.8. Статистичний аналіз був завершений за допомогою двостороннього дисперсійного аналізу (ANOVA) з тестом множинних порівнянь Тьюкі, де доречно; P < 0.05 вважалося значущим.
ELISA
Після періоду імплантації тварини були перервані вивихом шийки матки. Мозкову тканину витягували як з правої, так і з лівої півкулі мозку, швидко заморожували в рідкому азоті та зберігали при -80°C до подальшого використання. Тканину лізували за допомогою буфера для лізису NP-40 (150 мМ NaCl, 50 мМ Tris-Cl, 1% замінник Nonidet P40, Fluka, pH доведений до 7.4), що містить інгібітор протеази та фосфатази (Halt Protease and Phosphatase Inhibitor Cocktail, Thermo Fisher), з подальшим механічним руйнуванням тканини (TissueLyser LT, Qiagen). Потім зразки центрифугували протягом 10 хв при 5,000 об/хв, а супернатант зберігали при 4 °C до подальшого використання. Панель LEGENDplex Rat Inflammation Panel (каталожний номер 740401, BioLegend), мультиплексний набір ELISA на основі кульок, був запущений для кількісного визначення наступних цитокінів; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), гранулоцитарно-макрофагальний колонієстимулюючий фактор, інтерферон-γ і фактор некрозу пухлини. Набір запускали згідно з інструкціями виробника, із завантаженням білка у фіксованому об’ємі 15 мкл. Після інкубації з супернатантом кульки запускали на проточному цитометрі BD FACSVerse, а дані аналізували за допомогою програмного забезпечення для аналізу даних LEGENDplex.
Нейронна стимуляція
Інтрафасцікулярна імплантація
Усі експерименти на тваринах були схвалені Комітетом з етики Автономного університету Барселони відповідно до Директиви Ради Європейських Співтовариств 2010/63/ЄС. Тварин утримували при 22 ± 2 °C у циклі 12 год світла/12 годин темряви з вільною доступністю їжі та води. Сідничний нерв анестезованих самок щурів Sprague–Dawley (250–300 г, ∼18 тижневого віку) було піддано хірургічному втручанню, а електроди TIME імплантовано поперечно через сідничний нерв за допомогою прямої голки, прикріпленої до петлевої нитки 10-046. Процес спостерігали під дисекційним мікроскопом, щоб переконатися в правильному положенні активних центрів всередині нервових пучків (рис. 4b). Під час експериментів температуру тіла тварин підтримували грілкою.
Нервову стимуляцію виконували шляхом застосування серії двофазних імпульсів струму фіксованої тривалості 100 мкс на фазу та збільшення амплітуди від 0 до 150 мкА кроками 1 або 3 мкА з частотою 3 Гц протягом 33 с (стимулятор DS4, Digitimer) через різні EGNITE мікроелектродів. Одночасно CMAP були записані з м’язів GM, TA та PL за допомогою маленьких голчастих електродів (13 мм завдовжки, 0.4 мм діаметра, голчасті електроди з нержавіючої сталі A-03-14BEP, Bionic), розміщених у кожному м’язі.62. Активний електрод розташовували на черевці м'яза, а опорний - на рівні сухожилля. Записи електроміографії були посилені (×100 для GM і TA, ×1,000 для PL; підсилювачі P511AC, Grass), смугово-фільтровані (від 3 Гц до 3 кГц) і оцифровані за допомогою системи запису PowerLab (PowerLab16SP, ADInstruments) при 20 кГц.
Аналіз даних
Амплітуду кожного CMAP вимірювали від базової лінії до максимального негативного піку. Вимірювання піку напруги нормалізували до максимальної амплітуди CMAP, отриманої для кожного м’яза в експерименті. Індекс селективності (SI) розраховували для кожного активного центру як співвідношення між нормалізованою амплітудою CMAP для одного м’яза, CMAPi, і сума нормалізованих амплітуд CMAP у трьох м’язах за формулою SIi = nCMAPi/∑nCMAPj, при мінімальній амплітуді струму стимуляції, яка викликала мінімальну функціонально значущу м’язову відповідь (визначається як щонайменше 5% амплітуди CMAP для одного з м’язів відносно максимальної амплітуди CMAP цього м’яза, яка була визначена раніше). Потім активні центри з найвищим SI для кожного з трьох м’язів були обрані як SI для кожного м’яза в даному експерименті.
Хронічна інтраневральна біосумісність
За попередньою процедурою50,63, сідничний нерв анестезованих самок щурів Sprague–Dawley (250-300 g, ∼18 тижневого віку) було піддано впливу, і пристрої для біосумісності in vivo з і без EGNITE були поздовжньо імплантовані в тибіальну гілку сідничного нерва (n = 6–8 на групу). Коротко кажучи, нерв проколюють у трифуркації прямою голкою, прикріпленою до петлевої нитки 10-0 (STC-6, Ethicon); нитка тягне за стрілоподібний кінчик зігнутої електродної стрічки. Кінчик обрізаний, щоб відвести нитку, а кінчики кожного плеча злегка загнуті, щоб уникнути вилучення пристрою. Вибрали поздовжній імплантат, оскільки він дозволяє краще вивчити реакцію стороннього тіла всередині нерва50.
Функціональна оцінка нервів і тварин
Тварин оцінювали під час подальшого спостереження після імплантації за допомогою нервової провідності, альгезиметрії та тестів на рухову доріжку62. Для тестів провідності сідничний нерв імплантованої та контралатеральної лап стимулювали голчастими електродами в сідничній вирізці, а CMAP м’яза PL записували, як зазначено вище. Вимірювали затримку та амплітуду CMAP. Для альгезиметричного тесту щурів поміщали на платформу з дротяної сітки та застосовували механічний нешкідливий стимул металевим наконечником, з’єднаним з електронним альгезиметром фон Фрея (Bioseb). Вимірювали ноцицептивний поріг (силу в грамах, при якій тварини відсували лапу) імплантованих проти контралатеральних лап. Для випробування пішохідної доріжки підошовну поверхню задніх лап пофарбували чорним чорнилом і кожного щура залишили йти по коридору. Були зібрані відбитки ніг і розрахований функціональний індекс сідничного нерва62.
Гістологія
Через 2 або 8 тижнів тварин перфузували PFA (4%), і сідничні нерви збирали, постфіксували, кріоконсервували та обробляли для гістологічного аналізу. Для оцінки FBR сідничні нерви розрізали поперечними зрізами товщиною 15 мкм за допомогою кріостата (Leica CM190). Зразки фарбували первинними антитілами до мієлінізованих аксонів (анти-RT97 для мічення Neurofilament 200K, 1:200; Hybridoma Bank Developmental Studies) і макрофагів (анти-Iba-1, 1:500; Wako). Потім зрізи інкубували протягом 1 год при кімнатній температурі з вторинними антитілами осла проти миші Alexa Fluor 488 і осла проти кролика Alexa Fluor 555 (1:200, Invitrogen). Були відібрані репрезентативні зрізи центральної частини імплантату в великогомілковому нерві, зроблені зображення за допомогою епіфлуоресцентного мікроскопа (Eclipse Ni, Nikon), підключеного до цифрової камери (DS-Ri2, Nikon), і аналіз зображень виконано за допомогою програмного забезпечення ImageJ (National Institutes). охорони здоров'я). Кількісно визначали кількість Iba-1-позитивних клітин у всій області великогомілкового нерва, а товщину тканинної капсули вимірювали як середню відстань від кожної сторони імплантату до найближчих аксонів.
Статистичний аналіз
Для статистичного аналізу даних ми використовували одно- або двосторонній дисперсійний аналіз із подальшим пост-тестом Бонферроні для відмінностей між групами або часом. Для графічного представлення та аналізу використовувалося програмне забезпечення GraphPad Prism. Статистичну значущість враховували, коли P <0.05.
Підсумок звітності
Більш детальна інформація про розробку досліджень доступна в Короткий звіт про портфоліо природи пов'язана з цією статтею.
- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoData.Network Vertical Generative Ai. Додайте собі сили. Доступ тут.
- PlatoAiStream. Web3 Intelligence. Розширення знань. Доступ тут.
- ПлатонЕСГ. вуглець, CleanTech, Енергія, Навколишнє середовище, Сонячна, Поводження з відходами. Доступ тут.
- PlatoHealth. Розвідка про біотехнології та клінічні випробування. Доступ тут.
- джерело: https://www.nature.com/articles/s41565-023-01570-5
- : має
- :є
- : ні
- :де
- ][стор
- $UP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- Здатний
- вище
- доступ
- відповідно
- За
- акустичний
- набувати
- придбаний
- придбання
- через
- Діяти
- активоване
- Активація
- активний
- діяльність
- адаптивний
- Додатковий
- адреса
- Відрегульований
- Для дорослих
- після
- AG
- знову
- AL
- Алкоголь
- Alexa
- алгоритм
- ВСІ
- дозволяє
- по
- am
- Ambient
- кількість
- Посилений
- an
- аналізи
- аналіз
- Якір
- та
- тварина
- тварини
- антитіла
- антитіла
- крім
- додаток
- прикладної
- Застосування
- підхід
- відповідний
- твердження
- затверджений
- ЕСТЬ
- ПЛОЩА
- області
- ARM
- навколо
- масив
- стаття
- AS
- оцінити
- оцінка
- асоційований
- припущення
- At
- атмосфера
- атомний
- увагу
- уповноважений
- доступний
- уникнути
- геть
- фон
- Банк
- Барселона
- база
- заснований
- Базова лінія
- BD
- BE
- Промінь
- оскільки
- було
- перед тим
- поведінку
- нижче
- Краще
- між
- обов'язковий
- біомедичні
- Біт
- Black
- блокований
- органів
- тіло
- обидва
- Box
- коробки
- Brain
- мізки
- Філія
- коротко
- широкий
- приніс
- буфера
- але
- by
- кабель
- обчислювати
- розрахований
- кімната
- ємнісний
- потужність
- який
- carried
- випадок
- Категорія
- ccl2
- осередок
- Клітини
- цемент
- центральний
- проблеми
- характеризується
- заряд
- Чарльз
- хімічний
- вибраний
- класифікація
- класифікований
- клацання
- закрито
- коктейль
- збір
- Колони
- комбінований
- приходить
- комітет
- спільноти
- співтовариство
- Зроблено
- склад
- Умови
- проводиться
- провідність
- конфігурація
- З'єднуватися
- підключений
- вважається
- Складається
- постійна
- контакт
- містяться
- безперервний
- внесок
- Зближення
- виправити
- Відповідний
- коридор
- кора
- Рада
- аналоги
- курс
- покритий
- критичний
- Перетинати
- кріоконсервований
- Поточний
- виготовлений на замовлення
- Вирізати
- цикл
- циклів
- цитокіни
- руйнівний
- темно
- дані
- аналіз даних
- Днів
- de
- зменшити
- вважається
- певний
- Дель
- поставляється
- залежати
- депозит
- депонований
- глибина
- описаний
- дизайн
- бажаний
- докладно
- Визначати
- певний
- визначення
- розвитку
- пристрій
- прилади
- DID
- дієта
- різниця
- Відмінності
- різний
- цифровий
- оцифровані
- розведений
- прямий
- безпосередньо
- вивих
- Зрив
- відстань
- розділений
- do
- домен
- зроблений
- вниз
- Падіння
- два
- тривалість
- під час
- E&T
- кожен
- край
- електричний
- Electronic
- елемент
- слон
- піднесений
- охоплюючий
- енергія
- підвищувати
- підвищена
- Посилення
- забезпечувати
- обладнаний
- Еквівалент
- встановлений
- оцінка
- Ефір (ETH)
- етичний
- EURO
- Європейська
- EV
- оцінюється
- оцінка
- Event
- Кожен
- скрізь
- підтверджено
- досліджувати
- виняток
- очікуваний
- експеримент
- експериментальний
- Експерименти
- піддаватися
- експонування
- виражений
- ступінь
- витяг
- фасилітувати
- факт
- фактор
- Падати
- далеко
- ШВИДКО
- риси
- жінка
- Фіга
- Рисунок
- заповнений
- Фільм
- фільми
- фільтрація
- в кінці кінців
- Перший
- пристосування
- фіксованою
- Гнучкість
- гнучкий
- потік
- увагу
- фокусування
- потім
- після
- харчування
- для
- Примусово
- іноземні
- форма
- формула
- FRAME
- Безкоштовна
- вільно
- заморожування
- французька
- від
- перед
- заморожені
- Повний
- повністю
- функціональний
- функціонально
- далі
- майбутнє
- Отримувати
- дав
- Загальне
- геометрія
- Давати
- даний
- скло
- GM
- Go
- золото
- Графен
- трава
- Земля
- Group
- Групи
- керівні вказівки
- було
- Половина
- Обробка
- Мати
- здоров'я
- допомога
- півкулі
- висока роздільна здатність
- найвищий
- утримувач
- Hole
- Головна
- Міністерство внутрішніх справ
- Горизонтальний
- ГАРЯЧА
- Однак
- HTTPS
- хуан
- i
- ідентифікований
- ідентифікувати
- IEEE
- зображення
- аналіз зображення
- зображень
- Impact
- in
- У тому числі
- зростаючий
- інкубований
- ІНКУБАЦІЯ
- індекс
- індивідуальний
- запалення
- інформація
- вхід
- всередині
- Інститут
- інструкції
- інтегрований
- Інтеграція
- призначених
- інтерфейс
- Інтерфейси
- в
- дослідити
- IT
- ЙОГО
- збережений
- комплект
- Кох
- етикетка
- лабораторія
- великий
- більше
- лазер
- останній
- Затримка
- пізніше
- закон
- шар
- найменш
- залишити
- Законодавство
- довжина
- рівень
- бібліотека
- як
- недоліки
- Лінія
- LINK
- пов'язаний
- Рідина
- загрузка
- місцевий
- розташований
- місць
- Довго
- довгостроковий
- втрачений
- знижена
- макрофаги
- made
- головний
- підтримувати
- зробити
- карта
- карти
- маска
- відповідає
- матеріал
- Матеріали
- matplotlib
- максимальний
- mc
- значити
- засоби
- виміряний
- вимір
- вимірювання
- вимір
- механічний
- Медіа
- метал
- метод
- мікроглія
- мікрофон
- Мікроскоп
- Мікроскопія
- Середній
- хвилин
- мінімальний
- мінімальний
- служіння
- суміш
- ML
- модель
- Моделі
- Модулі
- Модулі
- молекули
- контрольований
- місяців
- миша
- рухатися
- переїхав
- MS
- Багатоканальний
- м'яз
- нанотехнології
- National
- Національні інститути здоров'я
- природа
- Близько
- необхідно
- некроз
- потреби
- негативний
- NEO
- мережу
- мережу
- Нейронний
- нейрофіламент
- Нейрони
- наступний
- немає
- шум
- номер
- нумпі
- об'єкт
- мета
- об'єкти
- спостерігати
- отримувати
- отриманий
- of
- від
- Office
- offline
- Старий
- on
- один раз
- ONE
- тільки
- відкрити
- отвори
- працювати
- or
- Інше
- наші
- з
- вихід
- поза
- над
- загальний
- за ніч
- огляд
- Кисень
- пакети
- майданчик
- Біль
- панди
- панель
- частина
- проходити
- моделі
- Плесна
- PBS
- Peak
- для
- продуктивність
- виконується
- period
- периферійний
- фаза
- фенотип
- сосна
- трубопровід
- піксель
- розміщений
- Літаки
- платформа
- платина
- plato
- Інформація про дані Платона
- PlatoData
- плюс
- pm
- точка
- точок
- портфель
- положення
- позитивний
- пошта
- потенціал
- влада
- попередньо
- підготовка
- підготовлений
- наявність
- представлений
- збереглися
- тиск
- раніше
- первинний
- попередній
- зонд
- Процедури
- процес
- оброблена
- процеси
- виробництво
- Продукти
- правильно
- властивості
- власність
- частка
- захищає
- Білок
- протокол
- протоколи
- забезпечувати
- забезпечення
- Тягне
- пульс
- Python
- R
- діапазон
- ранжування
- ЩУР
- ставка
- співвідношення
- RE
- реакція
- реакції
- готовий
- отримання
- рекомендації
- записаний
- запис
- відновлення
- зменшити
- Знижений
- скорочення
- посилання
- регенерація
- режими
- регіон
- відносний
- доречний
- залишатися
- видаляти
- Вилучено
- видалення
- повторний
- замінювати
- Повідомляється
- Звітність
- подання
- представник
- дослідження
- Опір
- дозвіл
- повага
- відповідно
- відповідь
- відповіді
- результати
- Звернення
- огляд
- стрічка
- Багаті
- право
- Зростання
- Річка
- Кімната
- прогін
- s
- то ж
- сканування
- scripts
- другий
- вторинний
- розділ
- розділам
- безпечний
- побачити
- обраний
- Серія
- сироватка
- набори
- кілька
- Форма
- показаний
- Шоу
- сторона
- Сигнал
- сигнали
- значення
- значний
- срібло
- одночасно
- один
- сайт
- сайти
- Розмір
- Шкіра
- Ковзати
- Слайди
- ковзання
- невеликий
- хватка
- Софтвер
- рішення
- Звучати
- Source
- просторовий
- Гучномовець
- динаміки
- зазначений
- дані
- Спектроскопія
- шипи
- Спін
- площа
- Стабільність
- стабілізувати
- стек
- Нержавіюча сталь
- standard
- нормований
- Починаючи
- стан
- статистичний
- статистика
- пар
- сталь
- ніжка
- Крок
- заходи
- стимул
- зберігання
- зберігати
- прямий
- Стратегія
- Зачистите
- сильний
- структурний
- структур
- Дослідження
- Вивчення
- підшкірний
- наступні
- істотний
- такі
- сума
- поверхню
- Хірургія
- система
- T
- Приймати
- прийняті
- Мета
- Завдання
- методи
- Технологія
- тимчасовий
- тест
- Тести
- ніж
- Що
- Команда
- Площа
- Майбутнє
- Великобританія
- їх
- потім
- Там.
- теплової
- вони
- це
- ті
- три
- поріг
- через
- по всьому
- Таким чином
- час
- times
- чайові
- Поради
- тканину
- титан
- до
- TONE
- топ
- Усього:
- зворушливий
- до
- трек
- поїзда
- транс-
- переклад
- передані
- Передача
- перехід
- лікування
- лікування
- лікування
- випробування
- підручник
- два
- тип
- Uk
- ультразвук
- при
- розуміння
- пережив
- до
- використання
- використовуваний
- використання
- Вакуум
- дійсний
- значення
- Цінності
- Проти
- через
- природних умовах
- Напруга
- обсяг
- з
- W
- ходити
- ходьба
- було
- вода
- we
- week
- тижня
- зважування
- вага
- Добробут
- були
- коли
- який
- в той час як
- білий
- всі
- вікно
- Провід
- з
- висновок
- без
- Work
- працював
- робочий
- X
- рентгенівський
- зефірнет