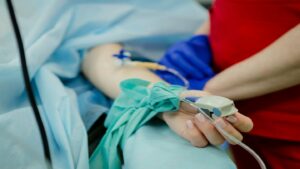
MoonLake Immunotherapeutics (MoonLake) розпочав співпрацю з SHL Medical спільно розробити автоін’єктор для клінічних і комерційних поставок свого нанотіла сонелокімабу.
Партнерство використовуватиме технологію модульної платформи Molly від SHL Medical для розробки автоінжектора.
Згідно з умовами угоди про співпрацю, SHL Medical надасть свій досвід у розробці, складанні та виробництві пристроїв для підтримки проекту виготовлення ліків.
Загалом 17 комбінованих продуктів, що використовують перевірену технологію автоінжекторів Molly, були схвалені щонайменше в 69 країнах.
Технологія полегшує домашнє лікування пацієнтів різних терапевтичних напрямків, які потребують ін’єкційних препаратів.
Сонелокімаб — досліджуване гуманізоване нанотіло масою 40 кДа, яке може ефективно нейтралізувати IL-17F та IL-17A для лікування запальних захворювань.
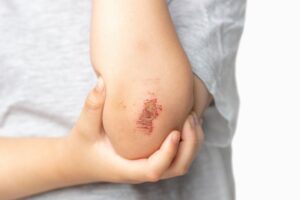
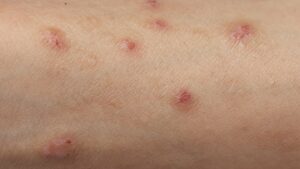
Наразі він перебуває на стадії клінічної розробки для низки показань, включаючи лікування запалення у пацієнтів із гнійним гідраденітом, хронічним захворюванням шкіри, яке призводить до незворотного руйнування тканин.
Компанія також представила клінічні дані на щорічній зустрічі Американської академії дерматології, щоб підтвердити цю гіпотезу.
Сонелокімаб менший за розміром порівняно з традиційними антитілами та альбумінзв’язуючим доменом, що може забезпечити більшу ефективність.
Генеральний директор SHL Medical Ульріх Фесслер сказав: «Робота з MoonLake під час розробки сонелокімабу дозволяє нам реалізовувати стратегії, які найкраще доповнюють клінічні та комерційні потреби MoonLake.
«Ми в захваті від співпраці та з нетерпінням чекаємо потенційного впровадження інноваційної технології нанотіл для лікування дерматологічних і ревматичних запальних захворювань у пацієнтів у всьому світі».
Компанія MoonLake вже завершила оцінку Sonelokimab у фазі 2b дослідження (NCT03384745).
У рандомізованому плацебо-контрольованому дослідженні за участю 313 пацієнтів, які страждають на псоріаз бляшкового типу середнього та важкого ступеня, препарат продемонстрував швидку та тривалу відповідь на очищення шкіри.
Компанія очікує оприлюднити найкращі результати випробування сонелокімабу фази 2 MIRA на осіб із помірним або важким гнійним гідраденітом до кінця червня цього року.
Головний технічний директор MoonLake Immunotherapeutics Олівер Далтроп сказав: «Оскільки ми активно плануємо програму фази 3 і комерційну готовність, експертиза SHL значно розширить нашу здатність представити сонелокімаб у форматі автоін’єктора, який може принести користь пацієнтам, якщо буде схвалено».
<!-- GPT AdSlot 3 для рекламного блоку "Verdict/Verdict_In_Article" ### Розмір: [[670,220]] -- !-- Закінчити рекламне місце 3 -->- Розповсюдження контенту та PR на основі SEO. Отримайте посилення сьогодні.
- PlatoAiStream. Web3 Data Intelligence. Розширення знань. Доступ тут.
- Карбування майбутнього з Адріенн Ешлі. Доступ тут.
- джерело: https://www.medicaldevice-network.com/news/moonlake-shl-medical-autoinjector-sonelokimab/
- : має
- :є
- a
- здатність
- МЕНЮ
- Академія
- активно
- Ad
- Угода
- дозволяє
- вже
- Також
- американська
- an
- та
- щорічний
- антитіла
- затверджений
- ЕСТЬ
- області
- збірка
- оцінка
- At
- назад
- було
- користь
- КРАЩЕ
- обидва
- Приведення
- by
- CAN
- нести
- Генеральний директор
- головний
- Клінічний
- співробітництво
- поєднання
- комерційний
- компанія
- порівняний
- Доповнення
- Зроблено
- стан
- може
- країни
- кредит
- В даний час
- дані
- продемонстрований
- розвивати
- розробка
- пристрій
- Захворювання
- домен
- наркотик
- Наркотики
- продуктивно
- включіть
- кінець
- підвищувати
- збуджений
- чекає
- експертиза
- полегшує
- для
- формат
- сформований
- Вперед
- від
- значно
- Мати
- Головна
- HTTPS
- if
- in
- У тому числі
- показання
- осіб
- запалення
- інноваційний
- вводити
- ЙОГО
- JPG
- червень
- КДА
- Веде за собою
- найменш
- Важіль
- подивитися
- Може..
- медичний
- засідання
- модульний
- більше
- потреби
- номер
- of
- Офіцер
- наші
- з
- партнер
- Партнерство
- pacientes
- фаза
- план
- платформа
- plato
- Інформація про дані Платона
- PlatoData
- потенційно
- представлений
- PRNewswire.com
- Production
- Продукти
- програма
- проект
- доведений
- забезпечувати
- швидко
- Готовність
- вимагати
- відповідь
- результати
- показувати
- Зазначений
- сильно
- Поділитись
- Розмір
- Шкіра
- менше
- стратегії
- страждає
- поставка
- підтримка
- технічний
- Технологія
- terms
- Що
- Команда
- Лікувальний
- це
- У цьому році
- до
- Усього:
- традиційний
- лікування
- лікування
- суд
- блок
- us
- використання
- різний
- we
- який
- в той час як
- волі
- з
- світовий
- рік
- зефірнет