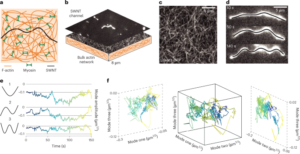
การเตรียมวัสดุและการกำหนดลักษณะเฉพาะ
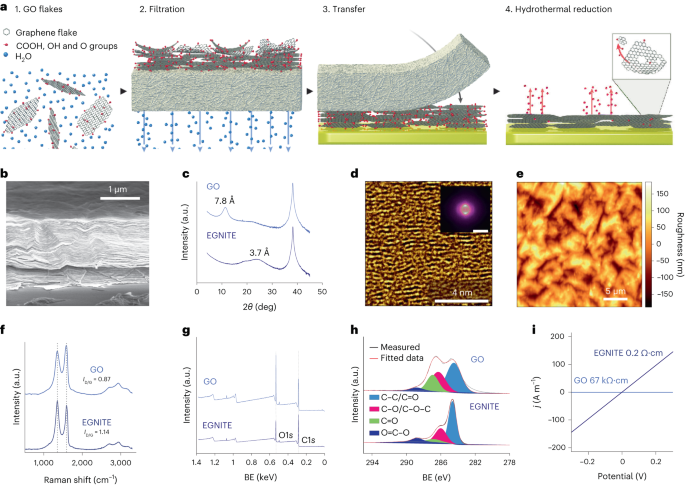
สารละลาย GO ที่เป็นน้ำถูกเจือจางในน้ำปราศจากไอออนเพื่อให้ได้ 0.15 มก. มล.-1 สารละลายและสุญญากาศถูกกรองผ่านเมมเบรนไนโตรเซลลูโลสที่มีรูพรุนขนาด 0.025 µm ทำให้เกิดเป็นฟิล์มบางของ GO จากนั้น ฟิล์มบางถูกถ่ายโอนไปยังซับสเตรตเป้าหมายโดยใช้การถ่ายโอนแบบเปียกในน้ำปราศจากไอออนและการอบอ่อนด้วยความร้อนเพิ่มเติมที่ 100 °C เป็นเวลา 2 นาที ชั้นฟิล์ม–สารตั้งต้น GO ถูกลดความร้อนด้วยความร้อนที่ 134 °C ในหม้อนึ่งความดันมาตรฐานเป็นเวลา 3 ชั่วโมงเพื่อสร้าง EGNITE สารตั้งต้นพื้นฐานสำหรับการศึกษาลักษณะเฉพาะทั้งหมดของ EGNITE เป็นรูปสี่เหลี่ยมจัตุรัส (1 × 1 ซม.2) ของ Si/SiO2 (400 ไมโครเมตร/1 ไมโครเมตร)
XPS
การวัด XPS ดำเนินการด้วยเครื่องวิเคราะห์ Phoibos 150 (SPECS) ในสภาวะสุญญากาศสูงเป็นพิเศษ (ความดันพื้นฐาน 5 × 10-10 mbar) ด้วยแหล่งกำเนิดรังสีเอกซ์ Al Kα แบบเอกรงค์ (1,486.74 eV) สเปกตรัมภาพรวมได้มาด้วยพลังงานการส่งผ่าน 50 eV และขนาดขั้น 1 eV และสเปกตรัมความละเอียดสูงได้มาด้วยพลังงานการส่งผ่าน 20 eV และขนาดขั้น 0.05 eV ความละเอียดโดยรวมในเงื่อนไขสุดท้ายเหล่านั้นคือ 0.58 eV ตามที่กำหนดโดยการวัดความกว้างเต็มที่ครึ่งหนึ่งของ Ag 3d5/2 จุดสูงสุดของเงินสปัตเตอร์ การวิเคราะห์ XPS แสดงให้เห็นการลดลงอย่างมากหลังการบำบัดด้วยความร้อนของจุดสูงสุดของ C–O (เกี่ยวข้องกับหมู่อีพอกไซด์) แต่มีส่วนช่วยเล็กน้อยของ C–OH, C=O และ C(O)OH เนื่องจากไฮดรอกซิล คาร์บอนิล และคาร์บอกซิลที่ คงอยู่หลังจากการลดลง การสลายตัวของ O1s พีคยืนยันพฤติกรรมดังกล่าว การสนับสนุนหลักให้กับ C1s อย่างไรก็ตามสัญญาณหลังจากการลดความร้อนใต้พิภพมาจาก sp2 ออร์บิทัล C-C ไฮบริด34,57.
การเลี้ยวเบนรังสีเอกซ์
การวัดการเลี้ยวเบนของรังสีเอกซ์ (θ-2θ สแกน) ดำเนินการในเครื่องวัดการเลี้ยวเบนของการวิจัยวัสดุ (Malvern PANalytical) เครื่องวัดการเลี้ยวเบนนี้มีแนวนอน ω-2θ โกนิโอมิเตอร์ (รัศมี 320 มม.) ในเรขาคณิตสี่วงกลม และทำงานร่วมกับหลอดเอ็กซ์เรย์เซรามิกที่มีขั้วบวก Cu Kα (λ = 1.540598 Å). เครื่องตรวจจับที่ใช้คือ Pixelcel ซึ่งเป็นเครื่องตรวจจับรังสีเอกซ์ที่รวดเร็วซึ่งใช้เทคโนโลยี Medipix2
รามัน สเปกโทรสโกปี
การวัดรามานสเปกโทรสโกปีดำเนินการโดยใช้สเปกโตรกราฟ Witec ที่ติดตั้งเส้นกระตุ้นด้วยเลเซอร์ 488 nm สำหรับการวัดนั้น Raman spectra ได้มาจากการใช้วัตถุประสงค์ 50 × และ 600 ร่องต่อตะแกรงนาโนเมตร กำลังเลเซอร์ถูกเก็บไว้ต่ำกว่า 1.5 mW เพื่อหลีกเลี่ยงการให้ความร้อนกับตัวอย่าง
TEM
ลาเมลลาลำแสงไอออนแบบโฟกัสถูกเตรียมด้วย Helios NanoLab DualBeam (LMA-INA) สำหรับการศึกษาภาคตัดขวางของตัวอย่าง EGNITE การวิเคราะห์โครงสร้างดำเนินการโดยใช้ TEM โดยใช้กล้องจุลทรรศน์ Tecnai F20 ทำงานที่ 200 kV รวมถึง HRTEM และเทคนิค STEM สนามมืดวงแหวนมุมสูง การทดลอง STEM-EELS ดำเนินการในกล้องจุลทรรศน์ Tecnai F20 ซึ่งทำงานที่ 200 KeV โดยมีรูรับแสง 5 มม. ความยาวกล้อง 30 มม. มุมลู่เข้า 12.7 mrad และมุมรวม 87.6 mrad เนื่องจากเราใช้ 0.5 eV ต่อพิกเซลและ 250 eV เป็นพลังงานเริ่มต้นในการได้มาซึ่งการสูญเสียคอร์ เราจึงไม่ได้รับ Si K-edge ที่คาดหวังที่ 1,839 eV, Pt M-edge ที่ 2,122 eV และ Au M-edge ที่ 2,206 eV. องค์ประกอบอะตอมของ C–O สัมพัทธ์ได้มาโดยการมุ่งความสนใจไปที่เลเยอร์ GO ที่ลดลง และสมมติว่าขอบที่วิเคราะห์ (C และ O ในกรณีของเรา) รวมเป็น 100% สมมติฐานนี้ใช้ได้ในกรณีของเราตามหลักฐานใน ข้อมูลเสริม แผนที่ ภาพตัดขวางส่วนต่างพลังงานคำนวณโดยใช้แบบจำลอง Hartree–Slater และพื้นหลังโดยใช้แบบจำลองกำลังต่ำ
การนำไฟฟ้า
การวัดค่าการนำไฟฟ้าดำเนินการโดยใช้เครื่องวัดแหล่งที่มา Keithley 2400 ในรูปแบบสองจุด ตัวอย่างที่วัดได้ประกอบด้วยฟิล์ม EGNITE ขนาด 1 × 1 ซม2 ด้านบนของ SiO2 สารตั้งต้น
การวิเคราะห์ข้อมูล
การเลี้ยวเบนของรังสีเอกซ์ ข้อมูล Raman และ XPS ได้รับการวิเคราะห์โดยใช้แพ็คเกจ Python 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib) ระยะห่างระหว่างระนาบคำนวณจากการวัดการเลี้ยวเบนของรังสีเอกซ์ตามกฎของสเนลล์ เมื่อข้อมูลถูกย้ายไปยังโดเมนเชิงพื้นที่แล้ว ยอดสูงสุดของพีคก็จะถูกพอดี ระยะทางที่สอดคล้องกันให้ค่าเฉลี่ยของระยะห่างระหว่างระนาบ การเบี่ยงเบนจากค่าเฉลี่ยเหล่านั้นคำนวณจากความกว้างเต็มที่ครึ่งหนึ่งสูงสุดของอุปกรณ์ฟิตติ้งลอเรนเซียนของยอดเขาบนโดเมนเชิงพื้นที่ การวัดค่า XPS และรามานสเปกโทรสโกปีได้รับการวิเคราะห์โดยปรับการโคจรของพีคในตำแหน่งที่คาดไว้สำหรับลักษณะเฉพาะที่สอดคล้องกัน ค่าการนำไฟฟ้าของ GO และ EGNITE ได้มาจากการปรับ I-V เส้นโค้งที่วัดได้ในการวัดค่าการนำไฟฟ้าตามกฎของโอห์ม ข้อมูลอยู่ n = 1 สำหรับการวัดแต่ละครั้ง
การสร้างอาร์เรย์ที่ยืดหยุ่น
การประดิษฐ์อุปกรณ์แสดงไว้ในรูปที่ 2 เพิ่มเติม 4. อุปกรณ์ถูกสร้างขึ้นบน Si/SiO ขนาด 4 นิ้ว2 (400 μm/1 μm) เวเฟอร์ ขั้นแรก PI (PI-10, HD MicroSystems) ชั้นหนา 2611 µm ถูกเคลือบแบบหมุนบนเวเฟอร์และอบในบรรยากาศที่อุดมไปด้วยไนโตรเจนที่อุณหภูมิ 350 °C เป็นเวลา 30 นาที ร่องรอยของโลหะถูกสร้างลวดลายโดยใช้การพิมพ์หินด้วยแสงของโฟโตรีซิสต์แบบกลับภาพ (AZ5214, ไมโครเคมีคอล) การระเหยของลำอิเล็กตรอนถูกใช้เพื่อสะสมไทเทเนียม 20 nm และทองคำ 200 ทอง และทำการยกออก เราใช้ฟิล์ม EGNITE ที่มีความหนาประมาณ 1 μm เพื่อแลกกันระหว่างประสิทธิภาพทางเคมีไฟฟ้าและความยืดหยุ่นของอาร์เรย์ หลังจากถ่ายโอนฟิล์ม GO แล้ว อะลูมิเนียมจะถูกระเหยออกไป และพื้นที่ด้านบนของไมโครอิเล็กโทรดในอนาคตถูกกำหนดโดยใช้โฟโตรีซิสต์เชิงลบ (nLOF 2070, ไมโครเคมีคอล) แล้วยกออก ถัดไป ฟิล์ม GO ถูกสลักทุกที่ ยกเว้นไมโครอิเล็กโทรดในอนาคตโดยใช้การกัดไอออนปฏิกิริยาออกซิเจน (RIE) เป็นเวลา 5 นาที ที่ 500 W และคอลัมน์อะลูมิเนียมที่ป้องกันถูกสลักด้วยสารละลายเจือจางของกรดฟอสฟอริกและกรดไนตริก จากนั้น PI-3 ชั้นหนา 2611 µm ก็ถูกวางลงบนเวเฟอร์และอบตามที่อธิบายไว้ก่อนหน้า จากนั้นจึงกำหนดช่องเปิดของ PI-2611 บนไมโครอิเล็กโทรดโดยใช้โฟโตรีซิสต์แบบหนาเชิงบวก (AZ9260, ไมโครเคมีคอล) ซึ่งทำหน้าที่เป็นหน้ากากสำหรับออกซิเจน RIE ในเวลาต่อมา ต่อมา อุปกรณ์ถูกสร้างลวดลายบนเลเยอร์ PI อีกครั้งโดยใช้โฟโตรีซิสต์ AZ9260 และ RIE จากนั้นชั้นโฟโตรีซิสจะถูกกำจัดออกในอะซิโตน และเวเฟอร์จะถูกทำความสะอาดด้วยไอโซโพรพิลแอลกอฮอล์และทำให้แห้ง ในที่สุด อุปกรณ์ก็ถูกลอกออกจากแผ่นเวเฟอร์และพร้อมที่จะใส่ในถุงฆ่าเชื้อที่จะบำบัดด้วยความร้อนที่อุณหภูมิ 134 °C ในหม้อนึ่งความดันมาตรฐานเป็นเวลา 3 ชั่วโมง
ลักษณะเฉพาะทางเคมีไฟฟ้าของไมโครอิเล็กโทรด
การแสดงคุณลักษณะทางเคมีไฟฟ้าของไมโครอิเล็กโทรดดำเนินการด้วยโพเทนชิโอสแตต Metrohm Autolab PGSTAT128N ใน 1× PBS (Sigma-Aldrich, P4417) ที่ประกอบด้วยบัฟเฟอร์ฟอสเฟต 10 mM NaCl 137 mM NaCl และ 2.7 mM KCl ที่ pH 7.4 และใช้การกำหนดค่าแบบสามอิเล็กโทรด อิเล็กโทรด Ag/AgCl (FlexRef, WPI) ถูกใช้เป็นข้อมูลอ้างอิง และใช้ลวดแพลตตินัม (Alfa Aesar, 45093) เป็นอิเล็กโทรดเคาน์เตอร์
ก่อนการประเมินประสิทธิภาพ อิเล็กโทรดถูกพัลส์ด้วยพัลส์ที่สมดุลประจุ 10,000 พัลส์ (1 ms, 15 µA) การที่อิเล็กโทรดสัมผัสกับโปรโตคอลการเต้นเป็นจังหวะต่อเนื่องที่ดำเนินการโดย 100 รอบโวลแทมเมทรีแบบไซคลิก (−0.9 ถึง +0.8 V) ที่ 50 mV s-1, 20 ครั้งด้วยพัลส์ 5,000 ครั้ง (1 ms) และการกำหนดศักย์ไฟฟ้าของวงจรเปิดใหม่
การวิเคราะห์ข้อมูล
ข้อมูลลักษณะทางเคมีไฟฟ้าได้รับการวิเคราะห์โดยใช้แพ็คเกจ Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib) ข้อมูลอิมพีแดนซ์สเปกโทรสโกปีถูกติดตั้งเข้ากับแบบจำลองทางไฟฟ้าที่เทียบเท่ากันซึ่งประกอบด้วยความต้านทาน (R) อนุกรมกับองค์ประกอบเฟสคงที่ (CPE) จากนั้น ค่า CPE จะถูกประมาณค่าความจุและหารด้วยพื้นที่เรขาคณิตของไมโครอิเล็กโทรด เพื่อให้ได้ค่าที่เท่ากันสำหรับความจุระหว่างพื้นผิวของ EGNITE ความจุการเก็บประจุของอิเล็กโทรดไมโครอิเล็กโทรด (CSC) คำนวณจากการวัดโวลแทมเมทรีแบบวนโดยการบูรณาการระบบแคโทดและขั้วบวกของกระแสที่วัดได้และทำให้เป็นมาตรฐานด้วยอัตราการสแกน ความจุการจัดเก็บประจุแคโทดและขั้วบวก (cCSC และ aCSC) ที่อัตราการสแกน 100 mV ของ EGNITE คือ 45.9 ± 2.4 และ 34.6 ± 2.8 mC cm-2ตามลำดับ (n = 3). ตามที่รายงานสำหรับวัสดุอื่น ๆ58CSC ที่ได้รับขึ้นอยู่กับอัตราการสแกน (รูปที่เสริม 5). เพื่อประเมินการมีอยู่ของปฏิกิริยาการลดออกซิเจน เราได้วัดรูปคลื่น CV ภายใต้อิเล็กโทรไลต์ที่กำจัดไนโตรเจน59 และไม่สังเกตเห็นความแตกต่างอย่างมีนัยสำคัญในรูปคลื่น (รูปที่ 2 เพิ่มเติม) 6). อย่างไรก็ตาม ผลลัพธ์ของเราไม่ได้ระบุถึงผลกระทบของปฏิกิริยาการลดออกซิเจนต่อความสามารถในการฉีดประจุของ EGNITE ได้อย่างสมบูรณ์ และจำเป็นต้องทำงานเพิ่มเติมเพื่อตรวจสอบเรื่องนี้อย่างเหมาะสม ความสามารถในการฉีดประจุของไมโครอิเล็กโทรด (CIC) ถูกกำหนดโดยการกำหนดแอมพลิจูดของพัลส์ปัจจุบันที่ทำให้เกิดแรงดันไฟฟ้าที่แตกต่างกัน (หลังจากเอาการตกของโอห์มมิกออกแล้ว) ที่ตรงกับหน้าต่างน้ำเคมีไฟฟ้าของอิเล็กโทรด (−0.9 V สำหรับแคโทดและ +0.8 V สำหรับขั้วบวกเทียบกับ Ag/AgCl ) (รูปที่เสริม 17)60.
การวิเคราะห์ทางสถิติ
ข้อมูลมีค่าเฉลี่ย ± s.d. n = 18 สำหรับ EIS และ n = 3 สำหรับโครโนโพเทนชิโอมิเตอร์ ข้อมูลของแผนที่การเคลื่อนที่ของแรงดันไฟฟ้าแบบคาโทดิกคือค่าเฉลี่ยของการเคลื่อนที่ของแรงดันไฟฟ้าแบบคาโธดิกสำหรับเหตุการณ์หนึ่งสำหรับรูปร่างพัลส์แต่ละรูปของ n = 3 อิเล็กโทรด
การประเมินเสถียรภาพทางกล
อัลตราซาวนด์ sonication
อาร์เรย์อิเล็กโทรด EGNITE ถูกวางไว้ในบีกเกอร์ที่เต็มไปด้วยน้ำในอ่างน้ำอัลตราซาวนด์ (Elmasonic P 180H) Sonication ถูกนำมาใช้ที่ 37 kHz เป็นเวลา 15 min ที่ 200 W และตามด้วยเสียง Sonication เพิ่มเติมอีก 15 min ที่ 37 kHz โดยมีกำลังเพิ่มขึ้นเป็น 300 W ภาพอิเล็กโทรดได้รับมาก่อนและหลังขั้นตอนการ Sonication
การทดสอบการดัด
การตั้งค่าการดัดงอ (รูปที่. 2k) ประกอบด้วยแท่งทรงกระบอกสามแท่ง ส่วนตรงกลาง (เส้นผ่านศูนย์กลาง 700 µm) ถูกลดระดับลง ทำให้มีมุมโค้งงอ 131° มีการใช้อาร์เรย์ไมโครอิเล็กโทรดแบบยืดหยุ่นสามตัวสำหรับการทดสอบการดัดงอ แต่ละอาร์เรย์มีไมโครอิเล็กโทรด 18 ตัวที่มีเส้นผ่านศูนย์กลาง 50 µm มีการวัดอาเรย์สองชุดหลังจาก 10 และ 20 รอบ ในขณะที่อุปกรณ์หนึ่งวัดเพียง 10 รอบเท่านั้น เนื่องจากได้รับความเสียหายระหว่างการจัดการหลังการวัด รอบการทดสอบการดัดงอประกอบด้วยการใช้งานโหลดนาน 10 วินาทีบวก 10 วินาทีโดยไม่มีโหลด อุปกรณ์มีลักษณะเฉพาะทางเคมีไฟฟ้า (EIS และ CV) ก่อนและหลังรอบการดัดงอ 10 และ 20 รอบ
การบันทึกประสาทแบบ Epicortical
การฝังแบบ Epicortical
ขั้นตอนการทดลองทั้งหมดได้ดำเนินการตามคำแนะนำของสภาประชาคมยุโรปและกฎหมายของฝรั่งเศสสำหรับการดูแลและการใช้สัตว์ทดลอง ระเบียบการได้รับการอนุมัติโดยคณะกรรมการจริยธรรมเกรอน็อบล์ (ComEth) และได้รับอนุญาตจากกระทรวงฝรั่งเศส (หมายเลข 04815.02) หนู Sprague–Dawley (ตัวผู้ อายุ 4 เดือน ชั่งน้ำหนัก -600 ไมโครกรัม) ถูกดมยาสลบในกล้ามเนื้อด้วยคีตามีน (50 ไมโครกรัมต่อกิโลกรัม (น้ำหนักตัว)) และไซลาซีน (10 ไมโครกรัมต่อกิโลกรัม (น้ำหนักตัว)) และจากนั้นจับจ้องไปที่ตัวยึดสเตอริโอแท็กซี่ การถอดกะโหลกศีรษะขมับออกจะเผยให้เห็นเปลือกสมองส่วนการได้ยิน Dura mater ถูกเก็บรักษาไว้เพื่อหลีกเลี่ยงความเสียหายต่อเนื้อเยื่อเยื่อหุ้มสมอง มีการเจาะรูที่จุดยอดเพื่อใส่อิเล็กโทรดอ้างอิง และเจาะรูที่สอง 7 มม. ไปทางด้านหน้าจากรูแรกเพื่อใส่อิเล็กโทรดกราวด์ อิเล็กโทรดเป็นพินหนา 0.5 มม. ใช้สำหรับช่องเสียบวงจรรวม พวกเขาถูกวางไว้เพื่อสัมผัสทางไฟฟ้ากับดูราเมเตอร์และยึดเข้ากับกะโหลกศีรษะด้วยซีเมนต์ทันตกรรม จากนั้นเราติดริบบิ้นไมโครอิเล็กโทรดพื้นผิวบนเปลือกการได้ยินดังแสดงในรูปที่ XNUMX 3b. รูปแบบของหลอดเลือดดำระบุเยื่อหุ้มสมองการได้ยินในพื้นที่ 41 ของแผนที่สมองหนูของ Krieg สัญญาณเยื่อหุ้มสมองถูกขยายไปพร้อมกันด้วยอัตราขยาย 1,000 และแปลงเป็นดิจิทัลที่อัตราการสุ่มตัวอย่าง 33 kHz ลำโพงขนาด 20 ซม. ที่อยู่ด้านหน้าหูของหนู ซึ่งอยู่ตรงข้ามกับเยื่อหุ้มสมองที่โผล่ออกมา ทำหน้าที่กระตุ้นทางเสียง สิ่งเร้าที่ส่งไปได้รับการตรวจสอบโดยไมโครโฟนขนาด 0.25 นิ้ว (Brüel & Kjaer, 4939) วางไว้ใกล้หูและนำเสนอในระดับความดันเสียง (dB SPL re 20 μPa) เราตรวจสอบการตอบสนองเวลาแฝงกลางจุดยอดบวก (ลบขึ้น) เกิดขึ้นโดยการคลิกที่สลับกันที่ 80 dB SPL และสิ่งเร้าระเบิดโทนเสียงที่ 70 dB SPL ด้วยความถี่ตั้งแต่ 5 ถึง 40 kHz เวลาขึ้นและลงที่ 5 ms และ ระยะเวลา 200 ms
การวิเคราะห์ข้อมูล
ข้อมูลทางไฟฟ้าสรีรวิทยาได้รับการวิเคราะห์โดยใช้แพ็คเกจ Python 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) และไลบรารีที่กำหนดเอง PhyREC (https://github.com/aguimera/PhyREC). rms ค่าถูกคำนวณด้วยหน้าต่างเลื่อน 20 ms ที่ความถี่สูงกว่า 200 Hz สเปกโตรแกรมถูกคำนวณสำหรับช่วงระหว่าง 70 Hz และ 1.1 kHz PSD ได้รับการคำนวณมากกว่า 60 s ของการบันทึกต่อเนื่อง สำหรับอาร์เรย์อิเล็กโทรดที่กำหนด จะมีการคำนวณ PSD สองตัว: ในสิ่งมีชีวิต (IV) และหลังชันสูตร (PM) SNR แสดงเป็น dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) และประมาณค่า 20 จุด โดยเว้นระยะห่างแบบลอการิทึมระหว่าง 10 Hz และ 1 kHz
การวิเคราะห์ทางสถิติ
ข้อมูลประสาท Epicortical แสดงในรูปที่ 1 3 นำมาจากการวัดแต่ละตัวในสัตว์ตัวเดียว ในรูป 3cนำเสนอข้อมูลจากอิเล็กโทรด 64 อิเล็กโทรด ในรูป 3dข้อมูลจากอิเล็กโทรดที่เลือกสองอันจะถูกนำเสนอ ในรูป 3f, PSD และ SNR คำนวณจากอิเล็กโทรด EGNITE 64 อิเล็กโทรด และแสดงเป็นค่าเฉลี่ย ± s.d ในรูปเสริม 12ค,ง ข้อมูลค่ามัธยฐานจะถูกนำเสนอสำหรับอิเล็กโทรด EGNITE 192 อิเล็กโทรดจาก n = 3 การทดลองและอิเล็กโทรดแพลทินัม 60 อันจาก n = 1 การทดลอง
การบันทึกระบบประสาทภายใน
การฝังในเยื่อหุ้มสมอง
สัตว์ได้รับการดมยาสลบด้วยส่วนผสมของคีตามีน/ไซลาซีน (75:1, 0.35 มล./28 g ip.) และสถานะนี้ถูกรักษาไว้ด้วยหน้ากากสำหรับการสูดดมซึ่งมีไอโซฟลูเรน 1.5% ไมโครสกรูหลายตัวถูกใส่เข้าไปในกะโหลกศีรษะเพื่อรักษาความมั่นคงของการปลูกถ่าย และใช้ไมโครสกรูที่อยู่ด้านบนของสมองน้อยเป็นพื้นดินทั่วไป โพรบถูกฝังในเยื่อหุ้มสมองส่วนหน้า (พิกัด: AP, 1.5 mm; ML, ±0.5 mm; DV, −1.7 mm จาก bregma) การฝังดำเนินการโดยการเคลือบโพรบด้วยมอลโตส (ดูเกณฑ์วิธีด้านล่าง) เพื่อให้โพรบมีความแข็งชั่วคราวและอำนวยความสะดวกในการใส่โพรบ โพรบถูกปิดผนึกด้วยซีเมนต์ทันตกรรม ตัวเชื่อมต่อ TDT-ZifClip ใช้เพื่อเชื่อมต่อโพรบกับระบบไฟฟ้าสรีรวิทยาผ่านสายเคเบิลขนาดเล็ก หลังการผ่าตัด หนูจะพักฟื้นเป็นเวลา 1 สัปดาห์ โดยได้รับการรักษาด้วยยาแก้ปวด (บูพรีนอร์ฟีน) และยาแก้อักเสบ (มีลอกซิแคม) กิจกรรมของระบบประสาทถูกบันทึกด้วยระบบ Open Ephys หลายช่องสัญญาณที่อัตราการสุ่มตัวอย่าง 30 kHz ด้วยเครื่องขยายสัญญาณ Intan RHD2132 การทดลองงานด้านการได้ยินดำเนินการในกล่องกันเสียง โดยมีวิทยากรสองคนอยู่ข้างในโดยใช้โปรโตคอลตามงานที่อธิบายไว้ก่อนหน้านี้61. การกระตุ้นด้วยเสียงประกอบด้วยการคลิกเสียงสีขาวยาว 15 มิลลิวินาที ทำซ้ำ 100 ครั้ง (รอบ) โดยแต่ละครั้งคั่นด้วย 5 s (ช่วงระหว่างการกระตุ้น) ในระหว่างภารกิจ สัตว์สามารถเคลื่อนไหวได้อย่างอิสระ
โปรโตคอลการทำให้แข็งตัวของมอลโตส
สารละลายมอลโตสที่เป็นน้ำจะถูกให้ความร้อนจนถึงจุดเปลี่ยนสถานะคล้ายแก้ว (Tg) ระหว่าง 130 ถึง 160 °C โดยใช้จานร้อนหรือไมโครเวฟ เมื่อมอลโตสมีความหนืด ด้านหลังของโพรบจะสัมผัสกับมอลโตสเท่านั้น เมื่อมอลโตสเย็นลง โพรบจะแข็งตัวและทำให้แข็งขึ้น
การวิเคราะห์ข้อมูล
สัญญาณประสาทจากอิเล็กโทรดแต่ละตัวถูกกรองแบบออฟไลน์เพื่อแยก SUA และ LFP SUA ถูกประเมินโดยการกรองสัญญาณระหว่าง 450 ถึง 6,000 Hz และเดือยจากเซลล์ประสาทแต่ละตัวถูกจัดเรียงโดยใช้การวิเคราะห์องค์ประกอบหลักด้วย Offline Sorter v.4 (Plexon) ในการรับ LFP สัญญาณจะถูกลดขนาดลงเป็น 1 kHz, ลดแนวโน้มและกรองรอยบากเพื่อลบสิ่งรบกวนของเส้นสัญญาณรบกวน (50 Hz และฮาร์โมนิกของมัน) ด้วยสคริปต์ที่เขียนแบบกำหนดเองใน Python AEP SNR คำนวณเป็นอัตราส่วนของแอมพลิจูด N1 สูงสุดและ sd ในช่วงเวลา 20 ms ก่อนเกิดการกระตุ้น
การวิเคราะห์ทางสถิติ
ข้อมูลที่แสดงในรูปที่. 3 ชม. ฉัน มีค่าเฉลี่ย ± s.d. n = 30 คือจำนวนการทดลองโดยเฉลี่ย ข้อมูลที่บันทึกจากอิเล็กโทรดเดียวกันจะแสดงในวันที่ 30, 60 และ 90 ข้อมูลจากสัตว์ตัวเดียวจะถูกนำเสนอ
ความเข้ากันได้ทางชีวภาพของ Epicortical แบบเรื้อรัง
การฝังอุปกรณ์โดยการผ่าตัด
การศึกษานี้ใช้หนู Sprague – Dawley ผู้ใหญ่ เพศผู้ จำนวน 27 ตัว (แม่น้ำชาร์ลส์) สัตว์ถูกเลี้ยงไว้ที่อุณหภูมิแวดล้อม 21 ± 2 °C และความชื้น 40–50% บนวงจรมืด 12 h/12 h หนูถูกเลี้ยงเป็นกลุ่มและได้รับอาหารและน้ำฟรีตลอดระยะเวลาการทดลอง ขั้นตอนการทดลองดำเนินการตามกฎหมายสวัสดิภาพสัตว์ (1998) ภายใต้การอนุมัติของสำนักงานที่บ้านในสหราชอาณาจักรและหน่วยงานตรวจสอบจริยธรรมสวัสดิภาพสัตว์ในท้องถิ่น (AWERB) สัตว์ได้รับการดมยาสลบด้วยไอโซฟลูเรน (2–3%) ตลอดระยะเวลาของการผ่าตัด และความลึกของการดมยาสลบได้รับการตรวจสอบโดยการทดสอบแบบสะท้อนการบีบนิ้วเท้า สัตว์ถูกวางไว้ในโครง Stereotaxic (Kopf, 900LS) ซึ่งอยู่เหนือผ้าห่มระบายความร้อนเพื่อรักษาอุณหภูมิของร่างกาย หลุมเปิดกะโหลกศีรษะ (-5 มม. ×4 มม.) ถูกสร้างขึ้นให้ห่างจากเส้นกึ่งกลาง 1 มม. โดยใช้สว่านทันตกรรมที่มีดอกสว่านเสี้ยน 0.9 มม. ดูราถูกถอดออก และวางอุปกรณ์เอพิคอร์ติคอลบนพื้นผิวเยื่อหุ้มสมองของสมอง การผ่าตัดเปิดกะโหลกศีรษะปิดด้วยควิกซิล ตามด้วยซีเมนต์ทันตกรรมเพื่อยึด และเย็บปิดผิวหนัง ฉีดน้ำเกลือใต้ผิวหนัง (1 มล. ต่อกิโลกรัม (น้ำหนักตัว)) และบูพรีนอร์ฟีน (0.03 มก.ต่อกก. (น้ำหนักตัว)) เพื่อทดแทนของเหลวที่สูญเสียไปและลดความเจ็บปวดหลังการผ่าตัด และถอนการระงับความรู้สึก
การรวบรวมและการแปรรูปเนื้อเยื่อ
สัตว์ถูกยุติที่ 2, 6 หรือ 12 สัปดาห์หลังการปลูกถ่ายโดยวิธีการที่เหมาะสมสำหรับประเภทของการวิเคราะห์ที่จะดำเนินการ
มิญชวิทยาและอิมมูโนฮิสโตเคมี
ที่ 2, 6 หรือ 12 สัปดาห์ของหนูหลังการปลูกถ่ายถูกยกเลิกโดยกระแสเลือดไปเลี้ยงหัวใจด้วยเฮพารินไนซ์ (10 U มล.-1, Sigma-Aldrich) PBS ตามด้วยพาราฟอร์มัลดีไฮด์ 4% (PFA, Sigma-Aldrich) ใน PBS สมองถูกตรึงภายหลังใน 4% PFA เป็นเวลา 24 h จากนั้นจึงถ่ายโอนไปยังซูโครส 30% ใน PBS เป็นเวลาอย่างน้อย 48 h ก่อนที่จะแช่แข็งในไอโซเพนเทน จากนั้น สมองจะถูกเก็บไว้ที่ −80 °C จนกระทั่งถูกแช่แข็งที่ 25 µm จากนั้นเนื้อเยื่อจะถูกย้อมสำหรับอะแดปเตอร์จับแคลเซียมที่แตกตัวเป็นไอออนโมเลกุล 1 (Iba-1) เพื่อกำหนดระดับการกระตุ้นการทำงานของจุลชีพ โดยสรุป ส่วนเนื้อเยื่อถูกปิดกั้นด้วยซีรัมแพะ 5% ใน PBS ที่มีไทรทัน-X 0.1% เป็นเวลา 1 ชั่วโมงก่อนการฟักตัวข้ามคืนที่ 4 °C ด้วยแอนติบอดีปฐมภูมิแอนติ-Iba-1 (1:1,000, 019-19741; Wako) จากนั้นส่วนต่างๆ ถูกย้อมด้วยแอนติบอดีทุติยภูมิ, ต่อต้านกระต่าย Alexa Fluor 594 (1:400, A-11012; เทอร์โมฟิชเชอร์) เป็นเวลา 1 ชั่วโมงที่อุณหภูมิห้อง สไลด์ถูกติดตั้งด้วยแผ่นปิดโดยใช้สื่อการติดตั้งป้องกันการเฟดของ Prolong Gold พร้อมด้วย 4,6-diamidino-2-phenylindole (เทอร์โม ฟิชเชอร์) โพรบครอบคลุมพื้นที่ 3 × 3.7 มม2 บนพื้นผิวเยื่อหุ้มสมองของสมอง ส่วนเนื้อเยื่อที่เลือกสำหรับการย้อมสีครอบคลุมความยาว 3.2 มม. ของบริเวณนี้ สไลด์ถูกถ่ายภาพโดยใช้เครื่องสแกนสไลด์ด้วยกล้องจุลทรรศน์ 3DHistech Pannoramic-250 ที่ 20× และวิเคราะห์ภาพโดยใช้ CaseViewer v.2.4 (3DHistech) เพื่อประเมินการกระตุ้นไมโครเกลีย พื้นที่ 3.2 มม. ถูกครอบคลุม โดยมีหนึ่งภาพวิเคราะห์ทุกๆ 100 µm ภาพถูกถ่ายโดยใช้กำลังขยาย 8.5 เท่า ซึ่งมีรายละเอียดส่วนของตำแหน่งหัวตรวจอีพิคอร์ติคอล ซึ่งอยู่ห่างจากเส้นกึ่งกลางของสมอง 3 มม. ครอบคลุมพื้นที่ใต้ตำแหน่งหัววัดโดยตรง
การประมวลผลภาพ
ข้อมูลกล้องจุลทรรศน์ได้รับการประมวลผลภาพโดยใช้อัลกอริธึมสำหรับการระบุลักษณะฟีโนไทป์ของ microglia (รูปที่ 2 เพิ่มเติม) 13). การกระตุ้นจุลินทรีย์ถูกวิเคราะห์โดยใช้ CellProfiler* แบบกำหนดเอง (Broad Institute, v.3.1.9 จาก https://cellprofiler.org/) ไปป์ไลน์ ประการแรก โมดูล EnhanceOrSuppressFeatures ถูกนำมาใช้เพื่อปรับปรุงโครงสร้างเส้นใย เช่น นิวไรต์ โดยการใช้วิธีเพิ่มประสิทธิภาพความเป็นท่อ จากรูปภาพที่ได้รับการปรับปรุง เซลล์ถูกแบ่งส่วนโดยใช้โมดูล IdentifyPrimaryObjects การวัดเบื้องต้นของเซลล์แนะนำว่าช่วงเส้นผ่านศูนย์กลางของวัตถุที่เหมาะสมคือ 3–40 พิกเซล วัตถุที่อยู่นอกช่วงเส้นผ่านศูนย์กลางนี้หรือสัมผัสขอบของภาพจะถูกทิ้งไป เซลล์ถูกแบ่งส่วนโดยใช้กลยุทธ์การกำหนดเกณฑ์แบบปรับตัวของ Otsu สองชั้นด้วยขนาดหน้าต่างแบบปรับได้ที่ 50 พิกเซล ออบเจ็กต์ที่ระบุโดยโมดูล IdentifyPrimaryObjects จะถูกป้อนเข้าสู่โมดูล MeasureObjectSizeShape เพื่อคำนวณคุณสมบัติที่จำเป็นสำหรับการจำแนกประเภทเซลล์ ในโมดูล ClassifyObjects หมวดหมู่ที่มีการระบุการจำแนกประเภทพื้นฐานให้เป็น AreaShape และเลือกขอบเขตเป็นการวัดที่สอดคล้องกัน เซลล์ถูกจัดประเภทเป็น 'เปิดใช้งาน' หรือ 'ไม่เปิดใช้งาน' ตามคุณสมบัติขอบเขต ซึ่งเป็นอัตราส่วนของพื้นที่ที่เซลล์ครอบครองต่อพื้นที่ที่ถูกครอบครองโดยกล่องขอบเขต วิธีการจำแนกประเภทนี้มีเหตุผลจากข้อเท็จจริงที่ว่า microglia ที่ถูกกระตุ้นนั้นมีเซลล์ขนาดใหญ่และไม่มีกระบวนการ ดังนั้นจึงใช้สัดส่วนของกรอบขอบเขตที่ใหญ่กว่ามากเมื่อเทียบกับเซลล์ที่ไม่ได้กระตุ้น สุดท้ายนี้ โมดูล CalculateMath และ ExportToSpreadsheet ถูกนำมาใช้ในการคำนวณและส่งออกสถิติที่ต้องการ
การวิเคราะห์ทางสถิติ
ชุดข้อมูลได้แก่ n = 3 สำหรับอุปกรณ์แต่ละประเภท (การปลูกถ่าย PI เท่านั้น (PI); PI ที่มีทองคำที่ทำด้วยไมโครแฟบริเคทแบบเปลือย (ทองคำ) และ PI ที่มีทองคำที่ทำด้วยไมโครแฟบริเคทและ EGNITE (EGNITE) ตลอดเวลา) ยกเว้นทองคำที่ 6 สัปดาห์ซึ่งก็คือ n = 2 สำหรับข้อมูล ELISA ซีกโลกด้านตรงข้ามถูกรวมเข้าด้วยกันในแต่ละช่วงเวลาเพื่อให้ n = 9 ที่ 2 และ 12 สัปดาห์หลังการปลูกถ่าย และ n = 8 ที่ 6 สัปดาห์หลังการปลูกถ่าย การวิเคราะห์ข้อมูลเสร็จสิ้นโดยใช้ซอฟต์แวร์ GraphPad Prism v.8 การวิเคราะห์ทางสถิติเสร็จสมบูรณ์โดยใช้การวิเคราะห์ความแปรปรวน (ANOVA) แบบสองทางด้วยการทดสอบการเปรียบเทียบพหุคูณของ Tukey ตามความเหมาะสม P < 0.05 ถือว่ามีนัยสำคัญ
วิธี ELISA
หลังจากระยะเวลาการปลูกถ่าย สัตว์ถูกยุติโดยการเคลื่อนที่ของปากมดลูก เนื้อเยื่อสมองถูกสกัดจากสมองซีกขวาและซ้าย แช่แข็งในไนโตรเจนเหลว และเก็บไว้ที่ −80 °C จนกระทั่งนำไปใช้ต่อไป เนื้อเยื่อถูกสลายโดยใช้บัฟเฟอร์สลาย NP-40 (NaCl 150 mM, Tris-Cl 50 mM, สารทดแทน Nonidet P1 40%, Fluka, pH ปรับเป็น 7.4) ที่มีโปรตีเอสและตัวยับยั้งฟอสฟาเตส (ค็อกเทลตัวยับยั้งโปรตีเอสและฟอสฟาเตส, เทอร์โม ฟิชเชอร์) ตามด้วยการหยุดชะงักทางกลไกของเนื้อเยื่อ (TissueLyser LT, Qiagen) จากนั้นตัวอย่างถูกปั่นแยกเป็นเวลา 10 นาทีที่ 5,000 รอบต่อนาที และส่วนลอยเหนือตะกอนเก็บไว้ที่ 4 °C จนกระทั่งใช้งานต่อไป แผงการอักเสบของหนู LEGENDplex (หมายเลขแค็ตตาล็อก 740401, BioLegend) ซึ่งเป็นชุด ELISA แบบมัลติเพล็กซ์แบบบีดถูกดำเนินการเพื่อหาปริมาณไซโตไคน์ต่อไปนี้ IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), แกรนูโลไซต์–การกระตุ้นอาณานิคมมาโครฟาจ ปัจจัย, อินเตอร์เฟอรอน-γ และปัจจัยเนื้อร้ายของเนื้องอก ชุดอุปกรณ์ดำเนินการตามคำแนะนำของผู้ผลิต โดยมีโปรตีนบรรจุอยู่ที่ปริมาตรคงที่ 15 µl หลังจากการบ่มด้วยส่วนลอยเหนือตะกอน เม็ดบีดถูกรันบนโฟลว์ไซโตมิเตอร์ BD FACSVerse และข้อมูลถูกวิเคราะห์โดยใช้ซอฟต์แวร์การวิเคราะห์ข้อมูล LEGENDplex
การกระตุ้นประสาท
การฝัง Intrafascicular
การทดลองกับสัตว์ทั้งหมดได้รับการอนุมัติโดยคณะกรรมการจริยธรรมของ Universitat Autònoma de Barcelona ตามคำสั่งของ European Communities Council Directive 2010/63/EU สัตว์ถูกเลี้ยงไว้ที่อุณหภูมิ 22 ± 2 °C ภายใต้แสง 12 h/12 h รอบความมืด โดยมีอาหารและน้ำหาได้ฟรี เส้นประสาทไขสันหลังของหนู Sprague–Dawley ตัวเมียที่ถูกดมยาสลบ (250–300 g, -อายุ 18 สัปดาห์) ได้รับการผ่าตัด และอิเล็กโทรด TIME ถูกปลูกฝังตามขวางข้ามเส้นประสาทไซอาติกด้วยความช่วยเหลือของเข็มตรงที่ติดอยู่กับเกลียว 10-046. กระบวนการนี้ได้รับการตรวจสอบภายใต้กล้องจุลทรรศน์แบบผ่าเพื่อให้แน่ใจว่าตำแหน่งที่ถูกต้องของตำแหน่งที่ออกฤทธิ์ภายในพังผืดเส้นประสาท (รูปที่. 4b). ในระหว่างการทดลอง อุณหภูมิร่างกายของสัตว์จะถูกรักษาไว้ด้วยแผ่นทำความร้อน
การกระตุ้นเส้นประสาทดำเนินการโดยการใช้ขบวนของพัลส์กระแสไฟฟ้าแบบไบเฟสซิกที่มีระยะเวลาคงที่ 100 µs ต่อเฟส และเพิ่มแอมพลิจูดจาก 0 ถึง 150 µA ในขั้น 1 หรือ 3 µA ที่ 3 Hz เป็นเวลา 33 s (เครื่องกระตุ้น DS4, Digitimer) ผ่าน EGNITE ที่แตกต่างกัน ไมโครอิเล็กโทรด พร้อมกัน CMAP ถูกบันทึกจากกล้ามเนื้อ GM, TA และ PL โดยใช้อิเล็กโทรดเข็มขนาดเล็ก (ยาว 13 มม., เส้นผ่านศูนย์กลาง 0.4 มม., อิเล็กโทรดเข็มสแตนเลส A-03-14BEP, ไบโอนิค) วางอยู่ในกล้ามเนื้อแต่ละอัน62. อิเล็กโทรดแบบแอคทีฟถูกวางไว้บนหน้าท้องของกล้ามเนื้อและอ้างอิงที่ระดับเอ็น การบันทึกด้วยไฟฟ้ากล้ามเนื้อถูกขยาย (×100 สำหรับ GM และ TA, ×1,000 สำหรับ PL; แอมพลิฟายเออร์ P511AC, หญ้า), กรองแบนด์พาส (3 Hz ถึง 3 kHz) และแปลงดิจิทัลด้วยระบบบันทึก PowerLab (PowerLab16SP, ADInstruments) ที่ 20 kHz
การวิเคราะห์ข้อมูล
แอมพลิจูดของแต่ละ CMAP วัดจากเส้นฐานถึงจุดสูงสุดที่เป็นลบสูงสุด การวัดค่าแรงดันไฟฟ้าสูงสุดถูกทำให้เป็นมาตรฐานเป็นแอมพลิจูด CMAP สูงสุดที่ได้รับสำหรับกล้ามเนื้อแต่ละมัดในการทดลอง ดัชนีการเลือก (SI) ถูกคำนวณสำหรับแต่ละตำแหน่งที่ทำงานเป็นอัตราส่วนระหว่างแอมพลิจูด CMAP ที่ทำให้เป็นมาตรฐานสำหรับกล้ามเนื้อหนึ่งมัด CMAPiและผลรวมของแอมพลิจูด CMAP ที่ทำให้เป็นมาตรฐานในกล้ามเนื้อทั้งสาม ตามสูตร SIi = nWCPAi/∑nWCPAjที่แอมพลิจูดกระแสกระตุ้นขั้นต่ำที่กระตุ้นการตอบสนองของกล้ามเนื้อที่เกี่ยวข้องกับการทำงานขั้นต่ำ (กำหนดเป็นแอมพลิจูด CMAP อย่างน้อย 5% สำหรับหนึ่งในกล้ามเนื้อโดยคำนึงถึงแอมพลิจูด CMAP สูงสุดของกล้ามเนื้อนั้นที่ถูกกำหนดไว้ก่อนหน้านี้) จากนั้น ตำแหน่งที่มี SI สูงสุดสำหรับกล้ามเนื้อแต่ละมัดจากทั้งสามส่วนจะถูกเลือกเป็น SI สำหรับกล้ามเนื้อแต่ละมัดในการทดลองที่กำหนด
ความเข้ากันได้ทางชีวภาพภายในระบบประสาทแบบเรื้อรัง
ตามขั้นตอนที่รายงานไว้ก่อนหน้านี้50,63, เส้นประสาทไซอาติกของหนูเพศเมีย Sprague–Dawley ที่ได้รับการดมยาสลบ (250-300 g, -อายุ 18 สัปดาห์) ถูกเปิดเผยและอุปกรณ์สำหรับความเข้ากันได้ทางชีวภาพ ภายในร่างกาย ที่มีและไม่มี EGNITE ถูกปลูกฝังตามยาวในสาขากระดูกหน้าแข้งของเส้นประสาทไซแอติก (n = 6–8 ต่อกลุ่ม) โดยสรุป เส้นประสาทถูกเจาะที่ trifurcation โดยใช้เข็มตรงติดอยู่กับเกลียว 10-0 (STC-6, Ethicon) ด้ายจะดึงปลายรูปลูกศรของแถบอิเล็กโทรดที่โค้งงอ ปลายถูกตัดเพื่อดึงด้ายออก และปลายแขนแต่ละข้างงอเล็กน้อยเพื่อหลีกเลี่ยงการหลุดออกจากอุปกรณ์ เลือกใช้การปลูกถ่ายตามยาวเนื่องจากช่วยให้สามารถศึกษาการตอบสนองของร่างกายต่อสิ่งแปลกปลอมภายในเส้นประสาทได้ดีขึ้น50.
การประเมินการทำงานของเส้นประสาทและสัตว์
สัตว์ได้รับการประเมินในระหว่างการติดตามผลหลังการปลูกถ่ายโดยวิธีการทดสอบการนำกระแสประสาท การวัดความสามารถในการวิเคราะห์และการเคลื่อนที่ของทางเดิน62. สำหรับการทดสอบการนำไฟฟ้า เส้นประสาทไซอาติกของอุ้งเท้าที่ฝังและอุ้งเท้าด้านตรงข้ามถูกกระตุ้นด้วยอิเล็กโทรดแบบเข็มที่รอยบากไซอาติก และ CMAP ของกล้ามเนื้อ PL ได้รับการบันทึกดังข้างต้น วัดเวลาแฝงและแอมพลิจูดของ CMAP สำหรับการทดสอบการวัดค่าความคลาดเคลื่อน หนูจะถูกวางบนแท่นที่มีตะแกรงลวด และใช้การกระตุ้นเชิงกลที่ไม่เป็นพิษกับปลายโลหะที่เชื่อมต่อกับเครื่องวัดความลึกแบบอิเล็กทรอนิกส์ Von Frey (Bioseb) เกณฑ์การรับความรู้สึกเจ็บปวด (แรงเป็นกรัมที่สัตว์ถอนอุ้งเท้า) ของอุ้งเท้าที่ปลูกถ่ายเทียบกับอุ้งเท้าด้านตรงข้ามถูกวัด สำหรับการทดสอบทางเดินเท้า พื้นผิวฝ่าเท้าของอุ้งเท้าหลังถูกทาด้วยหมึกสีดำ และปล่อยให้หนูแต่ละตัวเดินไปตามทางเดิน มีการรวบรวมรอยเท้าและคำนวณดัชนีการทำงานของไซแอติก62.
จุลกายวิภาคศาสตร์เนื้อเยื่อ
หลังจากผ่านไป 2 หรือ 8 สัปดาห์ สัตว์จะถูกรวมเข้ากับ PFA (4%) และเส้นประสาทไซแอติกถูกเก็บเกี่ยว หลังการตรึง เก็บรักษาด้วยการแช่แข็ง และประมวลผลสำหรับการวิเคราะห์ทางเนื้อเยื่อวิทยา สำหรับการประเมิน FBR เส้นประสาทไซแอติกถูกตัดในส่วนขวางที่มีความหนา 15 ไมโครเมตรด้วยเครื่องแช่แข็ง (Leica CM190) ตัวอย่างถูกย้อมด้วยแอนติบอดีปฐมภูมิสำหรับแอกซอนไมอีลิน (แอนติ-RT97 เพื่อติดฉลาก NeuroFIlament 200K, 1:200; Developmental Studies Hybridoma Bank) และมาโครฟาจ (แอนติ-Iba-1, 1:500; Wako) จากนั้น ส่วนต่างๆ ถูกบ่มเป็นเวลา 1 ชั่วโมงที่อุณหภูมิห้องด้วยแอนติบอดีทุติยภูมิที่ต้านหนูเมาส์ Alexa Fluor 488 และหนูที่ต้านกระต่าย Alexa Fluor 555 (1:200, Invitrogen) เลือกส่วนที่เป็นตัวแทนจากส่วนกลางของการปลูกถ่ายในเส้นประสาท tibial ภาพที่ถ่ายด้วยกล้องจุลทรรศน์ epifluorescence (Eclipse Ni, Nikon) ที่ติดกับกล้องดิจิตอล (DS-Ri2, Nikon) และการวิเคราะห์ภาพที่ดำเนินการด้วยซอฟต์แวร์ ImageJ (สถาบันแห่งชาติ ด้านสุขภาพ) ปริมาณของเซลล์ที่เป็นบวก Iba-1 ในพื้นที่ทั้งหมดของเส้นประสาทหน้าแข้งถูกวัดปริมาณและวัดความหนาของแคปซูลเนื้อเยื่อเป็นระยะทางเฉลี่ยของแต่ละด้านของการปลูกถ่ายไปยังแอกซอนที่ใกล้ที่สุด
การวิเคราะห์ทางสถิติ
สำหรับการวิเคราะห์ข้อมูลทางสถิติ เราใช้การวิเคราะห์ความแปรปรวนแบบทางเดียวหรือสองทาง ตามด้วยการทดสอบหลังการทดสอบของ Bonferroni เพื่อดูความแตกต่างระหว่างกลุ่มหรือเวลา ซอฟต์แวร์ GraphPad Prism ใช้สำหรับการแสดงและวิเคราะห์กราฟิก นัยสำคัญทางสถิติได้รับการพิจารณาเมื่อใด P <0.05.
สรุปการรายงาน
ข้อมูลเพิ่มเติมเกี่ยวกับการออกแบบการวิจัยมีอยู่ใน สรุปการรายงานผลงาน Nature เชื่อมโยงกับบทความนี้
- เนื้อหาที่ขับเคลื่อนด้วย SEO และการเผยแพร่ประชาสัมพันธ์ รับการขยายวันนี้
- PlatoData.Network Vertical Generative Ai เพิ่มพลังให้กับตัวเอง เข้าถึงได้ที่นี่.
- เพลโตไอสตรีม. Web3 อัจฉริยะ ขยายความรู้ เข้าถึงได้ที่นี่.
- เพลโตESG. คาร์บอน, คลีนเทค, พลังงาน, สิ่งแวดล้อม แสงอาทิตย์, การจัดการของเสีย. เข้าถึงได้ที่นี่.
- เพลโตสุขภาพ เทคโนโลยีชีวภาพและข่าวกรองการทดลองทางคลินิก เข้าถึงได้ที่นี่.
- ที่มา: https://www.nature.com/articles/s41565-023-01570-5
- :มี
- :เป็น
- :ไม่
- :ที่ไหน
- ][หน้า
- $ ขึ้น
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- ลด 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- ลด 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- สามารถ
- ข้างบน
- เข้า
- ตาม
- ตาม
- อะคูสติก
- ได้รับ
- ที่ได้มา
- การครอบครอง
- ข้าม
- กระทำ
- เปิดใช้งาน
- การกระตุ้น
- คล่องแคล่ว
- อยากทำกิจกรรม
- ปรับได้
- เพิ่มเติม
- ที่อยู่
- ปรับ
- ผู้ใหญ่
- หลังจาก
- AG
- อีกครั้ง
- AL
- แอลกอฮอล์
- Alexa
- ขั้นตอนวิธี
- ทั้งหมด
- ช่วยให้
- ตาม
- am
- ล้อมรอบ
- จำนวน
- ขยาย
- an
- วิเคราะห์
- การวิเคราะห์
- สมอ
- และ
- สัตว์
- สัตว์
- แอนติบอดี
- แอนติบอดี
- นอกเหนือ
- การใช้งาน
- ประยุกต์
- การประยุกต์ใช้
- เข้าใกล้
- เหมาะสม
- การอนุมัติ
- ได้รับการอนุมัติ
- เป็น
- AREA
- พื้นที่
- ARM
- รอบ
- แถว
- บทความ
- AS
- ประเมินผล
- การประเมินผล
- ที่เกี่ยวข้อง
- ข้อสมมติ
- At
- บรรยากาศ
- อะตอม
- ความสนใจ
- มีอำนาจ
- ใช้ได้
- หลีกเลี่ยง
- ไป
- พื้นหลัง
- ธนาคาร
- บาร์เซโลนา
- ฐาน
- ตาม
- baseline
- BD
- BE
- คาน
- เพราะ
- รับ
- ก่อน
- พฤติกรรม
- ด้านล่าง
- ดีกว่า
- ระหว่าง
- ผูกพัน
- ชีวการแพทย์
- บิต
- Black
- ที่ถูกบล็อก
- ร่างกาย
- ร่างกาย
- ทั้งสอง
- กล่อง
- ในกล่องสี่เหลี่ยม
- ของเล่นเพิ่มพัฒนาสมอง
- สมอง
- สาขา
- สั้น
- กว้าง
- นำ
- กันชน
- แต่
- by
- สายเคเบิล
- คำนวณ
- คำนวณ
- ห้อง
- capacitive
- ความจุ
- ซึ่ง
- ดำเนินการ
- กรณี
- หมวดหมู่
- ซีซีแอล2
- เซลล์
- เซลล์
- ปูนซีเมนต์
- ส่วนกลาง
- ความท้าทาย
- ลักษณะ
- รับผิดชอบ
- Charles
- สารเคมี
- เลือก
- การจัดหมวดหมู่
- จัด
- คลิก
- ปิด
- ค็อกเทล
- ชุด
- คอลัมน์
- รวม
- มา
- กรรมการ
- ชุมชน
- ชุมชน
- เสร็จ
- ส่วนประกอบ
- เงื่อนไข
- ดำเนินการ
- การนำ
- องค์ประกอบ
- เชื่อมต่อ
- งานที่เชื่อมต่อ
- ถือว่า
- ประกอบด้วย
- คงที่
- ติดต่อเรา
- ที่มีอยู่
- ต่อเนื่องกัน
- ผลงาน
- การลู่เข้า
- แก้ไข
- ตรงกัน
- ทางเดิน
- เยื่อหุ้มสมอง
- สภา
- counterparts
- หลักสูตร
- ปกคลุม
- วิกฤติ
- ข้าม
- เก็บรักษาไว้ด้วยการแช่แข็ง
- ปัจจุบัน
- ประเพณี
- ตัด
- วงจร
- รอบ
- cytokines
- เป็นอันตราย
- มืด
- ข้อมูล
- การวิเคราะห์ข้อมูล
- วัน
- de
- ลดลง
- ถือว่า
- กำหนด
- เดล
- ส่ง
- ขึ้นอยู่กับ
- ฝากเงิน
- ฝาก
- ความลึก
- อธิบาย
- ออกแบบ
- ที่ต้องการ
- รายละเอียด
- กำหนด
- แน่นอน
- การกำหนด
- พัฒนาการ
- เครื่อง
- อุปกรณ์
- DID
- อาหาร
- ความแตกต่าง
- ความแตกต่าง
- ต่าง
- ดิจิตอล
- ในรูปแบบดิจิตอล
- เจือจาง
- โดยตรง
- โดยตรง
- ความคลาดเคลื่อน
- การหยุดชะงัก
- ระยะทาง
- แบ่งออก
- do
- โดเมน
- ทำ
- ลง
- หล่น
- สอง
- ระยะเวลา
- ในระหว่าง
- E&T
- แต่ละ
- ขอบ
- ติดตั้งระบบไฟฟ้า
- อิเล็กทรอนิกส์
- ธาตุ
- ช้าง
- สูง
- ห้อมล้อม
- พลังงาน
- เสริม
- ที่เพิ่มขึ้น
- หัตถการด้านการเสริมความงาม
- ทำให้มั่นใจ
- พร้อม
- เท่ากัน
- ที่จัดตั้งขึ้น
- ประมาณ
- อีเธอร์ (ETH)
- ตามหลักจริยธรรม
- ยูโร
- ในทวีปยุโรป
- EV
- ประเมิน
- การประเมินผล
- เหตุการณ์
- ทุกๆ
- ทุกที่
- หลักฐาน
- ตรวจสอบ
- ข้อยกเว้น
- ที่คาดหวัง
- การทดลอง
- การทดลอง
- การทดลอง
- ที่เปิดเผย
- การเปิดรับ
- แสดง
- ขอบเขต
- สารสกัด
- อำนวยความสะดวก
- ความจริง
- ปัจจัย
- ตก
- ไกล
- FAST
- คุณสมบัติ
- หญิง
- มะเดื่อ
- รูป
- ที่เต็มไป
- ฟิล์ม
- ภาพยนตร์
- กรอง
- ในที่สุด
- ชื่อจริง
- เหมาะสม
- การแก้ไข
- ความยืดหยุ่น
- มีความยืดหยุ่น
- ไหล
- มุ่งเน้น
- โดยมุ่งเน้น
- ตาม
- ดังต่อไปนี้
- อาหาร
- สำหรับ
- บังคับ
- ต่างประเทศ
- ฟอร์ม
- สูตร
- FRAME
- ฟรี
- อิสระ
- แช่แข็ง
- ภาษาฝรั่งเศส
- ราคาเริ่มต้นที่
- ด้านหน้า
- แช่แข็ง
- เต็ม
- อย่างเต็มที่
- การทำงาน
- ตามหน้าที่
- ต่อไป
- อนาคต
- ได้รับ
- ให้
- General
- เรขาคณิต
- ให้
- กำหนด
- กระจก
- GM
- Go
- ทองคำ
- แกรฟีน
- หญ้า
- พื้น
- บัญชีกลุ่ม
- กลุ่ม
- แนวทาง
- มี
- ครึ่ง
- การจัดการ
- มี
- สุขภาพ
- ช่วย
- ซีกโลก
- ความละเอียดสูง
- ที่สูงที่สุด
- เจ้าของ
- รู
- หน้าแรก
- โฮมออฟฟิศ
- ตามแนวนอน
- ร้อน
- อย่างไรก็ตาม
- HTTPS
- Huang
- i
- ระบุ
- แยกแยะ
- อีอีอี
- ภาพ
- การวิเคราะห์ภาพ
- ภาพ
- ส่งผลกระทบ
- in
- รวมทั้ง
- ที่เพิ่มขึ้น
- ฟักไข่
- ฟักไข่
- ดัชนี
- เป็นรายบุคคล
- แผลอักเสบ
- ข้อมูล
- อินพุต
- ภายใน
- สถาบัน
- คำแนะนำการใช้
- แบบบูรณาการ
- การบูรณาการ
- ตั้งใจว่า
- อินเตอร์เฟซ
- อินเตอร์เฟซ
- เข้าไป
- สอบสวน
- IT
- ITS
- เก็บไว้
- ชุด
- Koch
- ฉลาก
- ห้องปฏิบัติการ
- ใหญ่
- ที่มีขนาดใหญ่
- เลเซอร์
- ชื่อสกุล
- ความแอบแฝง
- ต่อมา
- กฏหมาย
- ชั้น
- น้อยที่สุด
- ซ้าย
- กฎหมาย
- ความยาว
- ชั้น
- ห้องสมุด
- กดไลก์
- ข้อ จำกัด
- Line
- LINK
- ที่เชื่อมโยง
- ของเหลว
- โหลด
- ในประเทศ
- ที่ตั้งอยู่
- วันหยุด
- นาน
- ระยะยาว
- สูญหาย
- ลดลง
- macrophages
- ทำ
- หลัก
- เก็บรักษา
- ทำ
- แผนที่
- แผนที่
- หน้ากาก
- จับคู่
- วัสดุ
- วัสดุ
- matplotlib
- สูงสุด
- mc
- หมายความ
- วิธี
- วัด
- การวัด
- วัด
- การวัด
- เชิงกล
- ภาพบรรยากาศ
- โลหะ
- วิธี
- ไมโคร
- ไมโครโฟน
- กล้องจุลทรรศน์
- กล้องจุลทรรศน์
- กลาง
- นาที
- ต่ำสุด
- ขั้นต่ำ
- กระทรวง
- สารผสม
- ML
- แบบ
- โมเดล
- โมดูล
- โมดูล
- อณู
- การตรวจสอบ
- เดือน
- เม้าส์
- ย้าย
- ย้าย
- MS
- หลายช่อง
- กล้ามเนื้อ
- นาโนเทคโนโลยี
- แห่งชาติ
- สถาบันสุขภาพแห่งชาติ
- ธรรมชาติ
- ใกล้
- จำเป็น
- เนื้อร้าย
- ความต้องการ
- เชิงลบ
- NEO
- สุทธิ
- เครือข่าย
- ประสาท
- เส้นใยประสาท
- เซลล์ประสาท
- ถัดไป
- ไม่
- สัญญาณรบกวน
- จำนวน
- มึน
- วัตถุ
- วัตถุประสงค์
- วัตถุ
- สังเกต
- ได้รับ
- ที่ได้รับ
- of
- ปิด
- Office
- ออฟไลน์
- เก่า
- on
- ครั้งเดียว
- ONE
- เพียง
- เปิด
- เปิด
- การดำเนินการ
- or
- อื่นๆ
- ของเรา
- ออก
- เอาท์พุต
- ด้านนอก
- เกิน
- ทั้งหมด
- ค้างคืน
- ภาพรวม
- ออกซิเจน
- แพคเกจ
- เบาะ
- อาการเจ็บปวด
- หมีแพนด้า
- แผง
- ส่วนหนึ่ง
- ส่ง
- รูปแบบ
- อุ้งเท้า
- พีบีเอส
- จุดสูงสุด
- ต่อ
- การปฏิบัติ
- ดำเนินการ
- ระยะเวลา
- อุปกรณ์ต่อพ่วง
- ระยะ
- ฟีโนไทป์
- ต้นสน
- ท่อ
- พิกเซล
- วางไว้
- Planes
- เวที
- แพลทินัม
- เพลโต
- เพลโตดาต้าอินเทลลิเจนซ์
- เพลโตดาต้า
- บวก
- pm
- จุด
- จุด
- ผลงาน
- ตำแหน่ง
- บวก
- โพสต์
- ที่มีศักยภาพ
- อำนาจ
- เบื้องต้น
- การจัดเตรียม
- เตรียม
- การมี
- นำเสนอ
- ดอง
- ความดัน
- ก่อนหน้านี้
- ประถม
- ก่อน
- การสอบสวน
- ขั้นตอน
- กระบวนการ
- การประมวลผล
- กระบวนการ
- การผลิต
- ผลิตภัณฑ์
- อย่างถูกต้อง
- คุณสมบัติ
- คุณสมบัติ
- สัดส่วน
- ปกป้อง
- โปรตีน
- โปรโตคอล
- โปรโตคอล
- ให้
- การให้
- ดึง
- ชีพจร
- หลาม
- R
- พิสัย
- ตั้งแต่
- หนู
- คะแนน
- อัตราส่วน
- RE
- ปฏิกิริยา
- ปฏิกิริยา
- พร้อม
- การได้รับ
- แนะนำ
- บันทึก
- การบันทึก
- การฟื้นตัว
- ลด
- ลดลง
- การลดลง
- การอ้างอิง
- การฟื้นฟู
- อาหาร
- ภูมิภาค
- ญาติ
- ตรงประเด็น
- ยังคง
- เอาออก
- ลบออก
- ลบ
- ซ้ำแล้วซ้ำอีก
- แทนที่
- รายงาน
- การรายงาน
- การแสดง
- ตัวแทน
- การวิจัย
- ความต้านทาน
- ความละเอียด
- เคารพ
- ตามลำดับ
- คำตอบ
- การตอบสนอง
- ผลสอบ
- ความผกผัน
- ทบทวน
- ริบบิ้น
- รวย
- ขวา
- ขึ้น
- แม่น้ำ
- ห้อง
- วิ่ง
- s
- เดียวกัน
- การสแกน
- สคริปต์
- ที่สอง
- รอง
- Section
- ส่วน
- ปลอดภัย
- เห็น
- เลือก
- ชุด
- เซรุ่ม
- ชุดอุปกรณ์
- หลาย
- รูปร่าง
- แสดง
- แสดงให้เห็นว่า
- ด้าน
- สัญญาณ
- สัญญาณ
- ความสำคัญ
- สำคัญ
- เงิน
- พร้อมกัน
- เดียว
- เว็บไซต์
- สถานที่ทำวิจัย
- ขนาด
- ผิว
- เลื่อน
- สไลด์
- เลื่อน
- เล็ก
- ตะครุบ
- ซอฟต์แวร์
- ทางออก
- เสียง
- แหล่ง
- เกี่ยวกับอวกาศ
- ลำโพง
- ลำโพง
- ที่ระบุไว้
- รายละเอียด
- สเปก
- แหลม
- สปิน
- สี่เหลี่ยม
- Stability
- ทำให้มีเสถียรภาพ
- กอง
- เหล็กกล้าไร้สนิม
- มาตรฐาน
- มาตรฐาน
- ที่เริ่มต้น
- สถานะ
- ทางสถิติ
- สถิติ
- อบไอน้ำ
- เหล็ก
- ก้านดอก
- ขั้นตอน
- ขั้นตอน
- แรงบันดาลใจ
- การเก็บรักษา
- เก็บไว้
- ตรง
- กลยุทธ์
- เพิก
- แข็งแรง
- โครงสร้าง
- โครงสร้าง
- การศึกษา
- ศึกษา
- ใต้ผิวหนัง
- ภายหลัง
- เป็นกอบเป็นกำ
- อย่างเช่น
- รวม
- พื้นผิว
- ศัลยกรรม
- ระบบ
- T
- เอา
- นำ
- เป้า
- งาน
- เทคนิค
- เทคโนโลยี
- ชั่วคราว
- ทดสอบ
- การทดสอบ
- กว่า
- ที่
- พื้นที่
- พื้นที่
- ก้าวสู่อนาคต
- สหราชอาณาจักร
- ของพวกเขา
- แล้วก็
- ที่นั่น
- ร้อน
- พวกเขา
- นี้
- เหล่านั้น
- สาม
- ธรณีประตู
- ตลอด
- ตลอด
- ดังนั้น
- เวลา
- ครั้ง
- ชนิด
- เคล็ดลับ
- เนื้อเยื่อ
- ไทเทเนียม
- ไปยัง
- TONE
- ด้านบน
- รวม
- สัมผัส
- ไปทาง
- ลู่
- รถไฟ
- ไขมันทรานส์
- โอน
- โอน
- การถ่ายโอน
- การเปลี่ยนแปลง
- ได้รับการรักษา
- การรักษา
- การรักษา
- การทดลอง
- เกี่ยวกับการสอน
- สอง
- ชนิด
- Uk
- เสียงพ้น
- ภายใต้
- ความเข้าใจ
- ขนาน
- จนกระทั่ง
- ใช้
- มือสอง
- การใช้
- สูญญากาศ
- ถูกต้อง
- ความคุ้มค่า
- ความคุ้มค่า
- กับ
- ผ่านทาง
- ร่างกาย
- แรงดันไฟฟ้า
- ปริมาณ
- ของ
- W
- เดิน
- ที่เดิน
- คือ
- น้ำดื่ม
- we
- สัปดาห์
- สัปดาห์ที่ผ่านมา
- การชั่ง
- น้ำหนัก
- สวัสดิการ
- คือ
- เมื่อ
- ที่
- ในขณะที่
- ขาว
- ทั้งหมด
- หน้าต่าง
- ลวด
- กับ
- ถอนเงิน
- ไม่มี
- งาน
- ทำงาน
- การทำงาน
- X
- รังสีเอกซ์
- ลมทะเล