Nanobot syntes
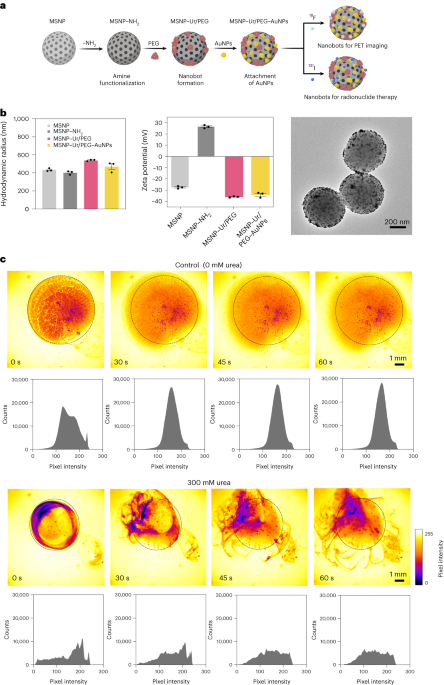
Nanobots framställdes som tidigare beskrivits33. Kort sagt, MSNP syntetiserades med hjälp av en modifierad Stöber-metod41reaktion med trietanolamin (35 g), ultrarent vatten (20 ml) och hexadecyltrimetylammoniumbromid (CTAB; 570 mg) vid 95 °C under 30 min under omrörning. Tetraetylortosilikat (1.5 ml) tillsattes därefter droppvis; blandningen lämnades att reagera i 2 h vid 95 °C och de resulterande MSNPs samlades upp genom centrifugering och tvättades i etanol (tre gånger, 2,500 XNUMXg, 5 min). För att ta bort CTAB-mallen placerades MSNPs under återflöde i sur metanol (1.8 ml HCl, 30 ml metanol) i 24 timmar. Sedan samlades MSNPs upp genom centrifugering och tvättades tre gånger i etanol (2,500 XNUMXg, 5 min) innan aminmodifiering införlivas genom att lägga till APTES (6 µl per mg MSNP) till MSNPs (1 mg ml-1) i en 70 % etanollösning vid 70°C, under kraftig omrörning i 1 timme. MSNPs-NH2 uppsamlades och tvättades tre gånger i etanol och tre gånger i vatten genom centrifugering (tre gånger, 1,150 XNUMXg, 5 min). MSNPs-NH2 resuspenderades i PBS vid en koncentration av 1 mg/ml-1 och total volym på 900 µl, och aktiveras med glutaraldehyd (100 µl) i 2.5 µh vid rumstemperatur. De aktiverade MSNP-NH2 uppsamlades och tvättades i PBS tre gånger genom centrifugering (1,150 XNUMXg, 5 min), återsuspenderad i en lösning av ureas (3 mg ml-1) och heterobifunktionell PEG (1 μg PEG per mg 5 kDa HS-MSNPs-NH224 (MgS1,150) i PBS, och reagerade i XNUMX timmar vid rumstemperatur. De resulterande nanobotarna samlades sedan upp och tvättades tre gånger i PBS genom centrifugering (XNUMX XNUMXg, 5 min) innan de återsuspenderas i en dispersion av AuNPs, framställda som tidigare beskrivits51låt dem reagera i 10 min och tvätta noggrant genom centrifugering (tre gånger, 1,150 XNUMXg, 5 minuter).
Hydrodynamisk storleksfördelning och ytladdning av MSNPs, MSNPs-NH2, nanobotar och AuNP-dekorerade nanobotar bestämdes med användning av ett Wyatt Mobius dynamiskt ljusspridningssystem respektive en Malvern Zetasizer. I samtliga fall var koncentrationen 20 µg ml-1 och förvärvstid 5 s, med tre körningar per experiment. Tre mätningar per partikeltyp utfördes.
Syntes av FITC MSNPs
En blandning av FITC (2 mg), etanol (5 ml) och APTES (400 µl) framställdes och omrördes i 30 min. Sedan följdes det tidigare beskrivna protokollet för MSNP-syntes, förutom att vi tillsatte tetraetylortosilikat (1.25 ml) droppvis i kombination med FITC-APTES-blandningen (250 µl). Funktionaliseringsstegen för att få FITC-märkta nanobotar var som nämnts ovan.
Syntes av AuNPs
AuNP syntetiserades med användning av en rapporterad metod33. Kort sagt, allt material rengjordes med nyberedd regiavatten, sköljdes noggrant med vatten och lufttorkades. Därefter, en 1 mM AuCl4 lösningen upphettades till sin kokpunkt under omrörning i en rundbottnad kolv integrerad i ett återflödessystem. Efter detta tillsattes 10 ml natriumcitratlösning (30.8 mM) och lösningen kokades i 20 minuter, vilket resulterade i en röd färg. Lösningen fick sedan svalna till rumstemperatur under omrörning i 1 timme. De resulterande AuNP:erna förvarades i mörker och karakterisering utfördes med användning av transmissionselektronmikroskopi.
Enzymatisk aktivitet
Enzymatisk aktivitet hos nanobotar, 18F-nanobots och 131I-nanobots mättes med fenolrött. För att göra det, 2 µl nanobots (1 mg ml-1) sattes till en platta med 96 brunnar och blandades med 200 µl av olika urealösningar (0, 50, 100, 200 mM) i 1.1 mM fenolrött. Absorbansen vid 560 nm mättes över tiden vid 37 °C.
Nanobots rörelsedynamik genom optisk mikroskopi
Optiska videor av nanobotar förvärvades med ett Leica Thunder-mikroskop, tillsammans med en Hamamatsu höghastighets CCD-kamera och ett ×1.25 objektiv. För detta centrifugerades nanobotarna och återsuspenderades i 50 µl PBS (slutkoncentration på 20 mg ml-1). Sedan fylldes en petriskål med 3 ml av antingen PBS eller en 300 mM lösning av urea (i PBS) och observerades under mikroskop. En 5 µl droppe med nanobots (20 mg ml-1) sattes sedan till den vätskefyllda petriskålen och videor spelades in med 25 bilder per sekund. Videopixelintensitetsfördelningar i ROI analyserades med 15 s intervaller med hjälp av programvaran ImageJ.
Radiomärkning av nanobotar med [18F]F-PyTFP
Syntes av [18F]F-PyTFP
[18F]F-PyTFP syntetiserades i en Neptis xSeed-modul (Optimized Radiochemical Applications), enligt en tidigare rapporterad metod33.
Syntes av 18F-märkta nanobotar
Nanobotar märktes med [18F]F-PyTFP, på grundval av ett tidigare fastställt förfarande med mindre ändringar33. I korthet, 200 µl nanobotlösning (1 mg ml-1) centrifugerades (10 min, 13,853 XNUMXg), återsuspenderad i 10 µl PBS (1 mM, pH 8), och inkuberad med 4 µl [18F]F-PyTFP i acetonitril (ca 37 MBq) i 35 min vid rumstemperatur. Efter inkubation späddes reaktionsblandningen med vatten (200 µl) och renades genom centrifugering (5 min, 13,853 XNUMXg). Den resulterande pelleten sköljdes sedan tre gånger med vatten innan den mättes i en doskalibrator (CPCRC-25R, Capintec). Radiokemiskt utbyte beräknades som förhållandet mellan mängden radioaktivitet som finns i nanobotarna efter tvättning och den initiala mängden radioaktivitet. Radiokemisk renhet efter rening var ≥99 %, bestämd med radiotunnskiktskromatografi (radio-TLC) med användning av iTLC-SG kromatografipapper (Agilent Technologies) och diklormetan och metanol (2:1) som stationära respektive mobila faser. TLC-plattor analyserades med användning av en TLC-läsare (MiniGITA, Raytest).
Stabilitet av 18F-nanobots
Stabiliteten av 18F-märkta nanobotar bestämdes med hjälp av följande media: (1) 300 mM urea, (2) vatten och (3) urin från tumörbärande djur. 18F-märkta nanobotar (10 µl) inkuberades med motsvarande lösning (100 µl) i 1 h vid rumstemperatur. Sedan separerades nanobotar och supernatant genom centrifugering och samlades upp och radioaktivitet mättes i en doskalibrator (CPCRC-25R).
Radiomärkning av nanobotar med 131I
Radiojodering av ureas-nanobotar utfördes genom att inkubera nanobotar med injicerbara [131I]NaI-lösning (925 MBq ml-1; GE HealthCare). I korthet, 400 µl ureas nanobotlösning (1 mg ml-113,853 centrifugerades (XNUMXg, 5 min), återsuspenderad i 100 µl PBS (10 mM, pH 7.4) och inkuberad med 25 µl eller 185 µl injicerbar [131I]NaI (ca 42.55 respektive 277.5 MBq) under 30 min, beroende på den önskade slutliga aktiviteten. Efter inkubation renades reaktionsblandningen genom centrifugering (13,853g, 5 min). Den resulterande fällningen tvättades tre gånger med vatten (100 µl). Radioaktiviteten i supernatanten och fällningen bestämdes med användning av en doskalibrator (CPCRC-25R), och båda fraktionerna analyserades med radio-TLC, som för 18F-nanobots.
Djurmodellutveckling
Möss sköttes och hanterades i enlighet med Europeiska rådets direktiv 2010/63/UE och interna riktlinjer. Alla experimentella procedurer godkändes av CIC biomaGUNEs etiska kommitté och lokala myndigheter (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Bildanalys (både PET och MRI) förblindades mot gruppfördelning av djuren.
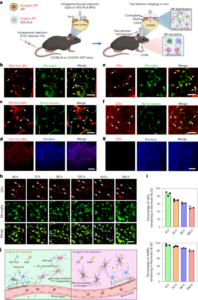
Den ortotopiska murina modellen av blåscancer genererades genom intravesikal administrering av MB49-celler (murin carcinom blåscellinje) till C57BL/6JRj honmöss (8 veckor gamla, Janvier). För experiment som syftade till att bestämma tumörackumulering (fyra grupper; detaljer nedan) inokulerades sex djur per grupp, vilket bestämdes med användning av precisionsanalys, med följande antaganden: erforderlig precision, 20 %; förväntad s.d., ±20%; självförtroende, 95%; djurförlust, 20 %. För experiment med terapeutisk effekt (sex grupper; detaljer nedan) inkluderades tio djur per grupp, beräknat med en ensidig student t-test, skillnad mellan två oberoende medel, med följande antaganden: nollhypotes, behandling påverkar inte tumörtillväxt; α0.05; 1 − β0.95; s.d., ±50%; förväntade skillnader mellan grupper, 50 %; djurförlust, 20 %. Eftersom experimentet utfördes i två partier av operativa skäl inkluderades en kontrollgrupp i båda batcherna (tabell 2), och sedan poolades alla djur. För tumöretablering sövdes mössen genom inandning av 3% isofluran i ren O2 och bibehålls av 1.0–1.5 % isofluran i 100 % O2. Sedan tömdes blåsan och kemiska lesioner inducerades på urotelet genom att intravesikalt ingjuta 50 µl poly-l-lysin (Sigma-Aldrich) genom en 24-gauge kateter i 15 min. Därefter tömdes blåsan igen och MB49-celler (105 celler) i DMEM med hög glukoshalt (100 µl) instillerades i 1 h innan katetern avlägsnades och blåsan tömdes via bukmassage. Under hela experimenten övervakades och vägdes mössen för hälso- och välfärdsövervakning. En human endpoint tillämpades om viktminskningen översteg 20 % eller på basis av kliniska symtom, enligt kriterierna för den ansvariga veterinären.
Tumörstorleksspårning
MRT-studier utfördes 7 och 14 dagar efter tumörinduktion, med användning av en 7 T Bruker BioSpec USR 70/30 skanner (Bruker BioSpin) utrustad med en BGA-12S gradientinsats på 440 mT m-1 och en 112/086 QSN-resonator (T12053V3) för radiofrekvens14 sändning och en råtthjärnespole (T11205V3) för RF-mottagning (båda arbetar vid 300 MHz). Djuren sövdes med isofluran (4 % för induktion och 1.5 % för underhåll i en 50 % O2/50 % N2 blandning) och placeras på en MR-kompatibel vagga. Kroppstemperatur och andningshastighet övervakades kontinuerligt med en MR-kompatibel övervakningsanordning (modell 1030 SA, Small Animal Instruments), kopplad till ett luftvärmesystem för små gnagare för att upprätthålla kroppstemperaturen. Efter att ha förvärvat referensbilder användes en spin-ekobaserad diffusionsvägd bildsekvens för att avbilda tumörer med följande parametrar: ekotid (TE) = 22.3 ms, upprepningstid (TR) = 2,500 XNUMX ms, n = 2 medelvärden, en A0-bild (basalbild med b = 0 s mm-2) och en DW-bild förvärvad med diffusionsgradienter i (1, 0, 0) riktningen med en gradientvaraktighet δ = 4.5 ms och en gradientseparation Δ = 10.6 ms, vilket ger b = 650 s mm-2, en 16 × 16 mm2 synfält, bildmatrisstorlek på 160 × 160 punkter, 20 på varandra följande skivor med 0.5 mm tjocklek (inget mellanrum, förvärvat i interfolierat läge) och en bandbredd på 192.9 Hz per pixel. För att visualisera tumörer efterbehandlades bilder med ImageJ-programvaran, varvid bilder som förvärvats med en diffusionsgradient (b = 650 s mm-2) av dem som förvärvats utan (b = 0 s mm-2), och tillämpa ett 3D Gaussiskt filter (σx = σy = σz = 0.7) till resultatet. Tumörer avgränsades manuellt för att bestämma deras volym.
Biodistribution in vivo
På dag 15 efter tumörinduktion randomiserades möss i fyra grupper för att erhålla homogena genomsnittliga tumörvolymfördelningar mellan grupper. PET-CT-skanningar (MOLECUBES β och X-CUBE skannrar) förvärvades 3 h efter intravesikal administrering av 100 µl av 18F-BSA (grupp 1 och 2) eller 18F-ureas (grupp 3 och 4) nanobotar i en koncentration av 200 µg ml-1, med antingen vatten (grupp 1 och 3) eller 300 mM urea i vatten (grupp 2 och 4) som vehikel (tabell 1). För bildinsamling inducerades djuren med anestesi (5 % isofluran i rent syre) och placerades i ryggläge innan de masserade buken för evakuering av urinblåsan. Omedelbart därefter, motsvarande 18F-märkta nanobotar (18F-BSA/18F-ureas i vatten/urea) instillerades i urinblåsan genom en 24-gauge kateter och inkuberades i 1 timme, innan katetern togs bort, blåsan tömdes och mössen lämnades för att återhämta sig från anestesin. På t = 3 h efter administrering, sövdes djuren på nytt och 10 min statiska PET-bilder av hela kroppen förvärvades, följt av CT-skanningar. PET-bilder rekonstruerades med hjälp av den 3D-ordnade subset förväntningsmaximeringsrekonstruktionsalgoritmen med slumpmässiga, spridnings- och dämpningskorrigeringar. PET-CT-bilder av samma mus samregistrerades och analyserades med hjälp av PMOD-bildbehandlingsverktyget. Plots av koncentration av radioaktivitet mot tid erhölls genom att skapa en volym av intresse på den övre blåsregionen med hjälp av ett 3D-konturverktyg och mäta aktivitet (förfallskorrigerad) i kilobecquerel per organ. Resultaten korrigerades genom att applicera en kalibreringsfaktor och normaliserades sedan med MRI-härledd tumörvolym.
Ex vivo studier
Histopatologiska analyser
Efter att ha slutfört all bildtagning, valda blåsor (n = 3 per grupp) från tumörbärande och friska djur avlägsnades under aseptiska förhållanden och fixerades omedelbart i 4 % formaldehyd. Sedan bäddades blåsor in i paraffin innan man tog 2–3 µm sektioner för hematoxylin–eosinfärgning. Representativa bilder erhölls från alla tillstånd för histopatologisk undersökning.
ICP-MS analys
Mätningar utfördes på en Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) i kombination med en ASX-560 autosampler (CETAC Tech). Efter att ha slutfört all bildtagning dödades djuren och utvalda blåsor (n = 2 per grupp; fyra grupper) uppsamlade och digererade i 1 ml HNO3HCl (4:1 blandning). Dispersionen kokades tills organen var fullständigt upplösta. Därefter kyldes lösningen till rumstemperatur och analyserades med ICP-MS för att bestämma koncentrationen av Au i varje prov, vilket omvandlade resultaten till procentandelar av injicerad dos per gram vävnad (%ID g-1).
Immunhistokemi och konfokal mikroskopi avbildning
För immunhistokemiska analyser fick tumörbärande djur FITC-märkta nanobotar i vatten eller 300 mM urea (n = 4 per grupp), som beskrivits ovan, för PET-CT-studier. Dessutom fungerade tumörbärande djur utan nanobotar som en kontrollgrupp (n = 2). I alla fall samlades blåsor, frystes och skars i 10 µm sektioner som omedelbart fixerades i 10 % formaldehyd i 15 min, tvättades med 10 mM PBS och inkuberades sedan i 50 mM NH4Cl i PBS i 5 min innan du sköljer igen med PBS. Permeabilisering utfördes med metanol:aceton (1:1) i 5 minuter vid rumstemperatur och 0.1 % Triton i PBS under 5 minuter. Efter PBS-tvätt mättades proverna med en lösning av 5% BSA–0.5% Tween i PBS i 15 min vid rumstemperatur och inkuberades i 1 h vid rumstemperatur med mus anti-FITC (1:100, Abcam) i 5% BSA –0.5 % Tween. Sektioner tvättades tre gånger med 10 mM PBS i 5 min och inkuberades i 30 min vid rumstemperatur med sekundär antikropp Alex Fluor 647 åsna-anti-mus IgG (Molecular Probes, Life Technologies, 1:1,000 5) i 0.5 % BSA–3 % Tween i PBS, tvättas igen i PBS (5 × 4,6 min) och monteras med ett ProLong antifade-kit med 2-diamidino-5-phenylindole (DAPI; Molecular Probes, Life Technologies). Bilder togs med ett Leica STELLARIS 10 konfokalmikroskop (UPV/EHU Scientific Park) med identiska inställningar för alla sektioner: ×4 förstoring med kakelavbildning och sömmar (vanligtvis 5 × 405 synfält). Laserlinje och detektionsfönster var 440 nm och 503–489 nm för DAPI, 494 nm och 602–653 nm för FITC vit laser och 660 nm och 836–647 nm för AlexaXNUMX vit laser.
Optisk clearing
Efter perfusion med 4 % paraformaldehyd och PBS togs blåsprover bort och fixerades ytterligare i 4 % paraformaldehyd över natten vid 4 °C, bäddades sedan in i en 5 ml spruta med 0.8 % lågsmältande agaros för att bilda ett cylindriskt block och möjliggöra lätt montering i kvartskyvetten. Hela blocket dehydratiserades progressivt med användning av metanol:H2O vid 4 °C (30%:70% under 1 h, 50%:50% under 1 h, 70%:30% under 1 h, 100%:0% i 1 h, sedan 100% metanol över natten och igen för 4 h) och slutligen nedsänkt i bensylalkohol–bensylbensoat (BABB) som lösning för brytningsindexmatchning för avbildning. För in vitro-jämförelser av gröna FITC-nanobotar med kommersiella röda partiklar använde vi DiagNano (Creative Diagnostics) röda fluorescerande kiseldioxidnanopartiklar, 1 µm diameter, resistenta mot BABB-rensning.
Autofluorescens och polariserad sLS-avbildning
Light-sheet-avbildning utfördes på MacroSPIM, ett anpassat system för rensad avbildning av hela organ utvecklat vid IRB Barcelona44,45. I korthet, prover bäddas in i ett agarosblock, rensas tillsammans med provet och avbildas inuti en kvartskyvett. Autofluorescensavbildning använde lasrar vid 488, 561 eller 638 nm som levererade belysning genom en 50 mm akromatisk dubblettcylindrisk lins (ACY254-050-A, Thorlabs). För att reducera randartefakter svängs ljusarket med en resonansskanner SC-10 (EOPC) längs ett 4f-teleskop med G322288322 100 mm akromatiska dubblettlinser (QI Optic Photonics). Vävnadsautofluorescens samlas in genom band- eller långpassfluorescensfilter och spelas in med en ORCA Flash v2-kamera (Hamamatsu Photonics). Avbildning utfördes vid ×9.6 med en ×8 zoom, ×2 lins och ×0.6 tublins. Ljusarket plattades till över synfältet, vilket gav 5–6 µm axiell upplösning. 3D-avbildning gjordes i steg om 2.5 µm. Helblåsavbildning utfördes i 2 × 3 eller 3 × 4 XY brickor, beroende på orgelstorlek.
sLS-avbildning uppnåddes genom att ta bort fluorescensfiltret eller använda något filter som överför lasern. Ljusarksvängning reducerade laserfläckbrus, vilket resulterar i tidsmässigt medelvärde av laserkoherens som visats tidigare52. Orienteringen av linjär ljusarkpolarisation i belysning kontrollerades genom att rotera en halvvågsplatta (AHWP05M-600, Thorlabs) före pivotskannern. Den detekterade signalen valdes i polarisation med användning av en roterande linjär polarisator (LPVISC100, Thorlabs) före filterhjulet vid detektering, vilket introducerade >50 % intensitetsförlust vid fluorescensdetektion. Medan sLS-signalfördelning i allmänhet förändras med polarisatorns orientering, förblir vävnadsautofluorescenssignalen opåverkad av polarisatorns rotation. sLS ger en rumslig upplösning på 2.4 ± 0.3 µm i BABB, vilket är jämförbart med upplösningen i fluorescensljusarkavbildning (bekräftas genom att anpassa en gaussisk funktion till XY bildsvar av en enda partikel, tilläggsbild. 8l–m) och nära den teoretiska upplösningen i luft (1.53 µm med numerisk bländare (NA) = 0.2 vid maximal makrozoom ×8).
Bildbehandling och 3D-analys
Bildbehandling, segmentering och analys av datauppsättningar av ljusark gjordes med ImageJ/Fiji, medan Fig. 3 och 4 genererades med Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) och kompletterande video 3 genererades med Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Kaklade ljusarksdatauppsättningar syddes med MosaicExplorerJ53. 3D-segmentering av blåsvävnad utfördes med hjälp av anpassade ImageJ/Fiji-makron för halvautomatisk 3D-kommentar av stora volymer i virtuellt läge. Kort sagt, ett första skript, "Macro1", laddar 3D-bildstaplar, möjliggör användarkommentarer av ROIs i flera plan och interpolerar automatiskt ROI:erna för att generera och exportera 3D-masker. ROI ritades var 15:e plan (var 37.5 µm) för att underlätta god segmenteringskontinuitet samtidigt som kommentarerna hölls till ett rimligt minimum. Ett andra skript, 'Macro2', utför de matematiska eller booleska operationerna, plan för plan utan att ladda hela stackarna i minnet, antingen mellan 3D-masker eller mellan en 3D-mask och originaldata, vilket sparar resultatet som en ny stack. Alla masker genererades genom att kommentera autofluorescensbilder.
Både tumör och frisk vävnads ytskikt (Fig. 3) avgränsades med Fijis trollstav och lassoverktyg på blåshålan i en mask. Genom att kalla denna första iteration BC1, vidgar efterföljande körningar av Macro1 automatiskt denna 3D-kontur med en definierad pixelmängd för att ge nya maskiterationer, BC2, BC3 och så vidare, med ökande utvidgningar. Det första lagret som innehåller både tumör och frisk vävnad, mask L1, erhålls genom att subtrahera mask BC1 från BC2 och så vidare, vilket ger L2 och L3 som koncentriska lager. Tumörvolymen närmast kaviteten erhölls genom att annotera tumören med trollstav och lassoverktyg för att skapa en mask T1, medan det friska 3D-lagret av urotel detekterades separat i mask U1. Att subtrahera U1 från L1 ger tumörens ytskikt, och så vidare: L2 − U1, L3 − U1. Omvänt erhålls det första lagret av urotelet genom att subtrahera T1 från L1. Alla lager i fig. 3 definierades till att ha 33 µm tjocklek.
Samma svit av makron och procedurer (ImageJ stavverktyg, digital erosion på 500 µm och så vidare) användes för att avgränsa och segmentera den inre delen av blåsvävnaden och sedan uppskatta blåsens inre vävnadsvolym (Fig. 4, se ovan för detaljer). Histogram av den spridda signalintensiteten skapades i Fiji genom att kombinera den spridda signalen och masken.
RNT använder 131Jag-nanobots
Mellan dag 8 och 15 efter tumörimplantation delades djuren in i sex grupper (grupp 1–6), för att försöka uppnå liknande genomsnittliga tumörvolymer över grupper (tabell) 2). För experimenten inducerades djur med anestesi (5% isofluran i ren O2) och placeras på rygg innan urinblåsan töms genom att massera bukområdet. Omedelbart därefter, 100 µl av lämplig behandling i en koncentration av 400 µg ml-1 (Tabell 2) instillerades i blåsan med användning av en 24-gauge kateter. Behandling och vehikel (vatten eller urea) låg kvar i urinblåsan i 1 h innan katetern togs bort. Blåsan tömdes igen genom bukmassage och möss återhämtade sig från anestesi i sina burar, och ersatte djurburens sågspån 24 h efter behandling för att avlägsna radioaktiv kontaminering.
Terapeutisk effekt bestäms av MRT
Två MRI-studier utfördes på varje mus: (1) mellan dag 7 och 14 efter tumörinokulering för att randomisera djuren bland grupper och mäta initiala (förbehandling) tumörvolymer; (2) mellan dag 16 och 21 efter tumörinokulering (efterbehandling) för att utvärdera terapeutisk effekt. MRT utfördes med 7 T Bruker BioSpec och 11.7 T Bruker BioSpec skannrar (båda med ParaVision 7), beroende på tillgänglighet. Detta påverkade inte resultaten eftersom det yttre fältet inte är kritiskt för anatomisk avbildning14. Avbildningsexperiment utfördes med samma avbildningsparametrar och bearbetning som förklarats ovan (Tumörstorleksspårning). I fallet med 11.7 T-skannern bestod uppsättningen av en mushjärtspole för mottagning och en volymetrisk spole för överföring. Tumörvolymer i varje skiva bestämdes från manuellt dragna volymer av intresse som täcker tumörområdet.
Statistisk analys
I PET-avbildningsstudier, procentandel av injicerad dos (% ID) och injicerad dos per tumörvolym (% ID cm-3) jämfördes med användning av envägs ANOVA. Skillnader mellan grupper bestämdes med Tukeys multipla jämförelsetest. NTV i RNT-sektionen erhölls från en t-test av oparade värden. Datadistributionen antogs vara normal, men detta testades inte formellt. Statistiska analyser utfördes med GraphPad Prism v.8.
Rapporteringsöversikt
Ytterligare information om forskningsdesign finns i Sammanfattning av naturportföljrapportering länkad till den här artikeln.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- Källa: https://www.nature.com/articles/s41565-023-01577-y
- :är
- :inte
- ][s
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- Om oss
- ovan
- överensstämmelse
- ackumulering
- Uppnå
- uppnås
- förvärvade
- förvärvande
- förvärv
- tvärs
- aktiverad
- aktiv
- aktivitet
- lagt till
- tillsats
- Dessutom
- administrering
- påverka
- Efter
- efteråt
- igen
- syftar
- LUFT
- AL
- alex
- algoritm
- Alla
- tillåts
- längs
- Alzheimers
- bland
- mängd
- amyloid
- an
- analyser
- analys
- Ankare
- och
- djur
- djur
- antikropp
- vilken som helst
- tillämpningar
- tillämpas
- Tillämpa
- lämpligt
- godkänd
- aqua
- ÄR
- OMRÅDE
- Artikeln
- AS
- antas
- antaganden
- At
- Myndigheter
- automatiskt
- tillgänglighet
- tillgänglig
- genomsnitt
- medelvärdes
- b
- BABB
- Bandbredd
- grund
- BE
- innan
- beteende
- Där vi får lov att vara utan att konstant prestera,
- nedan
- mellan
- Blockera
- kropp
- kokt
- båda
- Hjärna
- belastning
- men
- by
- burar
- beräknat
- anropande
- rum
- Cancer
- Vid
- fall
- CCD-
- cellen
- Celler
- Förändringar
- laddning
- kemisk
- Rensa
- klick
- Klinisk
- Stäng
- spole
- kombination
- kombinera
- kommersiella
- kommitté
- jämförbar
- jämfört
- jämförelser
- fullständigt
- fullborda
- koncentration
- tillstånd
- villkor
- genomfördes
- förtroende
- BEKRÄFTAT
- i följd
- kontinuitet
- kontinuerligt
- kontroll
- kontrolleras
- omvänt
- kyla
- Korrigerad
- Korrigeringar
- Motsvarande
- Rådet
- kopplad
- beläggning
- skapa
- skapas
- Skapa
- Kreativ
- kriterier
- kritisk
- CT-skanningar
- beställnings
- Klipp
- mörkt
- datum
- datauppsättningar
- dag
- Dagar
- de
- definierade
- leverera
- beroende
- beskriven
- Designa
- önskas
- detaljer
- detekterad
- Detektering
- Bestämma
- bestämd
- bestämmande
- utvecklade
- anordning
- diagnostik
- DID
- Skillnaden
- skillnader
- olika
- Diffusion
- digital
- utspädd
- riktning
- Sjukdom
- skålen
- Dispersion
- fördelning
- Distributioner
- dividerat
- do
- gör
- gjort
- dos
- dras
- Drop
- varaktighet
- dynamisk
- Dynamiken
- e
- E&T
- varje
- lätt
- missar
- effektivitet
- antingen
- inbäddade
- möjliggöra
- möjliggör
- Slutpunkt
- förbättrad
- Hela
- enzymatisk
- utrustad
- etablerade
- etablering
- uppskatta
- Eter (ETH)
- etik
- Giltigt körkort
- utvärdera
- Varje
- undersökning
- överskrids
- Utom
- förväntan
- förväntat
- experimentera
- experimentell
- experiment
- förklarade
- export
- extern
- främja
- faktor
- kvinna
- fält
- Fig.
- Figur
- fyllda
- filtrera
- filter
- slutlig
- Slutligen
- Förnamn
- montering
- fixerad
- Blixt
- följt
- efter
- För
- formen
- formaldehyd
- Formellt
- vidare
- fyra
- från
- frystes
- fungera
- ytterligare
- spalt
- ge
- GE Healthcare
- Allmänt
- generera
- genereras
- Ge
- god
- gradienter
- Gram
- Grön
- Grupp
- Gruppens
- Tillväxt
- riktlinjer
- Har
- he
- Hälsa
- hälso-och sjukvård
- friska
- Hjärta
- HTTPS
- huang
- humant
- kravet
- ID
- identiska
- if
- bild
- bildanalys
- bilder
- Imaging
- blir omedelbart
- nedsänkt
- förbättrar
- in
- ingår
- införlivande
- ökande
- inkuberades
- Inkuberar
- INKUBATION
- oberoende
- index
- induktion
- informationen
- inledande
- inre
- inuti
- instrument
- integrerade
- interaktiva
- intresse
- inre
- in
- införa
- iteration
- iterationer
- DESS
- KDA-förlängning
- hålla
- utrustning
- l2
- Large
- Lasern
- lasrar
- lager
- skikt
- lämnar
- vänster
- Lins
- linser
- livet
- ljus
- linje
- LINK
- kopplade
- läser in
- laster
- lokal
- förlust
- Makro
- makron
- bibehålla
- underhåll
- manuellt
- mask
- Masker
- matchande
- Materialet
- material
- matematisk
- Matris
- maximal
- betyder
- mäta
- mätt
- mätningar
- mätning
- Media
- Minne
- merino
- Metanol
- metoder
- möss
- Mikroskop
- Mikroskopi
- min
- minsta
- mindre
- blandad
- blandning
- ML
- Mobil
- Mode
- modell
- modeller
- modifierad
- modul
- molekylär
- övervakas
- övervakning
- rörelse
- mus
- MRT
- MS
- MT
- multipel
- nanoteknologi
- Natur
- nätverk
- Neutral
- Nya
- Nej
- Brus
- normala
- mål
- observerad
- få
- erhållna
- of
- Gamla
- on
- ONE
- drift
- operativa
- Verksamhet
- optimerad
- or
- Orca
- ursprungliga
- över
- natten
- oxford
- Syrgas
- Papper
- parametrar
- Park
- del
- partikel
- PBS
- Peg
- genomslag
- för
- utfört
- utför
- husdjur
- Petri
- Faserna
- pivot
- pixel
- placeras
- plan
- Planes
- plato
- Platon Data Intelligence
- PlatonData
- Punkt
- poäng
- portfölj
- placera
- placerad
- Precision
- beredd
- presentera
- tidigare
- förfaranden
- förfaranden
- bearbetning
- progressivt
- protokoll
- Qi
- kvantitativ
- radio
- slumpmässig
- randomized
- RÅTTA
- Betygsätta
- ratio
- Reagera
- Reaktionen
- Läsare
- rimlig
- skäl
- mottagna
- mottagning
- registreras
- Recover
- Red
- minska
- Minskad
- minskar
- referens
- region
- förblev
- resterna
- ta bort
- avlägsnas
- bort
- Rapporterad
- Rapportering
- representativ
- Obligatorisk
- forskning
- resistent
- Upplösning
- respektive
- respons
- resultera
- resulterande
- Resultat
- Roboten
- Rum
- kör
- s
- SA
- Samma
- sparande
- skannar
- spridda
- SCI
- vetenskaplig
- skript
- Andra
- sekundär
- §
- sektioner
- se
- segmentet
- segmentering
- vald
- Sekvens
- eras
- inställningar
- flera
- ark
- visas
- Signal
- Signalfördelning
- liknande
- eftersom
- enda
- SEX
- Storlek
- Skiva
- Small
- So
- natrium
- Mjukvara
- lösning
- Lösningar
- rumsliga
- Stabilitet
- stapel
- Stacks
- statistisk
- stellaris
- Steg
- lagras
- rand
- student
- studier
- senare
- Senare
- svit
- yta
- Symptom
- syntes
- system
- T
- T1
- bord
- tar
- tech
- Tekniken
- teleskop
- mall
- tio
- testa
- testade
- den där
- Smakämnen
- deras
- Dem
- sedan
- teoretiska
- Terapeutisk
- terapi
- detta
- grundligt
- de
- tre
- tredimensionella
- Genom
- hela
- tid
- gånger
- vävnad
- till
- tillsammans
- verktyg
- verktyg
- Totalt
- mot
- mot
- omvandla
- behandling
- Triton
- försöker
- tumörer
- två
- Typ
- typiskt
- opåverkad
- under
- tills
- på
- Begagnade
- Användare
- med hjälp av
- Värden
- vehikel
- Kontra
- via
- Video
- Video
- utsikt
- Virtuell
- visualisera
- lever
- volym
- volymer
- volymetrisk
- gåbil
- trollspö
- var
- tvättning
- Vatten
- we
- veckor
- vikt
- Välfärd
- były
- Hjul
- som
- medan
- vit
- fönster
- med
- inom
- utan
- X
- Avkastning
- vilket gav
- utbyten
- zephyrnet
- zoom