16 januari 2024
(Nanowerk Nyheter) En viktig kemisk reaktion – där rörelsen av protoner mellan ytan på en elektrod och en elektrolyt driver en elektrisk ström – är ett kritiskt steg i många energitekniker, inklusive bränsleceller och elektrolysörer som används för att producera vätgas. För första gången har MIT-kemister kartlagt i detalj hur dessa protonkopplade elektronöverföringar sker vid en elektrodyta. Deras resultat kan hjälpa forskare att designa effektivare bränsleceller, batterier eller annan energiteknik. "Vårt framsteg i den här artikeln var att studera och förstå naturen av hur dessa elektroner och protoner kopplas ihop på en ytplats, vilket är relevant för katalytiska reaktioner som är viktiga i samband med energiomvandlingsanordningar eller katalytiska reaktioner", säger Yogesh Surendranath, en professor i kemi och kemiteknik vid MIT och seniorförfattaren till studien. Bland deras fynd kunde forskarna spåra exakt hur förändringar i pH i elektrolytlösningen som omger en elektrod påverkar hastigheten för protonrörelse och elektronflöde i elektroden. MIT doktorand Noah Lewis är huvudförfattare till tidningen, som visas idag i Naturkemi ("Ett mekanistiskt ramverk på molekylär nivå för gränssnittsprotonkopplad elektronöverföringskinetik"). Ryan Bisbey, en tidigare postdoc vid MIT; Karl Westendorff, doktorand vid MIT; och Alexander Soudackov, en forskare vid Yale University, är också författare till artikeln.
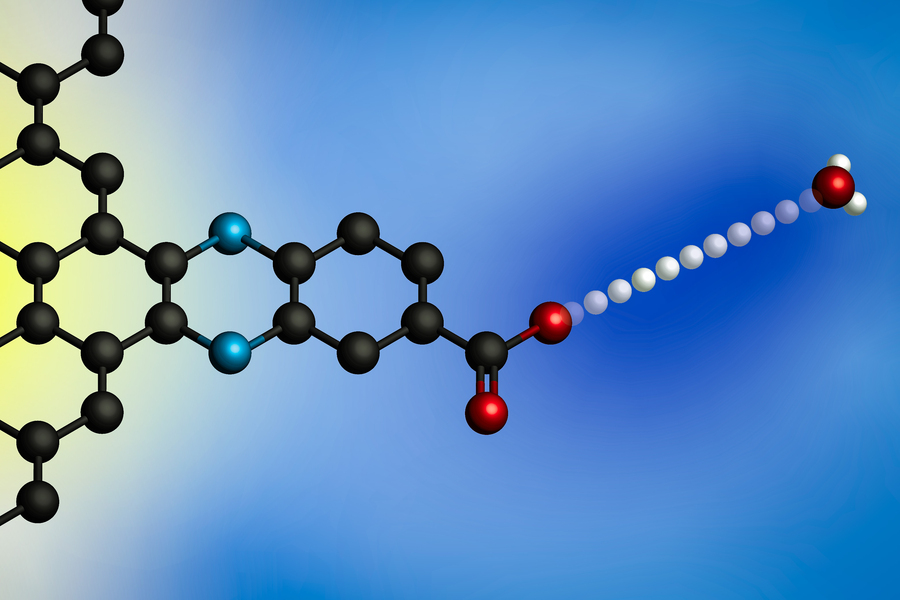 Att applicera en elektrisk potential gör att en proton överförs från en hydroniumjon (till höger) till en elektrods yta. Med hjälp av elektroder med molekylärt definierade protonbindningsställen utvecklade MIT-forskare en generell modell för dessa gränssnittsprotonkopplade elektronöverföringsreaktioner. (Bild: med tillstånd av forskarna)
Att applicera en elektrisk potential gör att en proton överförs från en hydroniumjon (till höger) till en elektrods yta. Med hjälp av elektroder med molekylärt definierade protonbindningsställen utvecklade MIT-forskare en generell modell för dessa gränssnittsprotonkopplade elektronöverföringsreaktioner. (Bild: med tillstånd av forskarna)
 Att applicera en elektrisk potential gör att en proton överförs från en hydroniumjon (till höger) till en elektrods yta. Med hjälp av elektroder med molekylärt definierade protonbindningsställen utvecklade MIT-forskare en generell modell för dessa gränssnittsprotonkopplade elektronöverföringsreaktioner. (Bild: med tillstånd av forskarna)
Att applicera en elektrisk potential gör att en proton överförs från en hydroniumjon (till höger) till en elektrods yta. Med hjälp av elektroder med molekylärt definierade protonbindningsställen utvecklade MIT-forskare en generell modell för dessa gränssnittsprotonkopplade elektronöverföringsreaktioner. (Bild: med tillstånd av forskarna)
Passerande protoner
Protonkopplad elektronöverföring sker när en molekyl, ofta vatten eller en syra, överför en proton till en annan molekyl eller till en elektrodyta, vilket stimulerar protonacceptorn att också ta upp en elektron. Denna typ av reaktion har utnyttjats för många energitillämpningar. "Dessa protonkopplade elektronöverföringsreaktioner är allestädes närvarande. De är ofta nyckelsteg i katalytiska mekanismer och är särskilt viktiga för energiomvandlingsprocesser som vätegenerering eller bränslecellskatalys, säger Surendranath. I en vätegenererande elektrolysator används detta tillvägagångssätt för att ta bort protoner från vatten och lägga till elektroner till protonerna för att bilda vätgas. I en bränslecell genereras elektricitet när protoner och elektroner avlägsnas från vätgas och tillsätts syre för att bilda vatten. Protonkopplad elektronöverföring är vanlig i många andra typer av kemiska reaktioner, till exempel koldioxidreduktion (omvandling av koldioxid till kemiska bränslen genom att tillsätta elektroner och protoner). Forskare har lärt sig mycket om hur dessa reaktioner uppstår när protonacceptorerna är molekyler, eftersom de exakt kan kontrollera strukturen för varje molekyl och observera hur elektroner och protoner passerar mellan dem. Men när protonkopplad elektronöverföring sker vid ytan av en elektrod är processen mycket svårare att studera eftersom elektrodytorna vanligtvis är mycket heterogena, med många olika platser som en proton potentiellt kan binda till. För att övervinna det hindret utvecklade MIT-teamet ett sätt att designa elektrodytor som ger dem mycket mer exakt kontroll över elektrodytans sammansättning. Deras elektroder består av ark av grafen med organiska, ringhaltiga föreningar fästa på ytan. I slutet av var och en av dessa organiska molekyler finns en negativt laddad syrejon som kan ta emot protoner från den omgivande lösningen, vilket gör att en elektron flödar från kretsen till den grafitiska ytan. "Vi kan skapa en elektrod som inte består av en stor mångfald av platser utan är en enhetlig uppsättning av en enda typ av mycket väldefinierade platser som var och en kan binda en proton med samma affinitet," säger Surendranath. "Eftersom vi har dessa mycket väldefinierade platser, vad detta tillät oss att göra var att verkligen reda ut kinetiken för dessa processer." Med hjälp av detta system kunde forskarna mäta flödet av elektrisk ström till elektroderna, vilket gjorde det möjligt för dem att beräkna hastigheten för protonöverföring till syrejonen vid ytan vid jämvikt - tillståndet när protondonationshastigheten till ytan och protonöverföringen tillbaka till lösningen från ytan är lika. De fann att pH i den omgivande lösningen har en betydande effekt på denna hastighet: De högsta nivåerna inträffade i de yttersta ändarna av pH-skalan - pH 0, det suraste, och pH 14, det mest basiska. För att förklara dessa resultat utvecklade forskarna en modell baserad på två möjliga reaktioner som kan uppstå vid elektroden. 3O+), som är i hög koncentration i starkt sura lösningar, levererar protoner till ytan av syrejoner och genererar vatten. I den andra levererar vatten protoner till ytan av syrejoner och genererar hydroxidjoner (OH-), som är i hög koncentration i starkt basiska lösningar. Hastigheten vid pH 0 är dock ungefär fyra gånger snabbare än hastigheten vid pH 14, delvis på grund av att hydronium avger protoner i en snabbare hastighet än vatten.En reaktion att ompröva
Forskarna upptäckte också, till sin förvåning, att de två reaktionerna har samma hastighet, inte vid neutralt pH 7, där hydronium- och hydroxidkoncentrationerna är lika, utan vid pH 10, där koncentrationen av hydroxidjoner är 1 miljon gånger den för hydronium. Modellen antyder att detta beror på att den framåtriktade reaktionen som involverar protondonation från hydronium eller vatten bidrar mer till den totala hastigheten än den bakåtreaktion som involverar protonavlägsnande med vatten eller hydroxid. Befintliga modeller av hur dessa reaktioner uppstår vid elektrodytor antar att reaktionerna framåt och bakåt bidrar lika till den totala hastigheten, så de nya rönen tyder på att dessa modeller kan behöva omprövas, säger forskarna. "Det är standardantagandet, att framåt- och bakåtreaktionerna bidrar lika mycket till reaktionshastigheten," säger Surendranath. "Vårt fynd är verkligen ögonöppnande eftersom det betyder att antagandet som människor använder för att analysera allt från bränslecellskatalys till väteutveckling kan vara något vi behöver se över." Forskarna använder nu sin experimentella uppställning för att studera hur tillsats av olika typer av joner till elektrolytlösningen som omger elektroden kan påskynda eller sakta ner hastigheten för protonkopplat elektronflöde. "Med vårt system vet vi att våra webbplatser är konstanta och inte påverkar varandra, så vi kan läsa ut vad förändringen i lösningen gör med reaktionen på ytan", säger Lewis.- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- Källa: https://www.nanowerk.com/news2/green/newsid=64425.php
- : har
- :är
- :inte
- :var
- $UPP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Able
- Om Oss
- Acceptera
- lägga till
- lagt till
- tillsats
- avancera
- påverka
- påverkar
- Alexander
- tillåts
- också
- bland
- an
- analysera
- och
- Annan
- visas
- tillämpningar
- Tillämpa
- tillvägagångssätt
- ÄR
- array
- AS
- utgå ifrån
- Antagandet
- At
- Författaren
- Författarna
- tillbaka
- baserat
- grundläggande
- batterier
- BE
- därför att
- varit
- mellan
- binda
- bindande
- men
- by
- beräkna
- KAN
- kol
- koldioxid
- Orsakerna
- cellen
- Celler
- Centrum
- byta
- Förändringar
- laddad
- kemisk
- kemi
- Apotek
- Gemensam
- sammansättning
- koncentration
- konstant
- sammanhang
- bidra
- bidrar
- kontroll
- Konvertering
- kunde
- Par
- skapa
- kritisk
- Aktuella
- Datum
- behandla
- Standard
- definierade
- leverera
- levererar
- Designa
- detalj
- utvecklade
- enheter
- olika
- svårt
- upptäckt
- Mångfald
- do
- inte
- gör
- donation
- ner
- enheter
- varje
- effekt
- effektiv
- elektriska
- el
- elektrolyt
- elektroner
- änden
- slutar
- energi
- Teknik
- lika
- lika
- Jämvikt
- Eter (ETH)
- allt
- Utvecklingen
- exakt
- exempel
- befintliga
- experimentell
- Förklara
- extrem
- snabbare
- finna
- resultat
- Förnamn
- första gången
- flöda
- För
- formen
- Tidigare
- Framåt
- hittade
- fyra
- Ramverk
- från
- Bränsle
- bränsleceller
- bränslen
- GAS
- Allmänt
- genereras
- generera
- generering
- ger
- uppgradera
- grafen
- stor
- hända
- utnyttjas
- Har
- Hjärta
- hjälpa
- Hög
- högsta
- Hur ser din drömresa ut
- Men
- HTTPS
- Hydrering
- bild
- med Esport
- in
- Inklusive
- in
- involverar
- IT
- jpg
- karl
- Nyckel
- Snäll
- Vet
- leda
- lärt
- Lewis
- många
- Maj..
- betyder
- mäta
- mekanismer
- Mitten
- miljon
- MIT
- MIT examen
- modell
- modeller
- molekyl
- mer
- mer effektiv
- mest
- rörelse
- rörelse
- mycket
- Natur
- Behöver
- negativt
- Neutral
- Nya
- Noah
- nu
- observera
- hinder
- inträffa
- inträffade
- of
- Ofta
- on
- or
- ekologisk
- Övriga
- vår
- ut
- över
- övergripande
- Övervinna
- Syrgas
- Papper
- del
- särskilt
- passera
- Personer
- plato
- Platon Data Intelligence
- PlatonData
- möjlig
- potentiell
- potentiellt
- exakt
- exakt
- process
- processer
- producera
- Professor
- protoner
- Betygsätta
- rates
- Reaktionen
- reaktioner
- Läsa
- verkligen
- reduktion
- relevanta
- avlägsnande
- ta bort
- avlägsnas
- Renewable
- förnybar energi
- forskning
- forskare
- Resultat
- avslöjar
- vända
- höger
- Ryan
- s
- Samma
- säga
- säger
- Skala
- Forskare
- vetenskapsmän
- Andra
- senior
- inställning
- signifikant
- enda
- webbplats
- Områden
- långsam
- So
- lösning
- Lösningar
- något
- fart
- Ange
- Steg
- Steg
- stimulerar
- starkt
- struktur
- student
- Läsa på
- Studerar
- sådana
- föreslå
- Föreslår
- yta
- överraskning
- kring
- system
- Ta
- grupp
- Tekniken
- än
- den där
- Smakämnen
- Staten
- deras
- Dem
- Dessa
- de
- detta
- de
- tid
- gånger
- till
- i dag
- spåra
- överföring
- överföringar
- två
- Typ
- typer
- allmänt förekommande
- förståelse
- universitet
- reda ut
- us
- Begagnade
- med hjälp av
- vanligen
- mycket
- var
- Vatten
- Sätt..
- we
- väldefinierad
- były
- Vad
- när
- som
- bred
- med
- inom
- zephyrnet