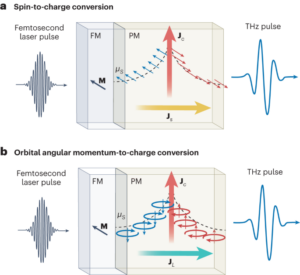
Alla reagenser användes som de mottogs om inte annat anges. Alla kemikalier köptes från Sigma Aldrich förutom räknepärlorna (CountBright Absolute Counting Beads, Invitrogen). ζ-Potential mättes med hjälp av en Zetasizer NanoZS90 (Malvern Instruments). Partiklarnas storlek och morfologi studerades av SEM i ett JEOL JSM 7800F Prime-mikroskop med integrerad EDS för att tillhandahålla elementaranalys. Partikelstorleken bestämdes genom att mäta 50 oberoende partiklar. Radio omedelbar tunnskiktskromatografi (ITLC) utvecklades på Agilent Technologies glasmikrofiberkromatografipapper impregnerat med kiselsyra och analyserades med hjälp av en Lablogic Flow-count TLC-skanner och en BioScan B-FC-3200 fotomultiplikatorrör (PMT) detektor med Laura programvara. Den mobila ITLC-fasen bestod av 0.175 M citronsyra och 0.325 M trinatriumcitrat i vatten om inte annat anges. Radioaktiva prover mättes med användning av en Capintec CRC-25R (Capintec) eller en LKB Wallac 1282 Compugamma CS (PerkinElmer) för vilka data samlades in med hjälp av EdenTerm-mjukvaran. Flödescytometriexperiment utfördes i en BD FACSMelody cellsorterare med användning av BD FACSChorus Software. PET/CT-bilder förvärvades med hjälp av en NanoPET/CT-skanner (Mediso), rekonstruerade med Nucline v.0.21-programvara, och bilder analyserades med VivoQuant-programvara (version 3.5, InviCRO). Listmode-data erhölls av ett specifikt MATLAB-mjukvaruverktyg utvecklat av Mediso. Autoradiografi utfördes i ett GE Amersham Typhoon-instrument.
Syntes av kiseldioxidpartiklar av submikrometerstorlek
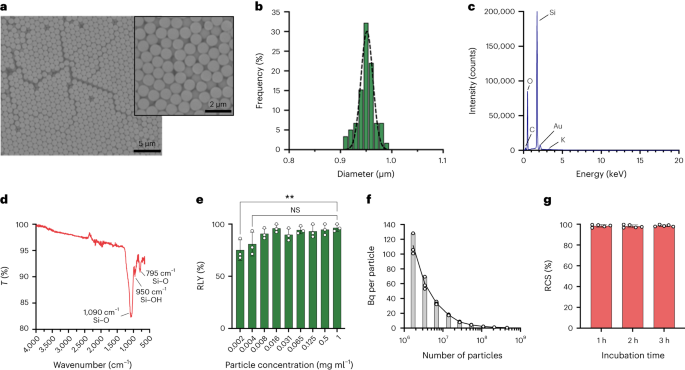
Partiklarna syntetiserades med hjälp av Stöber-metoden. Denna metod är baserad på hydrolys och konsekutiv kondensation av kiselalkoxider för att producera monodispersa, sfäriska kiseldioxidpartiklar27. Tetraetylortosilikat (TEOS) användes som kiselkälla, ammoniak som baskatalysator och kaliumklorid som elektrolyt. En lösning av TEOS i etanol sattes kontinuerligt till en lösning innehållande katalysatorn och elektrolyten. Modifiering av reagensstartkvantiteten eller tillsatshastigheten ger skillnader i partikelstorleken som tidigare rapporterats28. Här framställdes två lösningar före syntesen av partiklarna: lösning 1 innehållande 19.0 mmol TEOS i 33.3 ml EtOH och lösning 2 innehållande 0.23 mmol KCl i 9 ml ammoniak, 65 ml EtOH och 6.75 ml H2O. För syntesen placerades lösning 2 i en 250 ml rundbottnad kolv uppvärmd till 50 °C under omrörning vid 300 rpm i 15 min. Sedan tillsattes lösning 1 droppvis till lösning 2 (tillförselhastighet 0.2 ml min.-1). Efter tillsats av lösning 1 renades de erhållna partiklarna genom centrifugering vid 18,300 XNUMX°Cg under 3 min och tvättades med EtOH fem gånger. Slutligen SiO2 mikropartiklar torkades under vakuum.
Ympning av submikrometerstora partiklar med silan–PEG5k
En 20 mg ml-1 lösning av silan-PEG5k (Sigma Aldrich) i EtOH 98 % tillsattes över en lösning av smSiP vid 5 mg ml-1 i EtOH 98 % och 2.8 % ammoniak. Blandningen omrördes över natten vid rumstemperatur och partiklarna utvanns genom centrifugering vid 18,300 XNUMX°Cg i 3 min. Slutligen tvättades partiklarna tre gånger med destillerat vatten och torkades under vakuum över natten. Tvättlösningarna frystorkades över natten och mängden obunden silan-PEG5k viktad för beräkningen av reaktionsutbytet. A 0.05 mg ml-1 lösning av smSiP–PEG5k i destillerat vatten användes för ytterligare radiomärkningsreaktioner.
[68Ga]GaCl3
Gallium-68 eluerades som [68Ga]GaCl3 från en Eckert och Ziegler 68Ge /68Ga-generator i ultraren HCl (4 ml, 0.1 M) tillverkad enligt kraven på god tillverkningssed (ABX).
Koncentrationen av [68Ga]GaCl3 eluering genom katjonbyte
Koncentrationen av elueringen utfördes med användning av den uppställning som beskrivs i tilläggsbilden. 1. Först, 4 ml av [68Ga]GaCl3 eluering laddades på en Strata-X-C 33u patron (Phenomenex) och eluatet kasserades. Därefter tvättades patronen med 5 µml av en aceton/0.1 µM HCl-lösning (80:20) och eluatet kasserades. Slutligen, den koncentrerade [68Ga]GaCl3 uppsamlades genom att tillsätta 700 µl av en lösning av aceton/0.05 µM HCl (98:2), torkad under N2 ström och återsuspenderades i 50 µl 0.5 M HEPES-buffert, (pH 4.9). Radio-TLC utfördes i de olika stadierna för kvalitetskontroll. Protokollet tar cirka 20 min och ger ett återvinningsutbyte på 86.2 ± 8.5%.
Radiomärkning av kiseldioxidpartiklar i olika koncentrationer med 68Ga
Kiseldioxidpartiklar återsuspenderades i olika koncentrationer (från 1 till 0.002 mg ml-1) i 0.5 M HEPES-buffert (pH 4.9). Sedan tillsattes 50 µl av lösningen i ett reaktionsrör före tillsatsen av den koncentrerade [68Ga]GaCl3 eluering i 50 µl 0.5 M HEPES-buffert (pH 4.9). Reaktioner utfördes vid 90°C under 30 minuter, och radio-TLC utfördes för att beräkna det radiokemiska utbytet.
Mätning av partikelkoncentration genom flödescytometri
Partikelkoncentrationer beräknades genom flödescytometri med användning av räknekulor (CountBright Absolute Counting Beads, Invitrogen) enligt tillverkarens instruktioner. Kiseldioxidpartiklar återsuspenderades vid 0.05 mg mg ml-1, sonikerades i 10 min och passerade genom ett 10 µm filter med cut-off-storlek (KX sprutfilter, nylon, 25 mm, 10 µm). CountBright Absolute Counting Beads värmdes till rumstemperatur och vortexade i 30 sekunder. Sedan sattes 50 µl pärlor till 300 µl kiseldioxidpartiklar och blandningen virvlades i 30 µmin för att erhålla en homogen lösning. Provet kördes på flödescytometern och tröskelvärdet för framåtspridning (FSC) ställdes in för att inkludera pärlorna och partiklarna på den linjära FSC kontra linjära sidans spridningsdiagram. Efteråt justerades fluorescensdetektorspänningen för räknepärlorna och en grindstrategi utfördes för att isolera kiseldioxidpartiklarna och räknepärlpopulationerna. Slutligen ritades portar på partiklarna och de absolut räknande pärlorna och 1,000 XNUMX pärlhändelser registrerades för varje prov. Med denna strategi beräknades antalet partiklar i lösningen med hjälp av följande ekvation:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Particles}}{{{upmul}}}höger)=displaystylefrac{({mathrm{ Partiklar}},{mathrm{count}},times,{mathrm{Counting}},{mathrm{beads}},{mathrm{volym}})}{({mathrm{Counting}},{mathrm{beads}} ,{mathrm{count}},times,{mathrm{Particles}},{mathrm{volym}})} gånger,{mathrm{Counting}},{mathrm{beads}},{mathrm{concentration}}vänster(frac {{mathrm{Beads}}}{{{upmul}}}höger)end{array}$$
Radiomärkning av 500 smSiP
Femhundra smSiP sattes till 50 µl av den koncentrerade [68Ga]GaCl3 eluering i 0.5 M HEPES-buffert pH 4.9. Sedan tillsattes 5.6 µl polysorbat 80 och blandningen upphettades vid 90°C under 30 µmin vid 900 rpm i en termisk bländare. Efteråt utformades ett slutligt reningsprotokoll i flera steg för att avlägsna oreagerat/kolloidalt 68Ga. Femtio mikroliter 10 mM EDTA tillsattes och blandningen inkuberades 5 min vid rumstemperatur. Därefter centrifugerades partiklarna under 3 min vid 18,300 XNUMXg, återsuspenderades i 500 µl PBS innehållande 1 mM EDTA + 0.1 % polysorbat 80 och vortexade försiktigt i 10 s. Partiklarna centrifugerades igen, tvättades med en lösning av 0.1 mM EDTA + 0.1 % polysorbat 80 i PBS och vortexades försiktigt i 10 s. Slutligen centrifugerades partiklarna och tvättades ytterligare fem gånger med PBS + 0.1 % polysorbat 80 och återsuspenderades i 500 µl PBS. Radiomärkningsreaktionen övervakades med radio-TLC under de successiva reaktionsstegen för att utvärdera närvaron av kolloider (som kan förväxlas med partiklar om de inte tas bort på rätt sätt), radiomärkningen av partiklarna och renheten hos slutprodukten. RLY beräknades genom jämförelse mellan mängden radioaktivitet i partiklarna och supernatanterna efter tvättningsstegen.
fraktione
För fraktioneringsstrategin, volymer från 0.5 µl till 20 µl av 68Ga-smSiP vid en teoretisk koncentration av 1 partikel µl-1 sattes till olika provrör i steg om 1 µl (0.5, 1, 2, 3…) och PBS tillsattes för att få den slutliga volymen till 50 µl. Sedan pipetterades 37.5 µl från det första röret i ett andra provrör, 25 µl av det andra röret i ett tredje rör och slutligen 12.5 µl av det tredje röret till ett fjärde rör. Denna strategi ger fyra rör per prov med en slutlig volym på 12.5 µl per rör. Radioaktiviteten i varje rör mättes i en gammaräknare och värdena beräknades i kBq med hjälp av en kalibreringskurva, för ytterligare jämförelse och analys. Proverna som innehöll det mesta av radioaktiviteten i endast ett rör sonikerades i 30 s vid rumstemperatur och utsattes för ett andra fraktioneringssteg. Sedan användes proverna i vilka all radioaktivitet hittades i ett enda rör (med försumbar aktivitet i de andra tre rören) för ytterligare in vivo/ex vivo-experiment.
PET/CT-fantomavbildning
Ett fantomavbildningsexperiment utfördes med en 68Ga-smSiP. En kanyl användes för att leverera partikeln i ett provrör för att utvärdera om en enskild partikel kunde förbli instängd i kanylslangen under administrering. Kortfattat placerades fantomröret i nanoPET/CT-skannern med änden av kanylspetsen fäst vid röret. Efter start av PET-insamlingen levererades partikeln återsuspenderad i 100 µl PBS med en insulinspruta fäst vid början av kanylen. Sedan tvättades kanylen med 50 µl PBS för att säkerställa leveransen av partikeln in i fantomröret. PET-förvärvet genomfördes i 2 timmar följt av en standard CT-skanning.
In vivo PET/CT-avbildning
Djuravbildningsstudier granskades etiskt och utfördes i enlighet med Animals (Scientific Procedures) Act 1986 (ASPA) UK Home Office-bestämmelser som reglerar djurförsök. In vivo-avbildning utfördes på friska 8 veckor gamla BALB/c-möss. Djuren sövdes med isofluran (2–3 % i syre), kanylerades och placerades på skannerbädden under narkos. Sängen värmdes upp till 37 °C av inre luftflöde för att hålla djuret vid normal kroppstemperatur, och andningshastigheten övervakades och hölls vid 60–80 andetag min.-1 under hela skanningen. Att upprätthålla kontroll över djurets temperatur är viktigt, eftersom en oväntad temperatursänkning kan leda till en minskning av hastigheten för partikeln i blodet. Ett 68Ga-smSiP (n = 4) eller 68Ga-smSiP–PEG5k partikel (n = 2) administrerades genom kanylen i 100 µl PBS, följt av tvättning med 50 µl PBS efter start av PET-insamlingen (1:5 koincidensläge; 5 ns koincidenstidsfönster). PET registrerades i 2 timmar, och sedan utfördes en halvcirkelformad CT-skanning. Djurens kroppstemperatur och andningshastighet övervakades under hela processen. Dynamiska PET/CT-bilder rekonstruerades med Tera-Tomo 3D-rekonstruktion (400–600 keV energifönster, 1:5 koincidensläge, 20 iterationer och 1 delmängd) vid en voxelstorlek på 0.4 × 0.4 × 0.4 mm3 och korrigerad för dämpning, spridning och förfall. Listlägesdata för alla PET/PEPT-förvärv kan hittas för 68Ga-smSiP vid ref. 29 och för 68Ga-smSiP–PEG5k vid ref. 30.
Spårning i realtid
Först exporterades data från skannern i listlägesformat (det vill säga ett format med en tidsstämpel och kristallindex för detekterade koincidensfotoner). En geometrisk transformation tillämpades för att omvandla från kristallindex till position i mm-enheter. Birmingham-metoden beräknar iterativt MDP från en delmängd av alla LoRs. Den gör detta genom att kassera LoRs som är längre än ett visst avstånd från MDP eftersom dessa sannolikt kommer från falska LoRs, till exempel LoRs som kan härröra från spridning. MDP förfinas med varje iteration; antalet iterationer ställs effektivt in av f-faktor och relaterar till det totala antalet LoR som används för att uppskatta den slutliga partikelpositionen inom den delmängden (till exempel en f-faktorn 0.5 betyder att iterationsslingan kommer att avslutas när 50 % av LoRs i delmängden återstår). Antalet LoR som används i en delmängd kan reduceras för att förbättra den tidsmässiga samplingen (delmängderna är tidskonsekutiva utan överlappning) till priset av att osäkerheten i position ökar (ytterligare detaljer om algoritmen finns i Parker et al.5) Birmingham-metoden användes för att analysera listlägesdata från PET-skannern. En adaptiv provstorlek användes för att spåra partikeln i mössen. Provstorleken ställdes in för att uppnå en balans mellan tillräcklig tidsprovtagning samtidigt som positioneringsfel minimerades. En provstorlek mellan 100 och 200 LoRs användes i de tidiga stadierna av skanningarna (<60 s från skanningens start), med f = 0.1, vilket ger cirka 1–5 s intervaller. Vid skanningstider >60 s varierades provstorlekarna mellan 1,000 2,000 och 30 60, vilket gav tidsintervall på mellan XNUMX s och XNUMX s beroende på in vivo-experimentet. Antalet räkningar som används för att beräkna MDP (i den slutliga iterationen) kan hittas genom att multiplicera urvalsstorleken med f-faktorvärde. Dessa parametrar var baserade på tidigare erfarenheter och informerade av tidigare publikationer1.
Hastighet erhölls som (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) var ({v}_{m}^{2}) är hastigheten i x, y och z riktningar.
Ex vivo organupptag
Upptag i olika organ utvärderades genom gammaräkning. Efter in vivo PET/CT-avbildning dödades djuren genom cervikal dislokation och organ skars ut och vägdes för radioaktivitetsräkning i en gammaräknare (LKB Wallac 1282 Compugamma CS). Data uttrycktes som procentandel injicerad dos (dos i organet/total dos injicerad) per gram vävnad (%ID g-1).
Autoradiografi
Radioaktiviteten i lungorna spårades med en strålningsdetektor (EP15-sond, Morgan), och lungorna skars i små sektioner med en skalpell tills en liten del av vävnaden med den radioaktiva signalen erhölls. Vävnaden snabbfrystes i -80 °C isopropanol. Omedelbart efter frysning bäddades vävnaden in i medium med optimal skärtemperatur och skars i en kryostat i 20 µm skivor. Varje skiva undersöktes med detektorn tills den radioaktiva skivan hittades. Den föregående (under bakgrunden), radioaktiva och nästa (under bakgrunden) skivan placerades på ett Superfrost-mikroskopobjektglas (Epredia). Resten av den återstående vävnaden låg också under bakgrunden. Objektglaset med de tre sektionerna täcktes med matfilm och ställdes mot en GE autoradiografiplatta över natten. Plattan analyserades med GE Amersham Typhoon med 25 µm upplösning och PMT-inställning på 4,000 1. Autoradiografibilden lades ovanpå bilden av vävnaden och visade en radioaktivitetsfläck i den radioaktiva skivan. För kvantifieringen bereddes standarder i olika kända aktiviteter, och var och en sågs som 5 µl kvintett i papper. Fläckarna inkuberades i samma lagringsfosforskärm, BAS-IP MS (Multipurpose Standard) från GE som de enskilda partiklarna kvantifierades. Bilden togs med Amersham Typhoon 2.0 med Control Software version 100 i fosforläge med en pixelstorlek på 4,000 µm och en känslighet på 10.0 261. Bilderna kvantifierades med programvaran ImageQantTL vXNUMX-XNUMX med hjälp av gelkvantifieringsverktygslådan. Fläckarna korrigerades genom att välja en region omedelbart före eller efter fläcken som en konstant bakgrund. Den resulterande volymen av fläcken användes för att beräkna Bq i partikeln på basis av kalibreringskurvan.
Statistik och reproducerbarhet
För kvantitativ analys analyserades minst tre biologiska replikat exklusive in vivo-data från 68Ga-smSiP–PEG5k (n = 2). Data analyserades genom vanlig envägsvariansanalys (ANOVA) med Dunnetts multipla jämförelsetest och Students t-testa. A P värde <0.05 ansågs vara statistiskt signifikant.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- Källa: https://www.nature.com/articles/s41565-023-01589-8
- :är
- :inte
- :var
- ][s
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- Absolut
- överensstämmelse
- Uppnå
- förvärvade
- förvärv
- förvärv
- Agera
- aktiviteter
- aktivitet
- adaptiv
- lagt till
- tillsats
- Dessutom
- justerat
- administreras
- administrering
- framsteg
- Efter
- efteråt
- igen
- LUFT
- AL
- algoritm
- Alla
- också
- Ammoniak/ammonium
- mängd
- an
- analysera
- analys
- Ankare
- och
- djur
- djur
- tillämpas
- cirka
- ÄR
- stiga upp
- AS
- At
- b
- bakgrund
- Balansera
- bas
- baserat
- grund
- BD
- BE
- innan
- Börjar
- nedan
- mellan
- birmingham
- blod
- kropp
- i korthet
- föra
- buffert
- by
- beräkna
- beräknat
- beräknar
- beräkning
- KAN
- genom
- Katalysator
- cellen
- kemikalier
- välja
- klick
- tillfällighet
- jämförelse
- jämförelser
- sammansatt
- Koncentrerad
- koncentration
- genomfördes
- förväxlas
- i följd
- anses
- konstant
- kontinuerligt
- kontroll
- kontrolleras
- konvertera
- Korrigerad
- Pris
- kunde
- Motverka
- räkna
- omfattas
- Kristall
- cs
- kurva
- Klipp
- skärning
- datum
- leverera
- levereras
- leverans
- beroende
- beskriven
- utformade
- detaljer
- detekterad
- bestämd
- utvecklade
- skillnader
- olika
- riktningar
- förskjutning
- avstånd
- gör
- dos
- dras
- Drop
- under
- dynamisk
- e
- E&T
- varje
- Tidig
- effektivt
- elektrolyt
- inbäddade
- utsläpp
- anställd
- änden
- energi
- Teknik
- säkerställa
- Utrustning
- fel
- uppskatta
- Eter (ETH)
- utvärdera
- utvärderade
- händelser
- exempel
- Utom
- exklusive
- erfarenhet
- experimentera
- experiment
- uttryckt
- falsk
- Fig.
- Film
- filtrera
- slutlig
- Slutligen
- Förnamn
- fem
- flöda
- följt
- efter
- För
- format
- Framåt
- hittade
- fyra
- Fjärde
- frysning
- från
- frystes
- FSC
- ytterligare
- grindar
- ge
- Generatorn
- glas
- god
- styrande
- Gram
- Tillväxt
- friska
- här.
- Hem
- Hemmakontor
- HTTPS
- if
- bild
- bilder
- Imaging
- blir omedelbart
- med Esport
- förbättra
- in
- innefattar
- ökande
- inkuberades
- oberoende
- index
- index
- informeras
- omedelbar
- instruktioner
- Instrumentet
- instrument
- integrerade
- Gränssnitt
- inre
- in
- IT
- iteration
- iterationer
- Ha kvar
- känd
- Kx
- leda
- sannolikt
- LINK
- lungor
- upprätthålla
- tillverkad
- Produktion
- Materialet
- Maj..
- betyder
- mätt
- mätning
- Medium
- metod
- metoder
- möss
- mikron
- Mikroskop
- min
- minimerande
- minsta
- blandare
- blandning
- ML
- Mobil
- Mode
- övervakas
- mer
- Morgan
- mest
- MS
- multipel
- multiplicerande
- nanoteknologi
- Natur
- Nästa
- Nej
- normala
- antal
- få
- erhållna
- of
- Office
- on
- ONE
- endast
- motsatt
- optimala
- or
- vanlig
- Övriga
- annat
- ut
- över
- natten
- Syrgas
- Papper
- parametrar
- partikel
- Godkänd
- PBS
- för
- procentuell
- utfört
- husdjur
- fantom-
- fas
- Fotoner
- Bild
- pixel
- placeras
- plato
- Platon Data Intelligence
- PlatonData
- populationer
- del
- placera
- positionering
- positron
- praktiken
- beredd
- Närvaron
- föregående
- tidigare
- Prime
- Innan
- sond
- förfaranden
- process
- producera
- Produkt
- ordentligt
- protokoll
- ge
- ger
- tillhandahålla
- köpt
- kvalitet
- kvantifiering
- kvantitativ
- mängd
- R
- Strålning
- radio
- område
- Betygsätta
- Reaktionen
- reaktioner
- realtid
- mottagna
- senaste
- registreras
- återvinning
- Minskad
- reduktion
- referens
- raffinerade
- region
- föreskrifter
- hänför
- förblir
- Återstående
- ta bort
- avlägsnas
- replikerar
- Krav
- Upplösning
- REST
- resulterande
- översyn
- Granskad
- Rum
- Körning
- s
- Samma
- scanna
- scanning
- skannar
- SCI
- vetenskaplig
- screen
- Andra
- sekunder
- sektioner
- SEM
- Känslighet
- in
- inställning
- inställning
- visar
- Sigma
- Signal
- signifikant
- Kisel
- enda
- Storlek
- storlekar
- Skiva
- Skjut
- Small
- snap
- Mjukvara
- lösning
- Lösningar
- Källa
- specifik
- Spot
- fläckar
- stadier
- standard
- standarder
- starta
- Starta
- anges
- statistiskt
- Steg
- Steg
- förvaring
- Strategi
- ström
- studerade
- studier
- Studerar
- tillräcklig
- leverera
- tillfrågade
- syntes
- tar
- Tekniken
- Tekniken
- testa
- än
- den där
- Smakämnen
- sedan
- teoretiska
- termisk
- Dessa
- Tredje
- detta
- tre
- tröskelvärde
- Genom
- hela
- tid
- gånger
- tidsstämpel
- Tips
- vävnad
- till
- verktyg
- Verktygslåda
- Totalt
- spår
- Spårning
- Transformation
- instängd
- två
- Uk
- Osäkerhet
- under
- Oväntat
- enheter
- tills
- Begagnade
- med hjälp av
- Vakuum
- värde
- Värden
- Hastighet
- version
- Kontra
- lever
- Spänning
- volym
- volymer
- voxel
- W
- var
- tvättning
- Vatten
- były
- när
- om
- som
- medan
- Hela
- kommer
- fönster
- med
- inom
- Avkastning
- gav
- vilket gav
- zephyrnet
- Postnummer