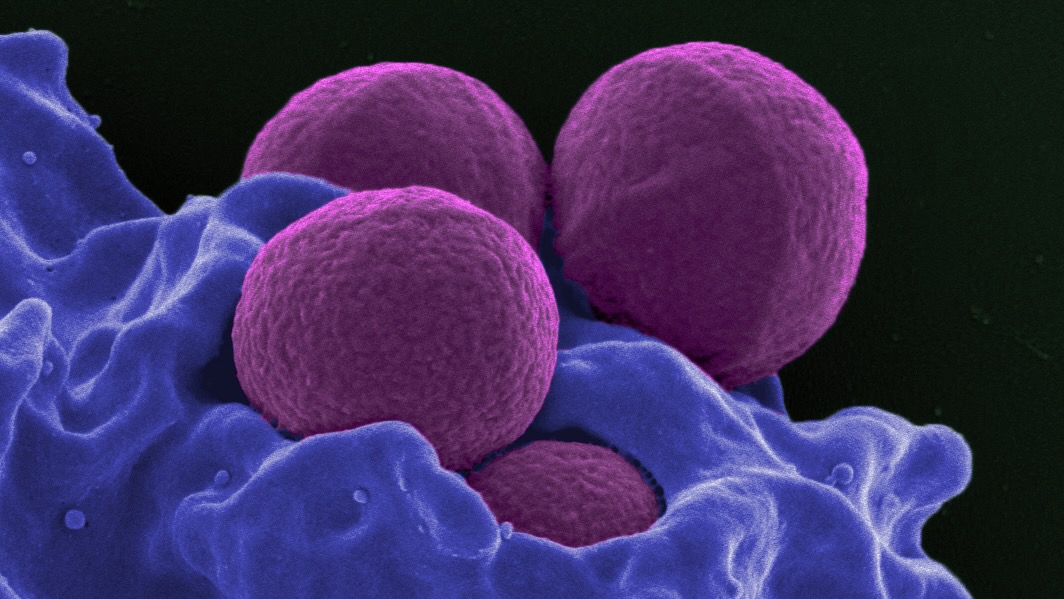
Antibiotika har räddat otaliga liv och är ett avgörande verktyg inom modern medicin. Men vi tappar mark i vår kamp mot bakterier. I mitten av förra seklet, vetenskapsmän upptäckte helt nya klasser av antibiotika. Sedan dess har upptäcktstakten sjunkit till en droppe, och förekomsten av antibiotikaresistenta bakterier har ökat.
Det finns sannolikt antibiotika som ännu inte har upptäckts, men det kemiska universum är för stort för någon att söka efter. Under de senaste åren har forskare vänt sig till AI. Maskininlärningsalgoritmer kan skära ner ett enormt antal potentiella kemiska konfigurationer till en handfull lovande kandidater för testning.
Hittills har forskare använt AI för att hitta enskilda föreningar med antibiotiska egenskaper. Men i en ny studie, publicerade igår i NaturMIT-forskare säger att de har byggt och testat ett system som kan identifiera helt nya klasser av antibiotika och förutsäga vilka som sannolikt är säkra för människor.
AI sållade över 12 miljoner föreningar och hittade en oupptäckt klass av antibiotika som visade sig effektiva i möss mot meticillinresistenta Staphylococcus aureus (MRSA), en dödlig stam av läkemedelsresistent insekt.
Även om dessa AI-upptäckta antibiotika fortfarande måste visa sig säkra och effektiva hos människor genom att klara standardhandsken för kliniska tester, tror teamet att deras arbete kan påskynda upptäckten på fronten och, förhoppningsvis, öka vår totala träfffrekvens.
Utforska drogrymden
Forskare använder allt oftare AI-sidekicks för att påskynda upptäcktsprocessen. Mest känd är kanske DeepMinds AlphaFold, ett maskininlärningsprogram som kan modellera formerna på proteiner, vår kropps grundläggande byggstenar. Tanken är att AlphaFold och dess ättlingar kan påskynda drogforskningens mödosamma process. Så stark är deras övertygelse att DeepMind skapade ett dotterbolag 2021, Isomorphic Labs, dedikerad till att göra just det.
Andra AI-metoder har också visat sig lovande. Särskilt en MIT-grupp har fokuserat på att utveckla helt nya antibiotika för att bekämpa superbugs. Deras första studie, publicerad 2020, fastställde att tillvägagångssättet kunde fungera när de hittade halicin, ett tidigare oupptäckt antibiotikum som kunde lätt ta ut läkemedelsresistenta E. coli.
I en uppföljning tidigare i år tog teamet sikte på Acinetobacter baumannii, "offentlig fiende nr 1 för multiresistenta bakterieinfektioner", enligt McMaster Universitys Jonathan Stokes, en senior författare av studien.
"Acinetobacter kan överleva på sjukhusets dörrhandtag och utrustning under långa perioder, och det kan ta upp antibiotikaresistensgener från sin miljö. Det är verkligen vanligt nu att hitta A. baumannii-isolat som är resistenta mot nästan alla antibiotika." sa Stokes då.
Efter att ha kammat igenom 6,680 240 föreningar på bara två timmar lyfte AI fram några hundra lovande kandidater. Teamet testade XNUMX av dessa som skilde sig strukturellt från befintliga antibiotika. De visade upp nio lovande kandidater, inklusive en, abaucin, som var ganska effektiv mot A. baumannii.
Båda studierna visade att tillvägagångssättet kunde fungera, men gav bara enstaka kandidater utan information om varför de var effektiva. Maskininlärningsalgoritmer är, notoriskt, svarta lådor - vad som händer "mellan öronen" så att säga är ofta ett fullständigt mysterium.
I den senaste studien siktade gruppen på en annan känd motståndare, MRSA, men den här gången kedjade de ihop flera algoritmer för att förbättra resultaten och bättre belysa AI:s resonemang.
Vänd på strömbrytaren
Teamets senaste antibiotiska blodhund tränade på cirka 39,000 XNUMX föreningar, inklusive deras kemiska struktur och förmåga att döda MRSA. De tränade också separata modeller för att förutsäga toxiciteten hos en given förening för mänskliga celler.
"Du kan representera i princip vilken molekyl som helst som en kemisk struktur, och du berättar också för modellen om den kemiska strukturen är antibakteriell eller inte," Felix Wong, postdoc vid IMES och Broad Institute of MIT och Harvard, berättade MIT News. ”Modellen är tränad på många sådana här exempel. Om du sedan ger den någon ny molekyl, ett nytt arrangemang av atomer och bindningar, kan det berätta för dig en sannolikhet att den föreningen förutspås vara antibakteriell."
När det var klart matade teamet in över 12 miljoner föreningar i systemet. AI minskade denna enorma lista till cirka 3,600 283 föreningar organiserade i fem klasser – baserat på deras strukturer – den förutspådde skulle ha viss aktivitet mot MRSA och vara minimalt toxiska för mänskliga celler. Teamet slog sig ner på en slutlig lista med XNUMX kandidater för testning.
Av dessa hittade de två från samma klass - det vill säga de hade liknande strukturella komponenter som tros bidra till antimikrobiell aktivitet - som var ganska effektiva. Hos möss bekämpade antibiotikan både en hudinfektion och en systemisk infektion genom att ta ut 90 procent av de närvarande MRSA-bakterierna.
Noterbart, medan deras tidigare arbete tacklade gramnegativa bakterier genom att störa cellmembran, är MRSA grampositiv och har tjockare väggar.
"Vi har ganska starka bevis för att denna nya strukturella klass är aktiv mot Gram-positiva patogener genom att selektivt skingra protonens drivkraft i bakterier," sa Wong. "Molekylerna angriper bakteriecellsmembran selektivt, på ett sätt som inte ådrar sig betydande skador i mänskliga cellmembran."
Genom att göra sin AI förklarlig hoppas teamet kunna nollställa strukturer som kan informera framtida sökningar eller bidra till utformningen av effektivare antibiotika i labbet.
Slutexamen
Det viktigaste att notera här är att även om det verkar som att de nya antibiotika var effektiva på möss i mycket liten skala, så är det en lång väg kvar innan du kommer att ordineras en.
Nya läkemedel genomgår rigorösa tester och kliniska prövningar, och många, till och med lovande kandidater, tar sig inte vidare till andra sidan. Området för AI-assisterad läkemedelsupptäckt, mer generellt, är fortfarande i ett tidigt skede i detta avseende. Den första AI-designade läkemedel är nu i kliniska prövningar, men ingen har ännu godkänts.
Ändå är förhoppningen att snabbare fylla pipelinen med bättre kandidater.
Det kan ta tre till sex år att upptäcka ett nytt antibiotikum som lämpar sig för kliniska prövningar, enligt University of Pennsylvania César de la Fuente, vars labb gör liknande arbete. Sedan har du själva prövningarna. Med antibiotikaresistens på uppgång kanske vi inte har den typen av tid, för att inte tala om det faktum att antibiotika inte har avkastningen på investeringen som andra läkemedel har. All hjälp är välkommen.
"Nu, med maskiner, har vi kunnat accelerera [tidslinjen]," de la Fuente berättade Scientific American. ”I mitt och mina kollegors eget arbete kan vi till exempel på några timmar upptäcka tusentals eller hundratusentals prekliniska kandidater istället för att behöva vänta tre till sex år. Jag tror att AI i allmänhet har möjliggjort det."
Det är tidigt ännu, men om AI-upptäckta antibiotika visar sig vara värda under de kommande åren, kanske vi kan behålla övertaget i vår långvariga kamp mot bakterier.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- Källa: https://singularityhub.com/2023/12/21/ai-discovers-a-new-class-of-antibiotics-after-scouring-12-million-compounds/
- : har
- :är
- :inte
- $UPP
- 000
- 1
- 12
- 2020
- 2021
- 39
- 600
- 90
- a
- förmåga
- Able
- accelerera
- Enligt
- aktiv
- aktivitet
- Efter
- mot
- AI
- Syftet
- algoritmer
- också
- Även
- an
- och
- Annan
- Antibiotika
- vilken som helst
- någon
- visas
- tillvägagångssätt
- tillvägagångssätt
- godkänd
- ÄR
- runt
- arrangemang
- AS
- At
- Anfall
- Författaren
- Bakterier
- grundläggande
- I grund och botten
- Slaget
- BE
- varit
- innan
- tros
- tror
- Bättre
- Stor
- Svart
- Block
- blod
- Obligationer
- båda
- bred
- Bug
- Byggnad
- byggt
- men
- by
- KAN
- kandidater
- cellen
- Celler
- Århundrade
- kedjad
- kemisk
- klass
- klasser
- Klinisk
- kliniska tester
- kommande
- Gemensam
- fullborda
- komponenter
- Luktämne
- bidra
- övertygelse
- kunde
- kredit
- avgörande
- skada
- Datum
- dedicerad
- Deepmind
- Designa
- utveckla
- olika
- Upptäck
- upptäckt
- upptäcker
- Upptäckten
- sjukdomar
- do
- gör
- gör
- inte
- ner
- drog
- läkemedelsforskning
- Läkemedel
- e
- Tidigare
- Tidig
- Effektiv
- aktiverad
- änden
- enorm
- helt
- Miljö
- Utrustning
- etablerade
- Även
- Varje
- bevis
- exempel
- exempel
- befintliga
- Faktum
- kända
- Fed
- få
- fält
- bekämpa
- slutlig
- hitta
- Förnamn
- fem
- fokuserade
- För
- kraft
- hittade
- från
- främre
- främre ände
- framtida
- Gatlopp
- Allmänt
- allmänhet
- Ge
- ges
- Go
- Marken
- Grupp
- vuxen
- hade
- sidan
- näve
- händer
- Harvard
- Har
- har
- hjälpa
- här.
- Markerad
- Träffa
- hoppas
- Förhoppningsvis
- hoppas
- Sjukhuset
- ÖPPETTIDER
- HTTPS
- humant
- Människa
- hundra
- Hundratals
- i
- Tanken
- identifiera
- if
- belysa
- förbättra
- in
- Inklusive
- Öka
- alltmer
- infektion
- Infektioner
- Infektionssjukdomar
- underrätta
- informationen
- istället
- Institute
- in
- investering
- isolat
- IT
- DESS
- jonathan
- bara
- Nyckel
- Döda
- Snäll
- känd
- lab
- Efternamn
- senaste
- inlärning
- tycka om
- sannolikt
- Lista
- Bor
- Lång
- långvarig
- förlora
- Maskinen
- maskininlärning
- Maskiner
- bibehålla
- göra
- Framställning
- många
- Materia
- Maj..
- läkemedel
- nämna
- möss
- Mitten
- kanske
- miljon
- MIT
- modell
- modeller
- Modern Konst
- molekyl
- mer
- mest
- MRSA
- my
- Mystery
- nationell
- nästan
- Behöver
- Nya
- NIH
- nio
- Nej
- Ingen
- Notera
- nu
- nummer
- of
- Ofta
- on
- ONE
- endast
- or
- Organiserad
- Övriga
- vår
- ut
- över
- övergripande
- egen
- Fred
- särskilt
- Förbi
- Personer
- procent
- kanske
- perioder
- rörledning
- plato
- Platon Data Intelligence
- PlatonData
- potentiell
- preklinisk
- förutse
- förutsagda
- presentera
- pretty
- utbredning
- föregående
- tidigare
- Sannolikheten
- process
- Program
- löfte
- lovande
- egenskaper
- Proteiner
- Bevisa
- visat
- publicerade
- snabbt
- ganska
- Betygsätta
- lätt
- verkligen
- senaste
- representerar
- forskning
- forskare
- Resistens
- resistent
- Resultat
- avkastning
- rigorös
- Rise
- säker
- Nämnda
- Samma
- sparade
- säga
- Skala
- vetenskapsmän
- Sök
- sök
- senior
- separat
- Fast
- flera
- former
- visade
- visas
- sida
- liknande
- eftersom
- enda
- SEX
- Hud
- Small
- So
- några
- tala
- fart
- spunnen
- stadier
- standard
- Fortfarande
- lager
- stark
- strukturell
- strukturellt
- struktur
- strukturer
- studier
- Läsa på
- dotterföretag
- väsentlig
- lämplig
- överleva
- system
- systemisk
- Ta
- tar
- grupp
- tala
- testade
- Testning
- den där
- Smakämnen
- deras
- sig själva
- sedan
- Dessa
- de
- sak
- tror
- detta
- i år
- tusentals
- tre
- Genom
- tid
- tidslinje
- till
- tillsammans
- berättade
- alltför
- tog
- verktyg
- tränad
- försök
- vände
- två
- genomgå
- oupptäckt
- Universum
- universitet
- Begagnade
- med hjälp av
- mycket
- vänta
- var
- Sätt..
- we
- välkommen
- były
- när
- som
- medan
- vit
- Hela
- vars
- med
- wong
- Arbete
- värdiga
- skulle
- år
- år
- i går
- ännu
- gav
- dig
- zephyrnet
- noll-







