NMPA publicerade det färdiga dokumentet "Guideline on Medical Device Real-world Study Design and Statistical Analysis" den 15 januari 2024. Utkastet släpptes den 28 september 2023.
Riktlinjens betydelse
Riktlinjen kommer att underlätta för utländska tillverkare att ytterligare utforska Hainan Real-world Data-pilotprogrammet.
Hainan Boao Pilot Zone tillåter användning av icke-godkänd medicinsk utrustning, IVD, läkemedel, med klinisk brådskande status i Kina. Medan de kommersialiserar och säljer sina produkter kan tillverkare samla in RWD genom RWS i Hainan som lokalt kliniskt bevis i Kina för att stödja deras nationella NMPA-registreringsgodkännande. Det särskilda programmet kan förkorta deras marknadstillträde i Kina till fyra månader.
Hainan-regeringen släppte "Föreskrifter om administrering av brådskande användning av importerade droger och medicinska apparater i Boao Lecheng International Medical Tourism Pilot Zone i Hainan Free Trade Port” den 28 mars 2023. Dokumentet säger att det INTE kräver lokal typprovning eller betydande bevisbörda som det nationella godkännandet.
Höjdpunkter i riktlinjen
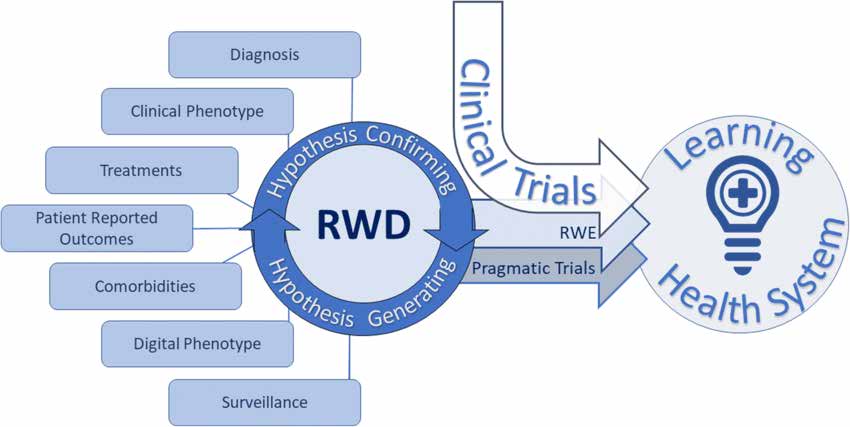
Dokumentet om studiedesign och statistisk analys beskriver olika typer av verklig forskning enligt följande:
Pragmatic Randomized Controlled Trials (pRCT) är utformade för att bedöma behandlingsresultat i verkliga vårdmiljöer. De använder randomiserings- och kontrollgrupper för att utvärdera interventionens effektivitet. PRCT:erna tillhandahåller högkvalitativa bevis från verkligheten och är lämpliga för olika patientpopulationer och kliniska scenarier.
Observational Real-World Research inkluderar olika studiedesigner:
- Beskrivande studiedesigner beskriva patientegenskaper eller hälsotillstånd utan att dra slutsatsen kausalitet.
- Kohortdesigner spåra resultat i olika patientgrupper baserat på apparatanvändning, med prospektiva och retrospektiva alternativ.
- Case-Control och härledda mönster jämför patienter med och utan apparatanvändning och inkluderar kapslade fall-kontroll- och fall-kohortstudier.
- Real-World Data som externa kontroller involvera att använda verklig data som en kontrollgrupp, även om detaljerade riktlinjer saknas.
Dokumentet beskriver överväganden för att utforma verkliga forskningsprotokoll:
- Bakgrund och mål: Definiera forskningsbakgrund, mål och säkerhets- och effektivitetsfrågor baserat på befintliga data.
- Genomförbarhetsbedömning: Utvärdera genomförbarheten av att utföra verklig forskning, med hänsyn till datatillgänglighet, kvalitet och förvirrande variabler.
- Välj Lämplig forskningsdesign: Välj design baserat på mål, vare sig det är experimentellt eller observationsmässigt.
- Studera flödesschema: Skapa ett flödesschema som beskriver studieprocessen, inklusive patientval, interventioner och undersökningar.
- Definiera studiepopulation: Definiera tydligt inklusions- och exkluderingskriterier för studiepopulationen.
- Enhetsexponering: Bedöm hur patienter exponeras för enheten, med tanke på potentiella fördomar.
- Kontrollgrupp: Bestäm lämpliga kontrollgrupper för observationsstudier för att balansera störande variabler.
- Utfallsmått: Definiera utfallsmått, inklusive deras syfte, definition och mätmetoder.
- Datainsamling: Utveckla datainsamlingsformulär och ordböcker, specificera datakällor, kvalitetsinformation och länkningsmetoder.
- Justering för konfunderande variabels: Identifiera störande variabler och inkludera/exkludera dem med skäl.
- Uppföljningstid: Definiera patientuppföljnings- eller observationstider för att svara på forskningsfrågor adekvat.
- Provstorlek och effektberäkning: Beräkna urvalsstorlek och statistisk styrka, med hänsyn till olika faktorer.
Det betonar också vikten av kvalitetskontroll:
- Datakvalitet: Utvärdera datakvalitet i termer av representativitet, fullständighet, noggrannhet med mera.
- Bias Risk: Beskriv åtgärder för att kontrollera bias risker i olika stadier, inklusive urval, information och confounding bias.
- Bedömning av partiskhet: Känn igen olika typer av bias och bedöm deras riktning och storlek.
- Etisk granskning: Se till att etiska granskningar och informerat samtycke följer bestämmelserna.
Jämförelse av två versioner
Jämfört med utkastet nämner det slutliga dokumentet "Att fastställa störande variabler som behöver modifieras" i avsnittet Statistisk analys.
I icke-randomiserade verkliga forskningsdesigner är identifiering av störande variabler avgörande för att kontrollera bias. Tre kriterier används för att identifiera dem: en variabel har ett kausalt samband med utfallet, är associerat med grupperingsvariabeln (exponering) och är inte en mellanvariabel i kausalvägen. Ett rekommenderat tillvägagångssätt innebär en rationell variabel urvalsprocess baserad på professionell kunskap och klinisk erfarenhet, med samarbete med kliniska och statistiska experter. För osäkra variabler föreslås känslighetsanalys som ger skäl och stödjande data för inkludering/exkludering. Ett konservativt tillvägagångssätt för val av variabler rekommenderas, undvik orelaterade variabler och övervägande av frågor som multikollinearitet och interaktionseffekter, visualiserade genom Directed Acyclic Graphs (DAGs).
För en engelsk kopia av riktlinjerna, vänligen maila info@ChinaMedDvice.com. Vi tar ut nominella avgifter för översättningen.
Visa nyheter på Hainan Real World Data-programmet.
Visa kommunikationsriktlinje arbeta med tillsynsmyndigheter.
Visa vårt inspelat webbseminarium om Hainan politik.
- SEO-drivet innehåll och PR-distribution. Bli förstärkt idag.
- PlatoData.Network Vertical Generative Ai. Styrka dig själv. Tillgång här.
- PlatoAiStream. Web3 Intelligence. Kunskap förstärkt. Tillgång här.
- Platoesg. Kol, CleanTech, Energi, Miljö, Sol, Avfallshantering. Tillgång här.
- PlatoHealth. Biotech och kliniska prövningar Intelligence. Tillgång här.
- Källa: https://chinameddevice.com/real-world-study-nmpa/
- : har
- :är
- :inte
- 15%
- 2023
- 2024
- 28
- a
- tillgång
- noggrannhet
- acyklisk
- adekvat
- administrering
- rådde
- tillåter
- också
- an
- analys
- och
- svara
- tillvägagångssätt
- lämpligt
- godkännande
- ÄR
- AS
- bedöma
- associerad
- At
- Myndigheter
- tillgänglighet
- undvika
- bakgrund
- Balansera
- baserat
- BE
- förspänning
- förspänner
- belastning
- beräkna
- KAN
- egenskaper
- laddning
- Kina
- Välja
- klart
- Klinisk
- samverkan
- samla
- samling
- COM
- följa
- villkor
- ledande
- samtycke
- konservativ
- överväganden
- med tanke på
- kontroll
- kontrolleras
- styrning
- kontroller
- skapa
- kriterier
- avgörande
- datum
- Datakvalitet
- definiera
- definition
- Härledd
- beskriva
- beskriver
- Designa
- utformade
- design
- mönster
- detaljerad
- detailing
- Bestämma
- utveckla
- anordning
- enheter
- olika
- riktad
- riktning
- flera
- dokumentera
- gör
- utkast
- Läkemedel
- effektivitet
- effekter
- betonar
- Engelska
- säkerställa
- etisk
- utvärdera
- bevis
- befintliga
- erfarenhet
- experimentell
- experter
- utforska
- utsatta
- Exponering
- extern
- främja
- faktorer
- genomförbarhet
- avgifter
- slutlig
- slutfört
- efter
- För
- former
- Fri
- ytterligare
- Regeringen
- grafer
- Grupp
- Gruppens
- riktlinjer
- Hälsa
- hälso-och sjukvård
- hög kvalitet
- Hur ser din drömresa ut
- HTTPS
- identifiera
- identifiera
- vikt
- in
- innefattar
- innefattar
- Inklusive
- integration
- informationen
- informeras
- interaktion
- Mellanliggande
- Internationell
- ingripande
- interventioner
- innebär
- problem
- IT
- Januari
- jpg
- kunskap
- saknas
- ledare
- tycka om
- lokal
- Tillverkare
- Mars
- marknad
- mätning
- åtgärder
- medicinsk
- medicinsk utrustning
- medicintekniska produkter
- nämner
- metoder
- kanske
- månader
- mer
- nationell
- Behöver
- mål
- observationen
- observational
- of
- on
- Tillbehör
- or
- vår
- Resultat
- utfall
- konturer
- utomlands
- bana
- Patienten
- patienter
- Föraren
- plato
- Platon Data Intelligence
- PlatonData
- snälla du
- Strategier
- befolkning
- populationer
- potentiell
- kraft
- process
- Produkter
- professionell
- Program
- bevis
- blivande
- protokoll
- ge
- tillhandahålla
- publicerade
- Syftet
- kvalitet
- frågor
- randomized
- Rationell
- verklig
- verkliga världen
- skäl
- rekommenderas
- Registrering
- föreskrifter
- regulatorer
- relation
- frigörs
- kräver
- forskning
- Omdömen
- risker
- Säkerhet
- säger
- scenarier
- §
- Val
- Försäljningen
- Känslighet
- September
- inställningar
- signifikant
- Storlek
- Källor
- speciell
- stadier
- statistisk
- status
- studier
- Läsa på
- lämplig
- stödja
- Stödjande
- villkor
- Testning
- den där
- Smakämnen
- deras
- Dem
- de
- fastän?
- tre
- Genom
- gånger
- till
- Turism
- spår
- handla
- Översättning
- behandling
- försök
- två
- Typ
- typer
- Osäker
- urgency
- brådskande
- användning
- Begagnade
- med hjälp av
- variabel
- olika
- version
- var
- we
- om
- medan
- kommer
- med
- utan
- arbetssätt
- världen
- zephyrnet