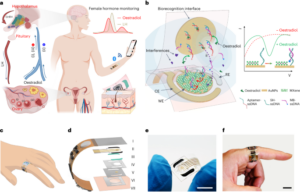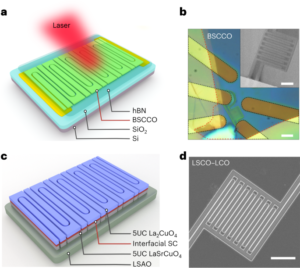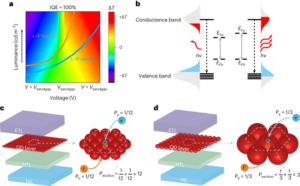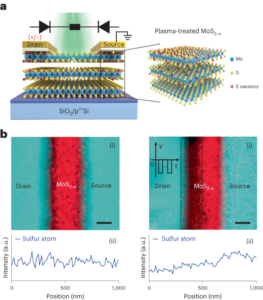
Sinteza nanobotov
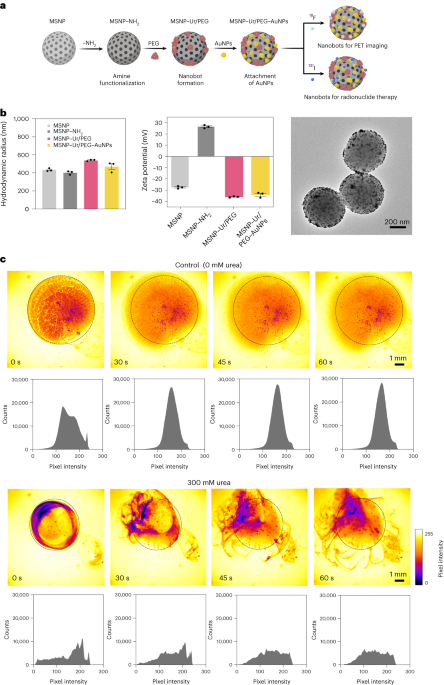
Nanoboti so bili pripravljeni, kot je opisano prej33. Na kratko, MSNP so bili sintetizirani z uporabo modificirane Stöberjeve metode41, reagiranje trietanolamina (35 g), ultračiste vode (20 ml) in heksadeciltrimetilamonijevega bromida (CTAB; 570 mg) pri 95 °C 30 min med mešanjem. Nato smo po kapljicah dodali tetraetil ortosilikat (1.5 ml); zmes smo pustili reagirati 2 h pri 95 °C in nastale MSNP smo zbrali s centrifugiranjem in sprali v etanolu (trikrat, 2,500g, 5 min). Da bi odstranili predlogo CTAB, smo MSNP postavili pod refluks v kislem metanolu (1.8, 30 ml HCl, 24 ml metanola) za 2,500 ur. Nato smo MSNP zbrali s centrifugiranjem in trikrat sprali v etanolu (XNUMXg, 5 min) pred vključitvijo modifikacije amina z dodajanjem APTES (6 µl na mg MSNP) k MSNP (1 mg ml-1) v 70-odstotni raztopini etanola pri 70 °C, ob močnem mešanju 1 h. MSNPs-NH2 smo zbrali in trikrat sprali v etanolu in trikrat v vodi s centrifugiranjem (trikrat, 1,150g, 5 min). MSNPs-NH2 smo resuspendirali v PBS pri koncentraciji 1 mg ml-1 in skupnim volumnom 900 µl ter aktiviran z glutaraldehidom (100 µl) 2.5 h pri sobni temperaturi. Aktivirani MSNPs-NH2 smo zbrali in trikrat sprali v PBS s centrifugiranjem (1,150g, 5 min), resuspendirano v raztopini ureaze (3 mg ml-1) in heterobifunkcionalni PEG (1 μg PEG na mg 5 kDa HS-MSNPs-NH2) v PBS in reagiral 24 ur pri sobni temperaturi. Nastale nanobote smo nato zbrali in trikrat sprali v PBS s centrifugiranjem (1,150g, 5 min), preden jih resuspendiramo v disperziji AuNP, pripravljeni, kot je opisano prej51pustite, da reagirajo 10 min, in jih temeljito sperite s centrifugiranjem (trikrat, 1,150g, 5 min).
Hidrodinamična porazdelitev velikosti in površinski naboj MSNP, MSNP-NH2, so bili nanoboti in nanoboti, okrašeni z AuNP, določeni z uporabo sistema dinamičnega sipanja svetlobe Wyatt Mobius oziroma Malvern Zetasizer. V vseh primerih je bila koncentracija 20 µg ml-1 in čas pridobivanja 5 s, z uporabo treh zagonov na poskus. Izvedene so bile tri meritve na vrsto delcev.
Sinteza FITC MSNP
Pripravili smo zmes FITC (2 mg), etanola (5 ml) in APTES (400 µl) in mešali 30 min. Nato smo sledili predhodno opisanemu protokolu za sintezo MSNP, le da smo po kapljicah dodali tetraetil ortosilikat (1.25 ml) v kombinaciji z mešanico FITC–APTES (250 µl). Koraki funkcionalizacije za pridobitev nanobotov, označenih s FITC, so bili kot zgoraj.
Sinteza AuNP
AuNP so bili sintetizirani z uporabo metode, o kateri so poročali33. Na kratko, vsi materiali so bili očiščeni s sveže pripravljeno aqua regia, temeljito sprani z vodo in posušeni na zraku. Nato je 1 mM AuCl4 raztopino segrevamo do vrelišča med mešanjem v bučki z okroglim dnom, integrirani v refluksni sistem. Nato smo dodali 10 ml raztopine natrijevega citrata (30.8 mM) in raztopino kuhali 20 minut, kar je povzročilo rdečo barvo. Raztopino smo nato pustili ohladiti na sobno temperaturo med mešanjem 1 h. Nastali AuNP so bili shranjeni v temi in karakterizacija je bila izvedena s transmisijsko elektronsko mikroskopijo.
Encimska aktivnost
Encimska aktivnost nanobotov, 18F-nanoboti in 131I-nanobote smo izmerili s fenol rdečim. Da bi to naredili, 2 µl nanobotov (1 mg ml-1) smo dodali na ploščo s 96 vdolbinicami in zmešali z 200 µl različnih raztopin sečnine (0, 50, 100, 200 mM) v 1.1 mM fenol rdeče. Absorbanca pri 560 nm je bila izmerjena skozi čas pri 37 °C.
Dinamika gibanja nanobotov skozi optično mikroskopijo
Optični videoposnetki nanobotov so bili pridobljeni z uporabo mikroskopa Leica Thunder, skupaj s Hamamatsu visokohitrostno CCD kamero in objektivom × 1.25. Za to so bili nanoboti centrifugirani in resuspendirani v 50 µl PBS (končna koncentracija 20 mg ml-1). Nato smo petrijevko napolnili s 3 ml PBS ali 300 mM raztopine sečnine (v PBS) in opazovali pod mikroskopom. 5 µl kapljica z nanoboti (20 mg ml-1) je bil nato dodan v petrijevko, napolnjeno s tekočino, in video posnetki so bili posneti pri 25 sličicah na sekundo. Porazdelitev intenzivnosti slikovnih pik videa v ROI je bila analizirana v 15-sekundnih intervalih s programsko opremo ImageJ.
Radioaktivno označevanje nanobotov z [18F]F-PyTFP
Sinteza [18F]F-PyTFP
[18F]F-PyTFP je bil sintetiziran v modulu Neptis xSeed (Optimizirane radiokemične aplikacije) po prej opisani metodi33.
Sinteza 18Nanoboti z oznako F
Nanoboti so bili označeni z [18F]F-PyTFP, na podlagi predhodno uveljavljenega postopka z manjšimi modifikacijami33. Na kratko, 200 µl raztopine nanobota (1 mg ml-1) centrifugirali (10 min, 13,853g), resuspendiramo v 10 µl PBS (1 mM, pH 8) in inkubiramo s 4 µl [18F]F-PyTFP v acetonitrilu (približno 37 MBq) 35 min pri sobni temperaturi. Po inkubaciji smo reakcijsko mešanico razredčili z vodo (200 µl) in očistili s centrifugiranjem (5 min, 13,853g). Nastalo peleto smo nato trikrat splaknili z vodo, preden smo jo izmerili v kalibratorju odmerka (CPCRC-25R, Capintec). Radiokemični izkoristek je bil izračunan kot razmerje med količino radioaktivnosti, ki je prisotna v nanobotih po pranju, in začetno količino radioaktivnosti. Radiokemijska čistost po čiščenju je bila ≥99 %, kot je bilo ugotovljeno z radijsko tankoplastno kromatografijo (radio-TLC) z uporabo iTLC-SG kromatografskega papirja (Agilent Technologies) ter diklorometana in metanola (2:1) kot stacionarne oziroma mobilne faze. TLC plošče smo analizirali s TLC čitalnikom (MiniGITA, Raytest).
Stabilnost od 18F-nanoboti
Stabilnost oz 18Nanoboti, označeni s F, so bili določeni z uporabo naslednjih medijev: (1) 300 mM sečnine, (2) vode in (3) urina živali, ki nosijo tumor. 18F-označene nanobote (10 µl) smo inkubirali z ustrezno raztopino (100 µl) 1 h pri sobni temperaturi. Nato smo nanobote in supernatant ločili s centrifugiranjem in zbrali ter izmerili radioaktivnost v kalibratorju odmerka (CPCRC-25R).
Radioaktivno označevanje nanobotov z 131I
Radiojodiranje ureaznih nanobotov je bilo izvedeno z inkubacijo nanobotov z injekcijskim [131I]NaI raztopina (925 MBq ml-1; GE HealthCare). Na kratko, 400 µl raztopine nanobota ureaze (1 mg ml-1) centrifugirali (13,853g, 5 min), resuspendiramo v 100 µl PBS (10 mM, pH 7.4) in inkubiramo s 25 µl ali 185 µl injekcijskega [131I]NaI (približno 42.55 oziroma 277.5 MBq) za 30 min, odvisno od želene končne aktivnosti. Po inkubaciji smo reakcijsko mešanico očistili s centrifugiranjem (13,853g, 5 min). Nastalo oborino trikrat speremo z vodo (100 µl). Radioaktivnost v supernatantu in oborini smo določili z uporabo kalibratorja odmerka (CPCRC-25R) in obe frakciji analizirali z radio-TLC, kot za 18F-nanoboti.
Razvoj živalskega modela
Miši so vzdrževali in z njimi ravnali v skladu z Direktivo Evropskega sveta 2010/63/UE in internimi smernicami. Vse eksperimentalne postopke so odobrili odbor za etiko CIC biomaGUNE in lokalne oblasti (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Analiza slike (tako PET kot MRI) je bila zaslepljena glede na skupinsko porazdelitev živali.
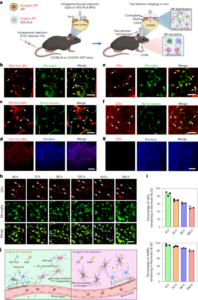
Ortotopni mišji model raka mehurja je bil ustvarjen z intravezikalnim dajanjem celic MB49 (celična linija mišjega karcinoma mehurja) mišjim samicam C57BL/6JRj (starim 8 tednov, Janvier). Za poskuse, namenjene določanju kopičenja tumorja (štiri skupine; podrobnosti spodaj), je bilo inokuliranih šest živali na skupino, kot je bilo ugotovljeno z analizo natančnosti, z naslednjimi predpostavkami: zahtevana natančnost, 20 %; pričakovana s.d., ±20 %; zaupanje, 95%; izguba živali, 20 %. Za poskuse terapevtske učinkovitosti (šest skupin; podrobnosti spodaj) je bilo vključenih deset živali na skupino, kot je bilo izračunano z enostranskim študentom t-test, razlika med dvema neodvisnima sredinama, z naslednjimi predpostavkami: ničelna hipoteza, zdravljenje ne vpliva na rast tumorja; α0.05; 1 − β0.95; s.d., ±50 %; pričakovane razlike med skupinami, 50 %; izguba živali, 20 %. Ker je bil poskus iz operativnih razlogov izveden v dveh sklopih, je bila v oba sklopa vključena ena kontrolna skupina (tabela 2), nato pa so bile vse živali združene. Za vzpostavitev tumorja so miši anestezirali z inhalacijo 3% izoflurana v čistem O2 in vzdržuje 1.0–1.5 % izoflurana v 100 % O2. Nato so izpraznili mehur in povzročili kemične lezije na uroteliju z intravezikalnim vkapanjem 50 µl poli-l-lizin (Sigma-Aldrich) skozi kateter velikosti 24 15 min. Nato je bil mehur ponovno izpraznjen in celice MB49 (105 celice) v DMEM z visoko vsebnostjo glukoze (100 µl) smo vkapali 1 h pred odstranitvijo katetra in praznjenjem mehurja z masažo trebuha. Med poskusi so miši spremljali in tehtali za spremljanje zdravja in dobrega počutja. Končna točka pri ljudeh je bila uporabljena, če je izguba teže presegla 20 % ali na podlagi kliničnih simptomov po merilih odgovornega veterinarja.
Sledenje velikosti tumorja
Študije MRI so bile izvedene 7 in 14 dni po indukciji tumorja z uporabo 7 T skenerja Bruker BioSpec USR 70/30 (Bruker BioSpin), opremljenega z gradientnim vložkom BGA-12S 440 mT m-1 in resonator 112/086 QSN (T12053V3) za radiofrekvenco14 prenos in tuljava na površini podganjih možganov (T11205V3) za RF sprejem (oba delujeta pri 300 MHz). Živali so bile anestezirane z izofluranom (4 % za indukcijo in 1.5 % za vzdrževanje v 50 % O2/50 % N2 mešanico) in jo položite na zibelko, združljivo z MR. Telesno temperaturo in stopnjo dihanja smo nenehno spremljali z MR-združljivo napravo za spremljanje (model 1030 SA, Small Animal Instruments), povezano s sistemom grelnika zraka za majhne glodavce za vzdrževanje telesne temperature. Po pridobitvi referenčnih slik je bilo za slikanje tumorjev uporabljeno difuzijsko uteženo slikovno zaporedje, ki temelji na spinskem odmevu, z uporabo naslednjih parametrov: čas odmeva (TE) = 22.3 ms, čas ponavljanja (TR) = 2,500 ms, n = 2 povprečji, ena slika A0 (bazalna slika z b = 0 s mm-2) in ena slika DW, pridobljena z uporabo difuzijskih gradientov v smeri (1, 0, 0) s trajanjem gradienta δ = 4.5 ms in gradientna ločitev Δ = 10.6 ms, kar daje b = 650 s mm-2, 16 × 16 mm2 vidno polje, velikost matrice slike 160 × 160 točk, 20 zaporednih rezin debeline 0.5 mm (brez vrzeli, pridobljeno v prepletenem načinu) in pasovna širina 192.9 Hz na slikovno piko. Za vizualizacijo tumorjev so bile slike naknadno obdelane s programsko opremo ImageJ in razdeljene slike, pridobljene z difuzijskim gradientom (b = 650 s mm-2) s tistimi, pridobljenimi brez (b = 0 s mm-2) in uporabo 3D Gaussovega filtra (σx = σy = σz = 0.7) na rezultat. Tumorji so bili ročno označeni, da se določi njihov volumen.
Biodistribucija in vivo
15. dan po indukciji tumorja smo miši randomizirali v štiri skupine, da smo dobili homogeno povprečno porazdelitev volumna tumorja med skupinami. PET-CT (skenerji MOLECUBES β in X-CUBE) so bili posneti 3 h po intravezikalnem dajanju 100 µl 18F-BSA (skupini 1 in 2) oz 18F-ureaza (skupini 3 in 4) nanoboti v koncentraciji 200 µg ml-1, z uporabo vode (skupini 1 in 3) ali 300 mM sečnine v vodi (skupini 2 in 4) kot nosilca (tabela 1). Za pridobitev slike so bile živali inducirane z anestezijo (5% izofluran v čistem kisiku) in postavljene v ležeč položaj pred masiranjem trebušne regije za evakuacijo mehurja. Takoj zatem še ustrezen 18Nanoboti z oznako F (18F-BSA/18F-ureazo v vodi/sečnini) so vkapali v mehur skozi kateter velikosti 24 in inkubirali 1 h, preden so odstranili kateter, izpraznili mehur in pustili miši, da si opomorejo od anestezije. pri t = 3 h po dajanju so bile živali ponovno anestezirane in pridobljene so bile 10 minutne statične PET slike celega telesa, čemur je sledil CT-pregled. Slike PET so bile rekonstruirane z uporabo algoritma za rekonstrukcijo maksimiziranja pričakovanja 3D urejenih podmnožic z naključnimi popravki, popravki razpršitve in slabljenja. Slike PET-CT iste miške so bile soregistrirane in analizirane z orodjem za obdelavo slik PMOD. Grafi koncentracije radioaktivnosti v odvisnosti od časa so bili pridobljeni z ustvarjanjem zanimivega volumna na zgornjem območju mehurja z uporabo 3D konturnega orodja in merjenjem aktivnosti (korigirano z razpadom) v kilobekerelih na organ. Rezultati so bili popravljeni z uporabo kalibracijskega faktorja in nato normalizirani z volumnom tumorja, pridobljenim z MRI.
Študije ex vivo
Histopatološke analize
Po zaključku vseh slikanj izbrani mehurji (n = 3 na skupino) iz živali s tumorjem in zdravih živali smo odstranili v aseptičnih pogojih in takoj fiksirali v 4% formaldehidu. Nato so mehurje vdelali v parafin, preden so vzeli odseke velikosti 2–3 µm za barvanje s hematoksilinom in eozinom. Reprezentativne slike so bile pridobljene iz vseh pogojev za histopatološki pregled.
Analiza ICP-MS
Meritve so bile izvedene na Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) skupaj s samodejnim vzorčevalnikom ASX-560 (CETAC Tech). Po zaključku vseh slikanj so bile živali usmrtene in izbrani mehurji (n = 2 na skupino; štiri skupine), zbrane in prebavljene v 1 ml HNO3:HCl (zmes 4:1). Disperzijo smo kuhali, dokler se organi popolnoma niso raztopili. Nato smo raztopino ohladili na sobno temperaturo in jo analizirali z uporabo ICP-MS za določitev koncentracije Au v vsakem vzorcu, pri čemer smo rezultate pretvorili v odstotke vbrizganega odmerka na gram tkiva (%ID g-1).
Imunohistokemija in konfokalna mikroskopija
Za imunohistokemijske analize so živali s tumorji prejele nanobote, označene s FITC, v vodi ali 300 mM sečnine (n = 4 na skupino), kot je opisano zgoraj, za študije PET-CT. Poleg tega so živali s tumorji brez nanobotov služile kot kontrolna skupina (n = 2). V vseh primerih so bili mehurji zbrani, zamrznjeni in razrezani na 10 µm odseke, ki so bili takoj fiksirani v 10% formaldehidu za 15 min, sprani z 10 mM PBS in nato inkubirani v 50 mM NH4Cl v PBS 5 min pred ponovnim izpiranjem s PBS. Permeabilizacija je bila izvedena z metanol:aceton (1:1) 5 minut pri sobni temperaturi in 0.1, 5% Tritona v PBS 5 minut. Po izpiranju s PBS smo vzorce nasičili z raztopino 0.5 % BSA–15 % Tween v PBS 1 minut pri sobni temperaturi in inkubirali 1 uro pri sobni temperaturi z mišjim anti-FITC (100:5, Abcam) v 0.5 % BSA. –10 % Tween. Sekcije so bile trikrat sprane z 5 mM PBS 30 minut in inkubirane 647 minut pri sobni temperaturi s sekundarnim protitelesom Alex Fluor 1 oslovski protimišji IgG (Molecular Probes, Life Technologies, 1,000:5) v 0.5 % BSA–3 % Tween. v PBS, ponovno sprano v PBS (5 × 4,6 min) in nameščeno s kompletom ProLong antifade s 2-diamidino-5-fenilindolom (DAPI; Molecular Probes, Life Technologies). Slike so bile pridobljene s konfokalnim mikroskopom Leica STELLARIS 10 (znanstveni park UPV/EHU) z enakimi nastavitvami za vse odseke: ×4 povečava s slikanjem ploščic in šivanjem (običajno 5 × 405 vidnega polja). Laserska črta in okna zaznavanja so bila 440 nm in 503–489 nm za DAPI, 494 nm in 602–653 nm za beli laser FITC ter 660 nm in 836–647 nm za beli laser AlexaXNUMX.
Optično čiščenje
Po perfuziji s 4 % paraformaldehidom in PBS smo vzorce mehurja odstranili in nadalje fiksirali v 4 % paraformaldehidu čez noč pri 4 °C, nato pa vstavili v 5 ml brizgo z 0.8 % agarozo z nizkim tališčem, da se oblikuje cilindrični blok in omogoči enostavno namestitev v kvarčno kiveto. Celoten blok je bil postopoma dehidriran z uporabo metanola:H2O pri 4 °C (30%:70% za 1 h, 50%:50% za 1 h, 70%:30% za 1 h, 100%:0% za 1 h, nato 100% metanol čez noč in ponovno za 4 h) in končno potopljen v benzil alkohol-benzil benzoat (BABB) kot rešitev za ujemanje lomnega indeksa za slikanje. Za in vitro primerjave zelenih nanobotov FITC s komercialnimi rdečimi delci smo uporabili rdeče fluorescentne nanodelce silicijevega dioksida DiagNano (Creative Diagnostics), premera 1 µm, odporne na čiščenje BABB.
Avtofluorescenčno in polarizirano sLS slikanje
Slikanje s svetlobnimi lističi je bilo izvedeno na MacroSPIM, sistemu po meri za očiščeno slikanje celih organov, razvitem na IRB Barcelona44,45. Na kratko, vzorci so vstavljeni v agarozni blok, očiščeni skupaj z vzorcem in posneti v kvarčni kiveti. Avtofluorescenčno slikanje je uporabilo laserje pri 488, 561 ali 638 nm, ki zagotavljajo osvetlitev skozi 50 mm akromatično dvojno valjasto lečo (ACY254-050-A, Thorlabs). Da bi zmanjšali artefakte v obliki črt, je svetlobni list zasukan z resonančnim skenerjem SC-10 (EOPC) vzdolž teleskopa 4f z akromatskimi dvojnimi lečami G322288322 100 mm (QI Optic Photonics). Avtofluorescenca tkiva se zbira s pasovnimi ali dolgoprehodnimi fluorescenčnimi filtri in posname s kamero ORCA Flash v2 (Hamamatsu Photonics). Slikanje je bilo izvedeno pri × 9.6 z zoomom × 8, objektivom × 2 in cevastim objektivom × 0.6. Svetlobna plošča je bila sploščena čez vidno polje, kar je prineslo 5–6 µm aksialne ločljivosti. 3D slikanje je bilo narejeno v korakih po 2.5 µm. Slikanje celotnega mehurja je bilo opravljeno v 2 × 3 ali 3 × 4 XY ploščice, odvisno od velikosti orgel.
SLS slikanje je bilo doseženo z odstranitvijo fluorescenčnega filtra ali uporabo katerega koli filtra, ki prenaša laser. Vrtenje svetlobnih listov zmanjša hrup laserskih peg, kar povzroči časovno povprečenje laserske koherence, kot je prikazano prej52. Usmerjenost linearne polarizacije svetlobnih listov pri osvetlitvi je bila nadzorovana z vrtenjem polvalovne plošče (AHWP05M-600, Thorlabs) pred vrtljivim skenerjem. Zaznani signal je bil izbran v polarizaciji z uporabo rotirajočega linearnega polarizatorja (LPVISC100, Thorlabs) pred filtrirnim kolesom v detekciji, kar je povzročilo> 50-odstotno izgubo intenzitete pri detekciji fluorescence. Medtem ko se porazdelitev signala sLS na splošno spreminja z orientacijo polarizatorja, na signal avtofluorescence tkiva ostane nespremenjen zaradi vrtenja polarizatorja. sLS daje prostorsko ločljivost 2.4 ± 0.3 µm v BABB, kar je primerljivo z ločljivostjo pri slikanju s fluorescenčnimi svetlobnimi ploščami (potrjeno s prilagajanjem Gaussove funkcije XY slikovni odziv enega samega delca, dopolnilna sl. 8l–m) in blizu teoretične ločljivosti v zraku (1.53 µm z numerično odprtino (NA) = 0.2 pri največji makro povečavi ×8).
Obdelava slik in 3D analiza
Obdelava slik, segmentacija in analiza podatkovnih nizov svetlobnih listov je bila izvedena s programom ImageJ/Fiji, medtem ko so sl. 3 in 4 so bili ustvarjeni s programom Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) in dodatni video 3 je bilo ustvarjeno z Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Podatkovni nizi svetlobnih listov so bili sestavljeni z MosaicExplorerJ53. 3D segmentacija tkiva mehurja je bila izvedena z uporabo makrov ImageJ/Fiji po meri za polavtomatsko 3D označevanje velikih količin v virtualnem načinu. Na kratko, prvi skript, »Macro1«, naloži sklade 3D slik, omogoči uporabniške opombe ROI v več ravninah in samodejno interpolira ROI za ustvarjanje in izvoz 3D mask. ROI so bile narisane na vsakih 15 ravnin (vsakih 37.5 µm), da bi omogočili dobro kontinuiteto segmentacije, hkrati pa ohranili pripombe na razumnem minimumu. Drugi skript, »Macro2«, izvaja matematične ali logične operacije, ravnino za ravnino brez nalaganja celotnih skladov v pomnilnik, bodisi med 3D maskami bodisi med 3D masko in izvirnimi podatki, pri čemer shrani rezultat kot nov sklad. Vse maske so bile ustvarjene z označevanjem avtofluorescenčnih slik.
Površinske plasti tumorja in zdravega tkiva (sl. 3) so bili označeni s Fijijevo palico in orodjem za laso na votlini mehurja v maski. Če pokličemo to prvo iteracijo BC1, nadaljnji zagoni Macro1 nato samodejno razširijo to 3D konturo za določeno količino slikovnih pik, da dobimo nove iteracije maske, BC2, BC3 in tako naprej, z naraščajočimi dilatacijami. Prvo plast, ki vsebuje tumor in zdravo tkivo, masko L1, dobimo z odštevanjem maske BC1 od BC2 in tako naprej, pri čemer dobimo L2 in L3 kot koncentrični plasti. Volumen tumorja, ki je najbližji votlini, je bil pridobljen z označevanjem tumorja z orodji za palico in laso, da se ustvari maska T1, medtem ko je bila 3D plast zdravega urotelija zaznana ločeno v maski U1. Če od L1 odštejemo U1, dobimo površinsko plast tumorja in tako naprej: L2 − U1, L3 − U1. Nasprotno pa prvo plast urotelija dobimo z odštevanjem T1 od L1. Vse plasti na sl. 3 so bile opredeljene kot debeline 33 µm.
Isti nabor makrov in postopkov (orodje ImageJ wand, digitalna erozija 500 µm in tako naprej) je bil uporabljen za razmejitev in segmentacijo notranjega dela tkiva mehurja in nato oceno notranjega volumna tkiva mehurja (sl. 4, za podrobnosti glejte zgoraj). Histogrami intenzitete razpršenega signala so bili ustvarjeni na Fidžiju s kombinacijo razpršenega signala in maske.
uporaba RNT 131I-nanoboti
Med 8. in 15. dnevom po implantaciji tumorja so bile živali razdeljene v šest skupin (skupine 1–6), pri čemer so poskušale doseči podobne povprečne količine tumorja v skupinah (tabela 2). Za poskuse so bile živali inducirane z anestezijo (5% izofluran v čistem O2) in leži na hrbtu, preden izpraznite mehur z masažo trebušne regije. Takoj zatem 100 µl ustreznega tretmaja v koncentraciji 400 µg ml.-1 (Tabela 2) vkapali v mehur z uporabo 24-gauge katetra. Zdravilo in nosilec (voda ali sečnina) sta ostala v mehurju 1 h pred odstranitvijo katetra. Mehur je bil ponovno izpraznjen z masažo trebuha in miši so si opomogle od anestezije v svojih kletkah, pri čemer so 24 ur po zdravljenju nadomestili žagovino živalske kletke, da so odstranili radioaktivno onesnaženje.
Terapevtska učinkovitost je določena z MRI
Na vsaki miši sta bili izvedeni dve študiji MRI: (1) med 7. in 14. dnevom po inokulaciji tumorja, da so živali naključno razvrstili med skupine in izmerili začetne (pred obdelavo) volumne tumorja; (2) med 16. in 21. dnevom po inokulaciji tumorja (po zdravljenju), da se oceni terapevtska učinkovitost. MRI je bil opravljen s skenerji 7 T Bruker BioSpec in 11.7 T Bruker BioSpec (oba s programsko opremo ParaVision 7), odvisno od razpoložljivosti. To ni vplivalo na rezultate, saj zunanje polje ni kritično za anatomsko slikanje14. Poskusi slikanja so bili izvedeni z uporabo istih parametrov slikanja in obdelave, kot je razloženo zgoraj (Sledenje velikosti tumorja). V primeru skenerja 11.7 T je bila nastavitev sestavljena iz površinske tuljave mišjega srca za sprejem in volumetrične tuljave za prenos. Volumen tumorja v vsaki rezini je bil določen iz ročno narisanih interesnih volumnov, ki pokrivajo območje tumorja.
Statistična analiza
V študijah slikanja PET odstotki vbrizganega odmerka (% ID) in vbrizganega odmerka na volumen tumorja (% ID cm-3) primerjali z enosmerno ANOVA. Razlike med skupinami so bile določene s Tukeyjevim testom večkratnih primerjav. NTV v rubriki RNT smo pridobili od a t-test neparnih vrednosti. Domnevalo se je, da je porazdelitev podatkov normalna, vendar to ni bilo uradno testirano. Statistične analize so bile izvedene z GraphPad Prism v.8.
Povzetek poročanja
Dodatne informacije o oblikovanju raziskav so na voljo v Povzetek poročanja o portfelju narave povezan s tem člankom.
- Distribucija vsebine in PR s pomočjo SEO. Okrepite se še danes.
- PlatoData.Network Vertical Generative Ai. Opolnomočite se. Dostopite tukaj.
- PlatoAiStream. Web3 Intelligence. Razširjeno znanje. Dostopite tukaj.
- PlatoESG. Ogljik, CleanTech, Energija, Okolje, sončna energija, Ravnanje z odpadki. Dostopite tukaj.
- PlatoHealth. Obveščanje o biotehnologiji in kliničnih preskušanjih. Dostopite tukaj.
- vir: https://www.nature.com/articles/s41565-023-01577-y
- : je
- :ne
- ][str
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- O meni
- nad
- skladnosti
- akumulacija
- Doseči
- doseže
- pridobljenih
- pridobitev
- pridobitev
- čez
- aktivira
- aktivna
- dejavnost
- dodano
- dodajanje
- Poleg tega
- uprava
- vplivajo
- po
- potem
- spet
- Namerjen
- AIR
- AL
- alex
- algoritem
- vsi
- dovoljene
- skupaj
- Alzheimerjeva bolezen
- med
- znesek
- amiloid
- an
- analize
- Analiza
- Sidro
- in
- živali
- Živali
- protitelo
- kaj
- aplikacije
- uporabna
- Uporaba
- primerno
- odobren
- aqua
- SE
- OBMOČJE
- članek
- AS
- domnevajo
- predpostavke
- At
- Organi
- samodejno
- razpoložljivost
- Na voljo
- povprečno
- povprečenje
- b
- BABB
- pasovna širina
- Osnova
- BE
- pred
- vedenje
- počutje
- spodaj
- med
- Block
- telo
- kuhana
- tako
- Brain
- obremenitev
- vendar
- by
- kletke
- izračuna
- kliče
- kamera
- rak
- primeru
- primeri
- CCD
- celica
- Celice
- Spremembe
- naboj
- kemijske
- Obračun
- klik
- klinični
- Zapri
- tuljava
- kombinacija
- združevanje
- komercialna
- Odbor
- primerljiva
- v primerjavi z letom
- primerjave
- popolnoma
- dokončanje
- koncentracija
- stanje
- Pogoji
- poteka
- zaupanje
- POTRJENO
- zaporedna
- kontinuiteto
- stalno
- nadzor
- nadzorom
- nasprotno
- Cool
- popravljen
- Popravki
- Ustrezno
- Svet
- skupaj
- kritje
- ustvarjajo
- ustvaril
- Ustvarjanje
- Creative
- Merila
- kritično
- CT skenira
- po meri
- Cut
- Temnomodra
- datum
- nabor podatkov
- dan
- Dnevi
- de
- opredeljen
- dostavo
- Odvisno
- opisano
- Oblikovanje
- želeno
- Podrobnosti
- Zaznali
- Odkrivanje
- Ugotovite,
- določi
- določanje
- razvili
- naprava
- diagnostika
- DID
- Razlika
- razlike
- drugačen
- Difuzija
- digitalni
- razredčen
- smer
- bolezen
- jed
- Razpršenost
- distribucija
- Distribucije
- deljeno
- do
- ne
- opravljeno
- Odmerek
- sestavljene
- Drop
- trajanje
- dinamično
- dinamika
- e
- E&T
- vsak
- lahka
- echo
- učinkovitost
- bodisi
- vgrajeni
- omogočajo
- omogoča
- Končna točka
- okrepljeno
- Celotna
- encimski
- opremljena
- ustanovljena
- vzpostavitev
- oceniti
- Eter (ETH)
- etika
- Evropski
- oceniti
- Tudi vsak
- Pregled
- presežena
- Razen
- pričakovanja
- Pričakuje
- poskus
- eksperimentalni
- Poskusi
- razložiti
- izvoz
- zunanja
- olajšati
- Faktor
- ženska
- Polje
- Slika
- Slika
- napolnjena
- filter
- Filtri
- končna
- končno
- prva
- opremljanje
- Všita
- Flash
- sledili
- po
- za
- obrazec
- formaldehid
- Formalno
- Naprej
- štiri
- iz
- zamrznjena
- funkcija
- nadalje
- vrzel
- ge
- GE Healthcare
- splošno
- ustvarjajo
- ustvarila
- Giving
- dobro
- gradienti
- Gram
- Zelen
- skupina
- Skupine
- Rast
- Smernice
- Imajo
- he
- Zdravje
- zdravstveno varstvo
- zdravo
- Srce
- HTTPS
- huang
- človeškega
- zahteva
- ID
- enako
- if
- slika
- analiza slike
- slike
- slikanje
- takoj
- potopljen
- izboljšuje
- in
- vključeno
- vključujoč
- narašča
- inkubirano
- Inkubacija
- INKUBACIJA
- Neodvisni
- Indeks
- indukcijo
- Podatki
- začetna
- notranja
- v notranjosti
- instrumenti
- integrirana
- interaktivno
- obresti
- notranji
- v
- Predstavljamo
- ponovitev
- ponovitve
- ITS
- KDA
- vzdrževanje
- Komplet
- l2
- velika
- laser
- laserji
- plast
- plasti
- odhodu
- levo
- Lens
- leče
- življenje
- light
- vrstica
- LINK
- povezane
- nalaganje
- obremenitve
- lokalna
- off
- Makro
- makri
- vzdrževati
- vzdrževanje
- ročno
- Maska
- Maske
- ujemanje
- Material
- materiali
- matematični
- Matrix
- največja
- pomeni
- merjenje
- izmerjena
- meritve
- merjenje
- mediji
- Spomin
- merino
- Metanol
- Metode
- miši
- Mikroskop
- Mikroskopija
- minut
- minimalna
- mladoletnika
- mešano
- mešanico
- ML
- Mobilni
- način
- Model
- modeli
- spremembe
- modul
- molekularno
- spremljati
- spremljanje
- motion
- miš
- MRI
- MS
- MT
- več
- nanotehnologija
- Narava
- omrežij
- Nevtralna
- Novo
- št
- hrup
- normalno
- Cilj
- opazovana
- pridobi
- pridobljeni
- of
- Staro
- on
- ONE
- deluje
- operativno
- operacije
- optimizirana
- or
- Orca
- izvirno
- več
- čez noč
- Oxford
- Kisik
- Papir
- parametri
- parkirati
- del
- delec
- PBS
- Peg
- penetracija
- za
- opravljeno
- opravlja
- hišne
- Petri
- faze
- pivot
- pixel
- postavi
- letalo
- Letala
- platon
- Platonova podatkovna inteligenca
- PlatoData
- Točka
- točke
- Portfelj
- Stališče
- pozicioniran
- Precision
- pripravljeni
- predstaviti
- prej
- postopek
- Postopki
- obravnavati
- postopoma
- protokol
- Qi
- količinsko
- radio
- naključno
- Naključno
- PODGANA
- Oceniti
- razmerje
- Reagirajo
- reakcija
- Bralec
- razumno
- Razlogi
- prejetih
- sprejem
- Zabeležena
- Obnovi
- Rdeča
- zmanjša
- Zmanjšana
- zmanjšuje
- reference
- okolica
- ostalo
- ostanki
- odstrani
- Odstranjeno
- odstranjevanje
- Prijavljeno
- Poročanje
- predstavnik
- obvezna
- Raziskave
- odporna
- Resolucija
- oziroma
- Odgovor
- povzroči
- rezultat
- Rezultati
- robot
- soba
- deluje
- s
- SA
- Enako
- shranjevanje
- skenira
- razpršene
- SCI
- znanstveno
- script
- drugi
- sekundarno
- Oddelek
- oddelki
- glej
- Segment
- segmentacija
- izbran
- Zaporedje
- služil
- nastavitve
- več
- stanja
- pokazale
- Signal
- Distribucija signala
- Podoben
- saj
- sam
- SIX
- Velikosti
- Slice
- majhna
- So
- natrijev
- Software
- Rešitev
- rešitve
- prostorsko
- Stabilnost
- sveženj
- Skladovnice
- Statistično
- stellaris
- Koraki
- shranjeni
- trak
- študent
- Študije
- kasneje
- Kasneje
- apartma
- Površina
- Simptomi
- sinteza
- sistem
- T
- T1
- miza
- ob
- tech
- Tehnologije
- teleskop
- Predloga
- deset
- Test
- Testiran
- da
- O
- njihove
- Njih
- POTEM
- Teoretični
- Terapevtsko
- terapija
- ta
- temeljito
- tisti,
- 3
- Tridimenzionalni
- skozi
- vsej
- čas
- krat
- tkivo
- do
- skupaj
- orodje
- orodja
- Skupaj za plačilo
- proti
- proti
- preoblikovanje
- Zdravljenje
- Triton
- poskuša
- tumorjev
- dva
- tip
- tipično
- nedotaknjen
- pod
- dokler
- naprej
- Rabljeni
- uporabnik
- uporabo
- Vrednote
- vozilo
- Proti
- preko
- Video
- Video posnetki
- Poglej
- Virtual
- vizualizirati
- vivo
- Obseg
- prostornine
- volumetrična
- Walker
- stena
- je
- pranje
- Voda
- we
- Weeks
- teža
- Dobro počutje
- so bili
- Kolo
- ki
- medtem
- bele
- okna
- z
- v
- brez
- X
- donos
- Mehek
- donosov
- zefirnet
- zoom