Članek pokriva ključne točke, povezane z obstoječimi regulativnimi zahtevami, in izpostavlja najpomembnejše vidike, ki jih morajo upoštevati vpletene strani.

Kazalo
Uprava za hrano in zdravila (FDA ali Agencija), ameriški regulativni organ na področju zdravstvenih izdelkov, je objavila vodilni dokument ki predstavlja priročnik za sestavljanje diagnostične rentgenske opreme. Dokument vsebuje pregled veljavnih regulativnih zahtev ter dodatna pojasnila in priporočila, ki jih morajo upoštevati proizvajalci medicinskih pripomočkov in druge vpletene strani, da bi zagotovili skladnost z njimi. Obenem so določbe navodil po svoji pravni naravi nezavezujoče, niti niso namenjene uvajanju novih pravil ali nalaganju novih obveznosti. Poleg tega organ izrecno navaja, da bi se lahko uporabil tudi alternativni pristop, če je ta v skladu z obstoječo zakonodajo in je bil predhodno dogovorjen z organom. Ta dokument predstavlja revidirano različico smernic, ki so bile prvotno izdane maja 2011.
Regulativno ozadje
Organ najprej podaja pregled veljavne zakonodaje, ki je podlaga za obstoječ pravni okvir za diagnostične rentgenske medicinske pripomočke. V skladu s smernicami je sestavljen iz Zakona o nadzoru sevanja za zdravje in varnost iz leta 1968, ki je bil pozneje vključen v Zvezni zakon o hrani, zdravilih in kozmetiki (FD&C) na podlagi Zakona o varnih medicinskih pripomočkih iz leta 1990. Ustrezni vidiki so obravnavano v podpoglavju J poglavja I uredbe 21 CFR in standardih diagnostične učinkovitosti rentgenskih žarkov za elektronske izdelke. Zgoraj navedeni predpisi urejajo zadeve v zvezi s proizvodnjo, uvozom in vgradnjo naprav, ki oddajajo sevanje. Zahteve za posamezne naprave so določene v predpisih 21 CFR 1020.30 »Diagnostični rentgenski sistemi in njihove glavne komponente«, 21 CFR 1020.31 »Radiografska oprema«, 21 CFR 1020.32 »Fluoroskopska oprema« in 21 CFR 1020.33 »Računalniška tomografija (CT) oprema«.
Poleg tega se te smernice nanašajo na standarde delovanja, ki so standardi delovanja za diagnostične rentgenske sisteme in njihove glavne komponente.
Hkrati organ izrecno navaja, da področje uporabe teh navodil zajema samo zahteve, določene v skladu z določbami EPRC, ki jih vsebuje FD&C Act, medtem ko zahteve, ki jih predpisujejo splošne določbe o medicinskih pripomočkih navedenega zakona, ne spadajo v okvir področje uporabe teh smernic.
Da bi zagotovili skladnost z veljavnimi regulativnimi zahtevami, morajo proizvajalci medicinskih pripomočkov, ki delajo z rentgenskimi izdelki, zagotoviti skladnost z vsemi ustreznimi zahtevami, uvedenimi v skladu s prej omenjenimi predpisi in standardi. Prav tako so dolžni namestiti ustrezne oznake, ki potrjujejo, da je izdelek certificiran. Organ tudi omenja, da so včasih diagnostični rentgenski sistemi sestavljeni iz komponent, ki jih proizvajajo različni subjekti, zato je njihovo pravilno delovanje, kadar se uporabljajo skupaj, bistvenega pomena, kot tudi namestitev in končno testiranje, ki ga je treba izvesti pred uporabo sistema. za predvideni namen.
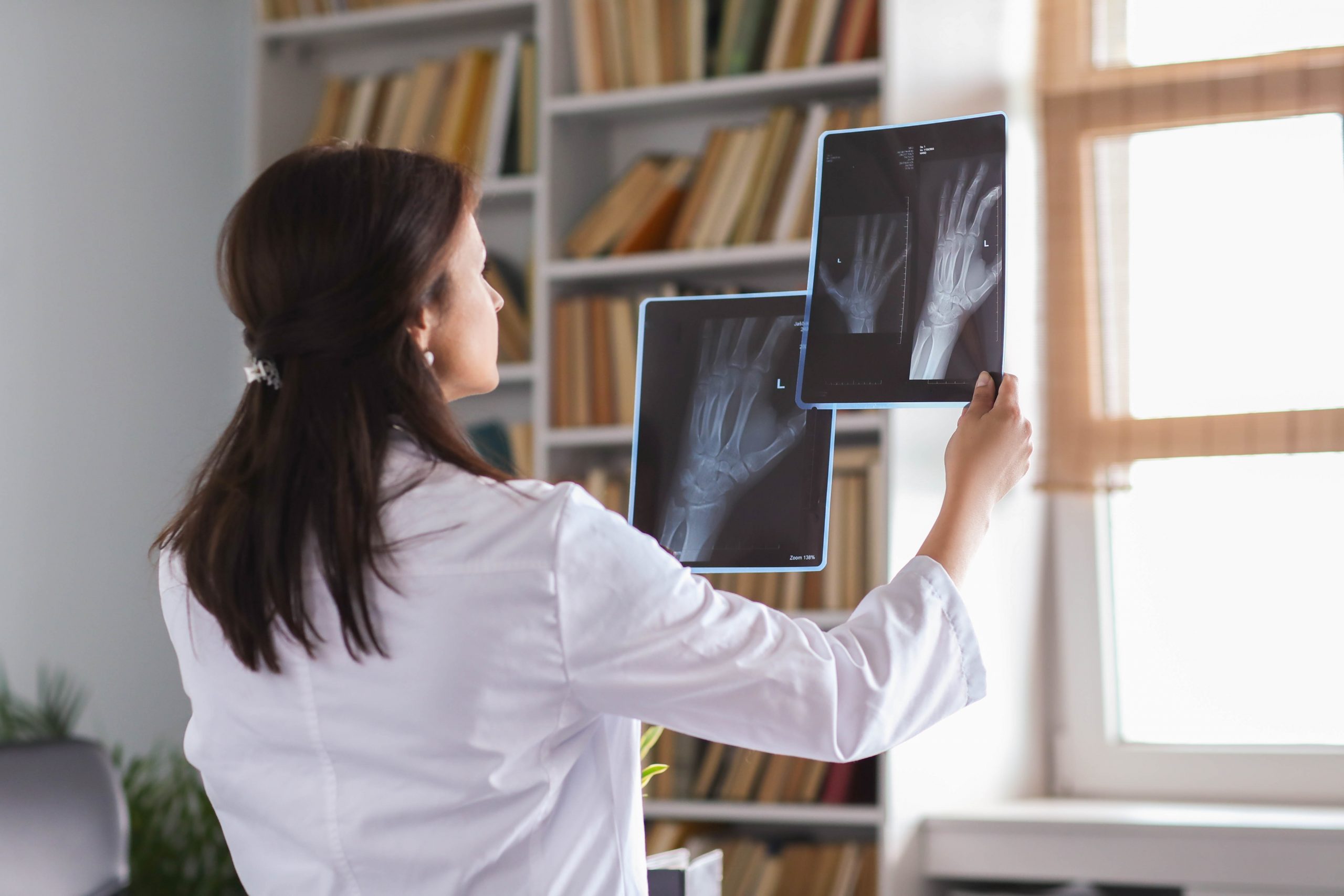
Odgovornosti proizvajalcev diagnostične rentgenske opreme
Dokument nadalje opisuje glavne odgovornosti strank, ki sodelujejo pri proizvodnji rentgenskih sistemov. V skladu z veljavnimi predpisi vključujejo obveznosti:
- Potrdite, da je vsaka komponenta v skladu s standardom učinkovitosti. Proizvajalec na podlagi certificiranja potrjuje, da bodo izdelki delovali, kot je predvideno, in bodo v skladu z veljavnimi regulativnimi zahtevami, ko se bodo uporabljali za predvideni namen, če bodo pravilno sestavljeni in testirani.
- Na vsako komponento namestite certifikacijske in identifikacijske nalepke s polnim imenom in naslovom proizvajalca, datumom in krajem izdelave, oznako modela in serijsko številko.
- Sestavljavcu zagotovite navodila za sestavljanje, namestitev, prilagoditev in preizkušanje komponente, ki so ustrezna za zagotovitev, da bo izdelek skladen s standardi delovanja, ko se upoštevajo navodila. Organ dodatno poudarja, da morajo navedena navodila vsebovati tudi podatke o komponentah, ki jih je treba uporabiti, da se zagotovi kompatibilnost in pravilno delovanje diagnostičnega rentgenskega sistema. Informacije o združljivih komponentah so lahko podane v obliki opisa lastnosti ali kot seznam specifičnih komponent z navedbo modela in proizvajalca.
- Kupcem priskrbite navodila, ki opisujejo specifične tehnične specifikacije opreme ter vse potrebne varnostne ukrepe in postopke za radiološko varnost. Kot je pojasnila FDA, bi to moralo vključevati podrobnosti priporočenega urnika vzdrževanja, ki naj bi ga upoštevale stranke, ki uporabljajo napravo, da bi zagotovili njeno stalno skladnost z veljavnimi regulativnimi zahtevami in standardi delovanja.
Splošne odgovornosti sestavljavcev
Področje uporabe smernic zajema tudi vidike, povezane z odgovornostjo sestavljavcev. V skladu s predpisom 21 CFR 1020.30(b) asembler pomeni katera koli oseba, ki se ukvarja s sestavljanjem, zamenjavo ali nameščanjem ene ali več komponent v diagnostični rentgenski sistem ali podsistem; izraz vključuje lastnika rentgenskega sistema ali njegovega zaposlenega ali zastopnika, ki sestavlja komponente v rentgenski sistem, ki se nato uporablja za zagotavljanje profesionalnih ali komercialnih storitev. Organ še navaja, da bi zgornja definicija lahko veljala tudi za tiste, ki jim montaža diagnostičnih rentgenskih sistemov ni običajen posel.
Čeprav obstaja določeno prekrivanje med pojmoma »sestavljalec« in »proizvajalec«, trenutni regulativni okvir določa ločene zahteve za vsakega od njiju. Zlasti morajo vse strani, ki sestavljajo diagnostične rentgenske sisteme za uporabo pri ljudeh, upoštevati odgovornosti sestavljavcev.
Veljavni predpisi določajo, da sestavljavci niso odgovorni za skladnost uporabljenih komponent z veljavnimi regulativnimi zahtevami. Hkrati so dolžni izpolnjevati obveznost poročanja o izvedenem zboru.
Če povzamemo, te smernice FDA zagotavljajo pregled obstoječega regulativnega okvira za diagnostično rentgensko opremo kot izdelke, ki oddajajo sevanje. Dokument poudarja tudi ključne točke, ki jih je treba upoštevati pri opisovanju odgovornosti vpletenih strani, vključno s proizvajalci in sestavljavci medicinskih pripomočkov.
Viri:
Kako lahko RegDesk pomaga?
RegDesk je holistični sistem za upravljanje regulativnih informacij, ki podjetjem za medicinske pripomočke in farmacevtska podjetja zagotavlja regulativne informacije za več kot 120 trgov po vsem svetu. Pomaga vam lahko pri pripravi in objavi globalnih aplikacij, upravljanju standardov, izvajanju ocen sprememb in prejemanju opozoril v realnem času o regulativnih spremembah prek centralizirane platforme. Naše stranke imajo tudi dostop do naše mreže več kot 4000 strokovnjakov za skladnost po vsem svetu, da pridobijo preverjanje kritičnih vprašanj. Globalna širitev še nikoli ni bila tako preprosta.
Želite izvedeti več o naših rešitvah? Pogovorite se s strokovnjakom za RegDesk še danes!
- Distribucija vsebine in PR s pomočjo SEO. Okrepite se še danes.
- Platoblockchain. Web3 Metaverse Intelligence. Razširjeno znanje. Dostopite tukaj.
- vir: https://www.regdesk.co/fda-assemblers-guide-to-diagnostic-x-ray-equipment-overview/
- : je
- 1
- 2011
- 8
- a
- O meni
- nad
- dostop
- Po
- Zakon
- Dodatne
- Poleg tega
- Naslov
- naslavljanje
- Prilagoditev
- uprava
- napredovanje
- agencija
- Agent
- Opozorila
- vsi
- alternativa
- in
- primerno
- aplikacije
- uporabna
- pristop
- primerno
- SE
- članek
- AS
- vidiki
- sestavljeni
- Skupščina
- Ocene
- At
- organ
- Osnova
- BE
- pred
- počutje
- med
- poslovni
- by
- CAN
- centralizirano
- nekatere
- certificiranje
- Certified
- spremenite
- Spremembe
- Poglavje
- lastnosti
- stranke
- komercialna
- Podjetja
- združljivost
- združljiv
- dokončanje
- skladnost
- komponenta
- deli
- Sestavljeno
- koncepti
- poteka
- premislek
- šteje
- naprej
- nadzor
- bi
- prevleke
- Ustvarjanje
- kritično
- Trenutna
- Datum
- opis
- imenovanje
- Podrobnosti
- naprava
- naprave
- drugačen
- dokument
- drog
- vsak
- Electronic
- poudarja
- Zaposlen
- , ki se ukvarjajo
- zagotovitev
- subjekti
- oprema
- Tudi
- obstoječih
- Širitev
- strokovnjak
- Strokovnjaki
- razložiti
- Falling
- FDA
- Zvezna
- končna
- sledili
- hrana
- Food and Drug Administration
- za
- obrazec
- Okvirni
- Izpolnite
- polno
- delovanje
- nadalje
- splošno
- Globalno
- globalna širitev
- Navodila
- vodi
- Imajo
- Zdravje
- zdravstveno varstvo
- pomoč
- Poudarki
- celosten
- HTTPS
- Ljudje
- i
- Identifikacija
- Pomembno
- naložila
- in
- vključujejo
- vključuje
- Vključno
- Vključena
- indikacija
- Podatki
- na začetku
- Namestitev
- Navodila
- Intelligence
- uvesti
- Uvedeno
- vključeni
- Izdala
- IT
- ITS
- jpg
- Ključne
- Vedite
- Oznake
- Pravne informacije
- pravni okvir
- Zakonodaja
- vrstica
- Seznam
- Glavne
- vzdrževanje
- velika
- upravljanje
- upravljanje
- upravljalni sistem
- proizvedeni
- Proizvajalec
- Proizvajalci
- proizvodnja
- Prisotnost
- Zadeve
- max širine
- medicinski
- medicinski pripomoček
- medicinske naprave
- omenjeno
- omenja
- Model
- več
- Poleg tega
- Najbolj
- Ime
- Narava
- potrebno
- mreža
- Novo
- Številka
- obveznice
- pridobi
- of
- on
- ONE
- deluje
- operacije
- Da
- redni
- Ostalo
- obrisi
- zunaj
- pregled
- Lastnik
- zlasti
- Stranke
- performance
- oseba
- Pharma
- Kraj
- platforma
- platon
- Platonova podatkovna inteligenca
- PlatoData
- točke
- Pripravimo
- predstaviti
- Postopki
- Izdelek
- Izdelki
- strokovni
- pravilno
- pravilno
- zagotavljajo
- če
- zagotavlja
- objavijo
- objavljeno
- nakupi
- Namen
- vprašanja
- Sevanje
- v realnem času
- Priporočila
- priporočeno
- nanaša
- Uredba
- predpisi
- regulatorni
- povezane
- pomembno
- Poročanje
- Zahteve
- odgovornosti
- Odgovornost
- odgovorna
- pravila
- Run
- s
- varna
- Varnost
- Je dejal
- Enako
- urnik
- Obseg
- ločena
- serijska
- Storitve
- nastavite
- shouldnt
- Enostavno
- So
- rešitve
- Viri
- govorijo
- specifična
- specifikacije
- standardna
- standardi
- stojala
- Države
- Kasneje
- taka
- POVZETEK
- sistem
- sistemi
- tehnični
- Testiranje
- da
- O
- informacije
- njihove
- Njih
- skozi
- čas
- Naslov
- do
- skupaj
- pod
- us
- Preverjanje
- različica
- Dobro
- ki
- medtem
- WHO
- bo
- z
- po vsem svetu
- x-ray
- zefirnet












