NMPA опубликовало окончательный вариант документа «Руководство по планированию реальных исследований медицинского оборудования и статистическому анализу» 15 января 2024 года. Черновая версия была выпущена 28 сентября 2023 года.
Значение Руководства
Это руководство поможет зарубежным производителям продолжить изучение пилотной программы Hainan Real-world Data.
Пилотная зона Хайнань-Боао позволяет использовать в Китае неутвержденные медицинские изделия, внутривенные имплантаты и лекарства, имеющие статус клинической неотложности. При коммерциализации и продаже своей продукции производители могут собирать RWD через RWS на Хайнане в качестве местных клинических доказательств в Китае для подтверждения своей национальной регистрации NMPA. Специальная программа может сократить доступ на рынок Китая до 4 месяцев.
Правительство Хайнаня опубликовало «Положение об управлении импортными лекарственными средствами и медицинским оборудованием для неотложного использования в пилотной зоне международного медицинского туризма Боао Лечэн порта свободной торговли Хайнань» 28 марта 2023 года. В документе говорится, что он НЕ требует местных типовых испытаний или значительного бремени доказывания, как национальное одобрение.
Основные моменты Руководства
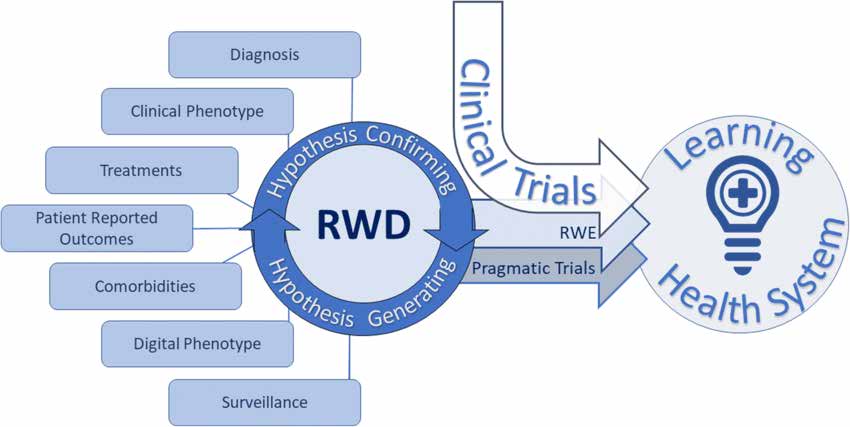
В документе «План исследования и статистический анализ» описаны различные типы реальных исследований следующим образом:
Прагматические рандомизированные контролируемые исследования (рРКИ) предназначены для оценки результатов лечения в реальных медицинских учреждениях. Они используют рандомизированные и контрольные группы для оценки эффективности вмешательства. ПрРКИ предоставляют высококачественные фактические данные и подходят для различных групп пациентов и клинических сценариев.
Наблюдательные исследования в реальном мире включают в себя различные дизайны исследований:
- Дизайн описательного исследования описывать характеристики пациента или состояние здоровья, не делая вывод о причинно-следственной связи.
- Когортные дизайны отслеживать результаты в различных группах пациентов на основе использования устройств с помощью проспективных и ретроспективных вариантов.
- Случай-контроль и производные проекты сравните пациентов, использующих и не использующих устройства, и включите вложенные исследования «случай-контроль» и когортные исследования «случай».
- Реальные данные как внешний контроль предполагают использование реальных данных в качестве контрольной группы, хотя подробные инструкции отсутствуют.
В документе излагаются соображения по разработке протоколов реальных исследований:
- Предпосылки и цели: Определить предпосылки исследования, цели, а также вопросы безопасности и эффективности на основе существующих данных.
- ТЭО: Оценить возможность проведения реальных исследований с учетом доступности, качества и вмешивающихся переменных.
- Выберите подходящий дизайн исследования: выберите дизайн на основе целей, будь то экспериментальных или наблюдательных.
- Блок-схема исследования: Создайте блок-схему с подробным описанием процесса исследования, включая отбор пациентов, вмешательства и обследования.
- Определить исследуемую совокупность: Четко определить критерии включения и исключения для исследуемой популяции.
- Экспозиция устройства: Оцените, как пациенты подвергаются воздействию устройства, учитывая возможные отклонения.
- Контрольная группа: Определите подходящие контрольные группы для наблюдательных исследований, чтобы сбалансировать мешающие переменные.
- Критерии оценки: Определить показатели результата, включая их цель, определение и методы измерения.
- Сбор данных: Разработать формы и словари сбора данных с указанием источников данных, качества информации и методов связи.
- Поправка на искажающую переменнуюs: Определите мешающие переменные и включите/исключите их с указанием причин.
- Время наблюдения: Определите время последующего наблюдения за пациентом, чтобы адекватно ответить на вопросы исследования.
- Размер выборки и расчет мощности: Рассчитайте размер выборки и статистическую мощность с учетом различных факторов.
Он также подчеркивает важность контроля качества:
- Качество данных: оценка качества данных с точки зрения репрезентативности, полноты, точности и т. д.
- Риск предвзятости: Описать меры по контролю рисков предвзятости на различных этапах, включая отбор, информацию и искажающую предвзятость.
- Оценка предвзятости: Распознайте различные типы предубеждений и оцените их направление и величину.
- Этический обзор: Обеспечить соответствие этических проверок и информированного согласия нормативным требованиям.
Сравнение двух версий
По сравнению с черновой версией, в окончательном документе в разделе «Статистический анализ» упоминается «Определение искажающих переменных, которые требуют модификации».
В нерандомизированных проектах реальных исследований выявление вмешивающихся переменных имеет решающее значение для контроля предвзятости. Для их идентификации используются три критерия: переменная имеет причинно-следственную связь с исходом, связана с группирующей переменной (воздействием) и не является промежуточной переменной на причинно-следственной связи. Рекомендуемый подход предполагает процесс рационального выбора переменных, основанный на профессиональных знаниях и клиническом опыте, в сотрудничестве с клиническими и статистическими экспертами. Для неопределенных переменных предлагается анализ чувствительности с указанием причин и подтверждающих данных для включения/исключения. Рекомендуется использовать консервативный подход к выбору переменных, избегая несвязанных переменных и учитывая такие проблемы, как мультиколлинеарность и эффекты взаимодействия, визуализируемые с помощью направленных ациклических графов (DAG).
Чтобы получить копию руководства на английском языке, отправьте электронное письмо info@ChinaMedDvice.com. Мы взимаем символическую плату за перевод.
Просмотр последние новости по программе Hainan Real World Data.
Просмотр руководство по коммуникации работа с контролирующими органами.
Посмотреть наш записанный вебинар о политике Хайнаня.
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://chinameddevice.com/real-world-study-nmpa/
- :имеет
- :является
- :нет
- 15%
- 2023
- 2024
- 28
- a
- доступ
- точность
- ациклический
- адекватно
- администрация
- рекомендуется
- позволяет
- причислены
- an
- анализ
- и
- ответ
- подхода
- соответствующий
- утверждение
- МЫ
- AS
- оценить
- связанный
- At
- Власти
- свободных мест
- избегающий
- фон
- Баланс
- основанный
- BE
- смещение
- предубеждения
- бремя
- вычислять
- CAN
- характеристика
- заряд
- Китай
- Выберите
- явно
- Клинический
- сотрудничество
- собирать
- лыжных шлемов
- COM
- соблюдать
- Условия
- проведение
- согласие
- консервативный
- соображения
- принимая во внимание
- контроль
- контроль
- управление
- контрольная
- Создайте
- Критерии
- решающее значение
- данным
- Качество данных
- определять
- определение
- Производный
- описывать
- описывает
- Проект
- предназначенный
- проектирование
- конструкций
- подробный
- Детализация
- Определять
- развивать
- устройство
- Устройства
- различный
- направленный
- направление
- Разное
- документ
- приносит
- проект
- Наркотики
- эффективность
- эффекты
- подчеркивает
- Английский
- обеспечивать
- этический
- оценивать
- , поскольку большинство сенаторов
- существующий
- опыт
- экспериментальный
- эксперты
- Больше
- подвергаться
- Экспозиция
- и, что лучший способ
- содействовал
- факторы
- осуществимость
- Сборы
- окончательный
- доработан
- после
- Что касается
- формы
- Бесплатно
- далее
- Правительство
- Графики
- группы
- Группы
- методические рекомендации
- Медицина
- здравоохранение
- высококачественный
- Как
- HTTPS
- определения
- идентифицирующий
- значение
- in
- включают
- включает в себя
- В том числе
- включение
- информация
- сообщил
- взаимодействие
- Intermediate
- Мультиязычность
- вмешательство
- вмешательства
- включает в себя
- вопросы
- IT
- январь
- JPG
- знания
- недостающий
- лидер
- такое как
- локальным
- Производители
- Март
- рынок
- измерение
- меры
- основным медицинским
- медицинский прибор
- медицинские приборы
- упоминает
- методы
- может быть
- месяцев
- БОЛЕЕ
- национальный
- Необходимость
- целей
- наблюдение
- наблюдательный
- of
- on
- Опции
- or
- наши
- Результат
- Результаты
- контуры
- за рубежом
- путь
- пациент
- пациентов
- пилот
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- пожалуйста
- сборах
- население
- популяции
- потенциал
- мощностью
- процесс
- Продукция
- профессиональный
- FitPartner™
- доказательство
- предполагаемый
- протоколы
- обеспечивать
- обеспечение
- опубликованный
- цель
- Вопросы
- Рандомизированное
- Рациональный
- реальные
- реальный мир
- причины
- Управление по борьбе с наркотиками (DEA)
- Регистрация
- правила
- регуляторы
- отношения
- выпустил
- требовать
- исследованиям
- Отзывы
- рисках,
- Сохранность
- говорит
- Сценарии
- Раздел
- выбор
- продажа
- чувствительность
- сентябрь
- настройки
- значительный
- Размер
- Источники
- особый
- этапы
- статистический
- Статус:
- исследования
- Кабинет
- подходящее
- поддержка
- поддержки
- terms
- Тестирование
- который
- Ассоциация
- их
- Их
- они
- хоть?
- три
- Через
- раз
- в
- Туризм
- трек
- торговать
- Переводы
- лечение
- испытания
- два
- напишите
- Типы
- Неопределенный
- острая необходимость
- срочный
- использование
- используемый
- через
- переменная
- различный
- версия
- законопроект
- we
- будь то
- в то время как
- будете
- без
- работает
- Мир
- зефирнет