Синтез наноботов
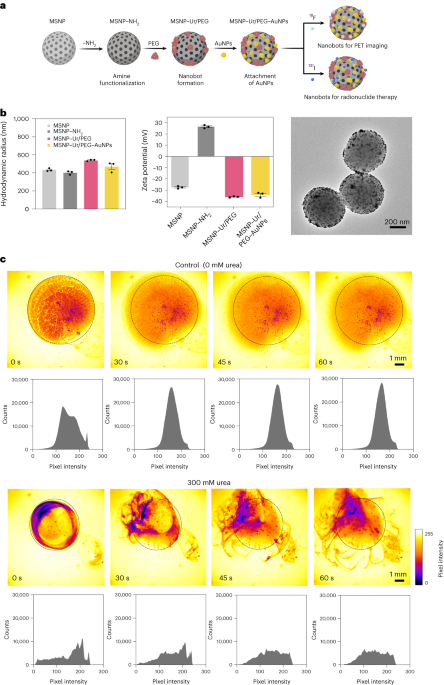
Наноботы были подготовлены, как описано ранее.33. Короче говоря, MSNP были синтезированы с использованием модифицированного метода Штёбера.41, взаимодействие триэтаноламина (35 г), сверхчистой воды (20 мл) и бромида гексадецилтриметиламмония (ЦТАБ; 570 мг) при 95°C в течение 30 минут при перемешивании. Затем по каплям добавляли тетраэтилортосиликат (1.5 мл); смесь оставляли реагировать в течение 2 часов при 95°C и полученные MSNP собирали центрифугированием и промывали этанолом (трижды, 2,500g, 5 мин). Чтобы удалить матрицу CTAB, MSNP помещали под кипячение с обратным холодильником в кислый метанол (1.8 мл HCl, 30 мл метанола) на 24 часа. Затем MSNP собирали центрифугированием и трижды промывали этанолом (2,500 мкл).g, 5 мин) перед включением модификации амина путем добавления APTES (6 мкл на мг MSNP) к MSNP (1 мг мл-1) в 70% этанольном растворе при температуре 70°C, энергично перемешивая в течение 1 часа. MSNP-NH2 собирали и трижды промывали в этаноле и трижды в воде центрифугированием (трижды, 1,150g, 5 мин). MSNP-NH2 ресуспендировали в PBS в концентрации 1 мг мл.-1 и общий объем 900 мкл, и активировали глутаральдегидом (100 мкл) в течение 2.5 ч при комнатной температуре. Активированные MSNP-NH2 собирали и трижды промывали в PBS центрифугированием (1,150g, 5 мин), ресуспендируют в растворе уреазы (3 мг мл-1) и гетеробифункциональный ПЭГ (1 мкг ПЭГ на мг 5 кДа HS-MSNP-NH2) в PBS и реагировал в течение 24 часов при комнатной температуре. Полученные нанороботы затем собирали и трижды промывали в PBS центрифугированием (1,150 мкл).g, 5 мин) перед их ресуспендированием в дисперсии AuNP, приготовленной, как описано ранее.51, оставляя их реагировать на 10 минут и тщательно промывая центрифугированием (трижды по 1,150g, 5 мин).
Гидродинамическое распределение по размерам и поверхностный заряд МСНЧ, МСНЧ-NH2Наноботы и наноботы, украшенные AuNP, определялись с использованием системы динамического светорассеяния Wyatt Mobius и Malvern Zetasizer соответственно. Во всех случаях концентрация составляла 20 мкг мл.-1 и время сбора данных 5 с, используя три прогона на эксперимент. Было проведено три измерения для каждого типа частиц.
Синтез MSNP FITC
Готовили смесь FITC (2 мг), этанола (5 мл) и APTES (400 мкл) и перемешивали в течение 30 минут. Затем следовали ранее описанному протоколу синтеза MSNP, за исключением того, что мы добавляли по каплям тетраэтилортосиликат (1.25 мл) в сочетании со смесью FITC-APTES (250 мкл). Шаги функционализации для получения нанороботов, меченных FITC, были такими же, как указано выше.
Синтез AuNP
AuNP были синтезированы с использованием описанного метода.33. Короче говоря, все материалы были очищены свежеприготовленной царской водкой, тщательно промыты водой и высушены на воздухе. Впоследствии 1 мМ AuCl4 раствор нагревали до точки кипения при перемешивании в круглодонной колбе, встроенной в систему обратного орошения. После этого добавляли 10 мл раствора цитрата натрия (30.8 мМ) и раствор кипятили в течение 20 минут, в результате чего он приобретал красный цвет. Затем раствору давали остыть до комнатной температуры при перемешивании в течение 1 часа. Полученные AuNP хранили в темноте, а характеристики проводили с помощью просвечивающей электронной микроскопии.
Ферментативная активность
Ферментативная активность нанороботов, 18F-наноботы и 131I-наноботы измеряли с использованием фенолового красного. Для этого 2 мкл наноботов (1 мг мл-1) добавляли в 96-луночный планшет и смешивали с 200 мкл различных растворов мочевины (0, 50, 100, 200 мМ) в 1.1 мМ фенолового красного. Поглощение при длине волны 560 нм измеряли с течением времени при 37°C.
Динамика движения наноботов с помощью оптической микроскопии
Оптические видео наноботов были получены с использованием микроскопа Leica Thunder в сочетании с высокоскоростной ПЗС-камерой Hamamatsu и объективом ×1.25. Для этого наноботов центрифугировали и ресуспендировали в 50 мкл PBS (конечная концентрация 20 мг мл).-1). Затем чашку Петри заполняли 3 мл либо PBS, либо 300 мМ раствора мочевины (в PBS) и наблюдали под микроскопом. Капля 5 мкл с наноботами (20 мг мл-1) затем добавляли в наполненную жидкостью чашку Петри и записывали видео со скоростью 25 кадров в секунду. Распределение интенсивности видеопикселей в ROI анализировалось с интервалом в 15 секунд с использованием программного обеспечения ImageJ.
Радиомечение наноботов с помощью [18F]F-PyTFP
Синтез [18F]F-PyTFP
[18F]F-PyTFP был синтезирован в модуле Neptis xSeed (оптимизированные радиохимические приложения) по ранее описанному методу.33.
Синтез 18Наноботы с F-маркировкой
Нанороботы были помечены [18F]F-PyTFP, по ранее установленной методике с небольшими изменениями.33. Короче говоря, 200 мкл раствора нанобота (1 мг мл-1) центрифугировали (10 мин, 13,853 XNUMXg), ресуспендировали в 10 мкл PBS (1 мМ, pH 8) и инкубировали с 4 мкл [18F]F-PyTFP в ацетонитриле (около 37 МБк) в течение 35 минут при комнатной температуре. После инкубации реакционную смесь разбавляли водой (200 мкл) и очищали центрифугированием (5 мин, 13,853 XNUMX мкл).g). Полученный осадок затем трижды промывали водой перед измерением в калибраторе дозы (CPCRC-25R, Capintec). Радиохимический выход рассчитывали как отношение количества радиоактивности, присутствующей в наноботах после промывки, к исходному количеству радиоактивности. Радиохимическая чистота после очистки составляла ≥99%, что определялось методом радиотонкослойной хроматографии (радиоТСХ) с использованием хроматографической бумаги iTLC-SG (Agilent Technologies) и дихлорметана и метанола (2:1) в качестве неподвижной и подвижной фаз соответственно. Пластины ТСХ анализировали с использованием ТСХ-ридера (MiniGITA, Raytest).
Стабильность 18F-наноботы
Стабильность 18F-меченные наноботы определяли с использованием следующих сред: (1) 300 мМ мочевины, (2) воды и (3) мочи животных с опухолями. 18Наноботы, меченные F (10 мкл), инкубировали с соответствующим раствором (100 мкл) в течение 1 часа при комнатной температуре. Затем наноботы и супернатант разделяли центрифугированием и собирали, а радиоактивность измеряли в дозировочном калибраторе (CPCRC-25R).
Радиомечение наноботов с помощью 131I
Радиойодирование уреазных наноботов осуществляли путем инкубации наноботов с инъецируемой [131Раствор I]NaI (925 МБк мл-1; GE HealthCare). Короче говоря, 400 мкл раствора нанобота уреазы (1 мг мл-1) центрифугировали (13,853 XNUMXg, 5 мин), ресуспендировали в 100 мкл PBS (10 мМ, pH 7.4) и инкубировали с 25 мкл или 185 мкл инъекционного препарата [131I]NaI (около 42.55 или 277.5 МБк соответственно) в течение 30 мин, в зависимости от желаемой конечной активности. После инкубации реакционную смесь очищали центрифугированием (13,853g, 5 мин). Полученный осадок трижды промывали водой (100 мкл). Радиоактивность в супернатанте и осадке определяли с использованием калибратора дозы (CPCRC-25R), и обе фракции анализировали методом радио-ТСХ, как и для 18F-наноботы.
Разработка моделей животных
Мышей содержали и обращались с ними в соответствии с Директивой Европейского Совета 2010/63/UE и внутренними инструкциями. Все экспериментальные процедуры были одобрены комитетом по этике CIC biomaGUNE и местными властями (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Анализ изображений (как ПЭТ, так и МРТ) не учитывал групповое распределение животных.
Ортотопическую мышиную модель рака мочевого пузыря создавали путем внутрипузырного введения клеток MB49 (линия клеток мышиной карциномы мочевого пузыря) самкам мышей C57BL/6JRj (8 недель, Janvier). Для экспериментов, направленных на определение накопления опухоли (четыре группы; подробности ниже), по шесть животных инокулировали на группу, как определялось с помощью прецизионного анализа, со следующими допущениями: требуемая точность - 20%; ожидаемое стандартное отклонение, ±20%; уверенность – 95%; потери животных, 20%. Для экспериментов по терапевтической эффективности (шесть групп; подробности ниже) в каждую группу включали по десять животных, согласно расчетам с использованием одностороннего критерия Стьюдента. t-тест, разница между двумя независимыми средними значениями, со следующими допущениями: нулевая гипотеза, лечение не влияет на рост опухоли; α, 0.05; 1 - β, 0.95; стандартное отклонение, ±50%; ожидаемые различия между группами – 50%; потери животных, 20%. Поскольку по оперативным соображениям эксперимент проводился в двух партиях, в обе партии была включена одна контрольная группа (табл. 2), а затем всех животных объединили. Для создания опухоли мышей анестезировали ингаляцией 3% изофлурана в чистом O.2 и поддерживается 1.0–1.5% изофлюраном в 100% O.2. Затем мочевой пузырь опорожняли и вызывали химические повреждения уротелия путем внутрипузырной инстилляции 50 мкл поли-l-лизин (Sigma-Aldrich) через катетер 24 калибра в течение 15 минут. Впоследствии мочевой пузырь снова опорожнялся и клетки MB49 (105 клетки) в DMEM с высоким содержанием глюкозы (100 мкл) закапывали в течение 1 часа перед удалением катетера и опорожнением мочевого пузыря посредством массажа живота. На протяжении всего эксперимента за мышами наблюдали и взвешивали для контроля за их здоровьем и благополучием. Конечная точка для человека применялась, если потеря веса превышала 20% или на основании клинических симптомов в соответствии с критериями ответственного ветеринара.
Отслеживание размера опухоли
МРТ-исследования проводились через 7 и 14 дней после индукции опухоли с использованием 7-Т сканера Bruker BioSpec USR 70/30 (Bruker BioSpin), оснащенного градиентной вставкой BGA-12S 440 мТл.-1 и резонатор QSN 112/086 (T12053V3) для радиочастот.14 передачи и катушка на поверхности мозга крысы (T11205V3) для приема радиочастот (обе работают на частоте 300 МГц). Животных анестезировали изофлураном (4% для индукции и 1.5% для поддержания в среде с 50% O).2/50% Н2 смесь) и поместили на MR-совместимую подставку. Температуру тела и частоту дыхания постоянно контролировали с помощью MR-совместимого устройства мониторинга (модель 1030 SA, Small Animal Instruments), подключенного к системе нагревателя воздуха для мелких грызунов для поддержания температуры тела. После получения эталонных изображений для изображения опухолей использовалась последовательность диффузионно-взвешенных изображений на основе спин-эха с использованием следующих параметров: время эхо (TE) = 22.3 мс, время повторения (TR) = 2,500 мс, n = 2 средних значения, одно изображение А0 (базальное изображение с b = 0 с мм-2) и одно изображение ДГ, полученное с использованием диффузионных градиентов в направлении (1, 0, 0) с длительностью градиента δ = 4.5 мс и градиентное разделение Δ = 10.6 мс, что дает b = 650 с мм-2, 16 × 16 мм2 поле зрения, размер матрицы изображения 160×160 точек, 20 последовательных срезов толщиной 0.5 мм (без зазора, получено в чередующемся режиме) и полоса пропускания 192.9 Гц на пиксель. Для визуализации опухолей изображения подвергались постобработке с помощью программного обеспечения ImageJ, разделяя изображения, полученные с помощью диффузионного градиента (b = 650 с мм-2) приобретенными без (b = 0 с мм-2) и применив 3D-фильтр Гаусса (σx = σy = σz = 0.7) к результату. Опухоли были очерчены вручную для определения их объема.
Биораспределение in vivo
На 15-й день после индукции опухоли мышей рандомизировали на четыре группы для получения однородного среднего распределения объема опухоли между группами. Сканирование ПЭТ-КТ (сканеры MOLECUBES β и X-CUBE) было получено через 3 часа после внутрипузырного введения 100 мкл 18F-BSA (группы 1 и 2) или 18F-уреаза (группы 3 и 4) наноботы в концентрации 200 мкг мл-1, используя в качестве носителя либо воду (группы 1 и 3), либо 300 мМ мочевины в воде (группы 2 и 4) (таблица 1). Для получения изображений животных вводили в анестезию (5% изофлюран в чистом кислороде) и помещали в положение лежа на спине перед массированием брюшной области для опорожнения мочевого пузыря. Сразу после этого соответствующее 18Наноботы с F-маркировкой (18Ф-БСА/18F-уреаза в воде/мочевине) вводили в мочевой пузырь через катетер диаметром 24 калибра и инкубировали в течение 1 часа, затем удаляли катетер, опорожняли мочевой пузырь и оставляли мышей для восстановления после анестезии. В t Через 3 часа после введения животных повторно анестезировали и получали 10-минутные статические ПЭТ-изображения всего тела с последующим сканированием КТ. ПЭТ-изображения были реконструированы с использованием алгоритма реконструкции трехмерного упорядоченного подмножества с коррекцией случайных чисел, разброса и затухания. Изображения ПЭТ-КТ одной и той же мыши были зарегистрированы и проанализированы с использованием инструмента обработки изображений PMOD. Графики зависимости концентрации радиоактивности от времени были получены путем создания интересующего объема в верхней части мочевого пузыря с использованием инструмента 3D-контура и измерения активности (с поправкой на распад) в килобеккерелях на орган. Результаты были скорректированы путем применения калибровочного коэффициента, а затем нормализованы по объему опухоли, полученному с помощью МРТ.
Исследования ex vivo
Гистопатологические анализы
После завершения всех изображений выбранные мочевые пузыри (n = 3 на группу) от опухоленосителей и здоровых животных извлекали в асептических условиях и немедленно фиксировали в 4% формальдегиде. Затем мочевые пузыри заливали в парафин, а затем делали срезы толщиной 2–3 мкм для окрашивания гематоксилин-эозином. Репрезентативные изображения были получены во всех условиях гистопатологического исследования.
ИСП-МС анализ
Измерения проводились на приборе Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) в сочетании с автосамплером ASX-560 (CETAC Tech). После завершения всех визуализаций животных умерщвляли и отбирали мочевые пузыри (n = 2 на группу; четыре группы), собранные и переваренные в 1 мл HNO.3:HCl (смесь 4:1). Дисперсию кипятили до полного растворения органов. Затем раствор охлаждали до комнатной температуры и анализировали с помощью ICP-MS для определения концентрации Au в каждом образце, преобразуя результаты в процентное содержание введенной дозы на грамм ткани (%ID г-1).
Иммуногистохимия и конфокальная микроскопия
Для иммуногистохимического анализа животные с опухолями получали наноботы, меченные FITC, в воде или 300 мМ мочевины (n = 4 на группу), как описано выше, для исследований ПЭТ-КТ. Кроме того, животные с опухолями без наноботов служили контрольной группой (n = 2). Во всех случаях пузыри собирали, замораживали и разрезали на срезы толщиной 10 мкм, которые немедленно фиксировали в 10% формальдегиде в течение 15 минут, промывали 10 мМ PBS и затем инкубировали в 50 мМ NH.4Cl в PBS в течение 5 мин, а затем снова промыть PBS. Пермеабилизацию проводили с помощью смеси метанол:ацетон (1:1) в течение 5 минут при комнатной температуре и 0.1% тритона в PBS в течение 5 минут. После промывки PBS образцы насыщали раствором 5% BSA–0.5% Tween в PBS в течение 15 минут при комнатной температуре и инкубировали в течение 1 часа при комнатной температуре с мышиным анти-FITC (1:100, Abcam) в 5% BSA. –0.5% Твин. Срезы трижды промывали 10 мМ PBS в течение 5 минут и инкубировали в течение 30 минут при комнатной температуре со вторичным антителом Alex Fluor 647 осла против мышиного IgG (Molecular Probes, Life Technologies, 1:1,000) в 5% BSA–0.5% Tween. в PBS, снова промывали в PBS (3 ×5 мин) и монтировали с помощью набора против выцветания ProLong с 4,6-диамидино-2-фенилиндолом (DAPI; Molecular Probes, Life Technologies). Изображения были получены с помощью конфокального микроскопа Leica STELLARIS 5 (Научный парк УПВ/ЕГУ) с одинаковыми настройками для всех срезов: увеличение ×10 с отображением плиток и сшивкой (обычно поле зрения 4 × 5). Лазерная линия и окна обнаружения составляли 405 нм и 440–503 нм для DAPI, 489 нм и 494–602 нм для белого лазера FITC и 653 нм и 660–836 нм для белого лазера Alexa647.
Оптическая очистка
После перфузии 4% параформальдегидом и PBS образцы мочевого пузыря извлекали и дополнительно фиксировали в 4% параформальдегиде в течение ночи при 4°C, затем помещали в шприц емкостью 5 мл с 0.8% агарозой с низкой температурой плавления, чтобы сформировать цилиндрический блок и облегчить процесс перфузии. монтаж в кварцевой кювете. Весь блок постепенно обезвоживался с использованием метанола: H.2O при 4 °C (30%:70% в течение 1 ч, 50%:50% в течение 1 ч, 70%:30% в течение 1 ч, 100%:0% в течение 1 ч, затем 100% метанол в течение ночи и еще раз в течение 4 h) и, наконец, погружают в бензиловый спирт-бензилбензоат (BABB) в качестве раствора для согласования показателей преломления для визуализации. Для сравнения in vitro зеленых наноботов FITC с коммерческими красными частицами мы использовали наночастицы красного флуоресцентного кремнезема DiagNano (Creative Diagnostics) диаметром 1 мкм, устойчивые к очистке BABB.
Автофлуоресценция и поляризованная SLS-визуализация
Визуализация светового листа была выполнена с помощью MacroSPIM, специальной системы для четкой визуализации всего органа, разработанной в IRB Barcelona.44,45. Короче говоря, образцы помещают в блок агарозы, очищают вместе с образцом и визуализируют внутри кварцевой кюветы. Для визуализации автофлуоресценции использовались лазеры с длиной волны 488, 561 или 638 нм, обеспечивающие освещение через ахроматическую дублетную цилиндрическую линзу диаметром 50 мм (ACY254-050-A, Thorlabs). Чтобы уменьшить полосовые артефакты, световой лист поворачивается с помощью резонансного сканера SC-10 (EOPC) вдоль телескопа 4f с ахроматическими дублетными линзами G322288322 100 мм (QI Optic Photonics). Автофлуоресценцию тканей собирают с помощью полосовых или длиннопроходных флуоресцентных фильтров и записывают с помощью камеры ORCA Flash v2 (Hamamatsu Photonics). Визуализация выполнялась с увеличением ×9.6 с увеличением ×8, объективом ×2 и трубчатым объективом ×0.6. Световой лист был сплющен по полю зрения, что обеспечивало осевое разрешение 5–6 мкм. 3D-изображение выполнялось с шагом 2.5 мкм. Визуализация всего мочевого пузыря выполнялась через 2 × 3 или 3 × 4. XY плитки, в зависимости от размера органа.
Визуализация sLS была достигнута путем удаления флуоресцентного фильтра или использования любого фильтра, пропускающего лазер. Поворот светового листа снижает лазерный спекл-шум, что приводит к временному усреднению когерентности лазера, как показано ранее.52. Ориентацию линейной поляризации светового листа при освещении контролировали путем вращения полуволновой пластинки (AHWP05M-600, Thorlabs) перед поворотным сканером. Детектируемый сигнал отбирался по поляризации с использованием вращающегося линейного поляризатора (LPVISC100, Thorlabs) перед обнаружением колеса фильтров, что приводило к потере интенсивности более 50% при обнаружении флуоресценции. Хотя распределение сигнала SLS в целом меняется в зависимости от ориентации поляризатора, на сигнал автофлуоресценции ткани вращение поляризатора не влияет. sLS дает пространственное разрешение 2.4 ± 0.3 мкм в BABB, что сравнимо с разрешением при визуализации флуоресцентного светового листа (подтверждено путем подгонки функции Гаусса к XY изображение отклика одной частицы, дополнительный рис. 8л–м) и близко к теоретическому разрешению в воздухе (1.53 мкм с числовой апертурой (NA) = 0.2 при максимальном макрозуме ×8).
Обработка изображений и 3D-анализ
Обработка изображений, сегментация и анализ наборов данных световых листов выполнялись с помощью ImageJ/Fiji, а на рис. 3 и 4 были созданы с помощью Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) и дополнительное видео 3 был создан с помощью Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Плиточные наборы данных световых листов были сшиты с помощью MosaicExplorerJ.53. Трехмерная сегментация ткани мочевого пузыря выполнялась с использованием пользовательских макросов ImageJ/Fiji для полуавтоматической трехмерной аннотации больших объемов в виртуальном режиме. Вкратце, первый скрипт «Макрос3» загружает стеки 3D-изображений, позволяет пользователю аннотировать ROI в нескольких плоскостях и автоматически интерполирует ROI для создания и экспорта 1D-масок. ОИ были нарисованы через каждые 3 плоскостей (каждые 3 мкм), чтобы обеспечить хорошую непрерывность сегментации, сводя при этом количество аннотаций к разумному минимуму. Второй скрипт, «Макро15», выполняет математические или логические операции плоскость за плоскостью, не загружая все стеки в память, либо между 37.5D-масками, либо между 2D-маской и исходными данными, сохраняя результат как новый стек. Все маски были созданы путем аннотирования изображений автофлуоресценции.
Поверхностные слои как опухоли, так и здоровой ткани (рис. 3) были очерчены с помощью палочки Фиджи и инструментов-лассо на полости мочевого пузыря в маске. Вызвав эту первую итерацию BC1, последующие запуски Macro1 автоматически расширяют этот 3D-контур на определенное количество пикселей, чтобы получить новые итерации маски, BC2, BC3 и так далее, с увеличивающимся расширением. Первый слой, содержащий как опухоль, так и здоровую ткань, маска L1, получается путем вычитания маски BC1 из BC2 и т. д., в результате чего L2 и L3 представляют собой концентрические слои. Объем опухоли, ближайший к полости, был получен путем аннотирования опухоли с помощью инструментов палочки и лассо для создания маски T1, в то время как трехмерный слой здорового уротелия был обнаружен отдельно в маске U3. Вычитание U1 из L1 дает поверхностный слой опухоли и так далее: L1 - U2, L1 - U3. И наоборот, первый слой уротелия получается путем вычитания T1 из L1. Все слои на рис. 3 были определены как имеющие толщину 33 мкм.
Тот же набор макросов и процедур (инструмент ImageJ, цифровая эрозия 500 мкм и т. д.) использовался для очерчивания и сегментирования внутренней части ткани мочевого пузыря, а затем оценки объема внутренней ткани мочевого пузыря (рис. 4, подробности см. выше). Гистограммы интенсивности рассеянного сигнала были созданы на Фиджи путем объединения рассеянного сигнала и маски.
РНТ с использованием 131Я-наноботы
Между 8 и 15 днями после имплантации опухоли животных разделили на шесть групп (группы 1–6), стремясь добиться одинакового среднего объема опухоли в группах (таблица 2). Для проведения экспериментов животных вводили в анестезию (5% изофлюран в чистом OXNUMX).2) и положить на спину перед опорожнением мочевого пузыря, массируя область живота. Сразу после этого 100 мкл соответствующего препарата в концентрации 400 мкг мл.-1 (Таблица 2) вводили в мочевой пузырь с помощью катетера 24 калибра. Лечение и носитель (вода или мочевина) оставались в мочевом пузыре в течение 1 часа перед удалением катетера. Мочевой пузырь снова опорожняли с помощью массажа живота, и мыши выходили из анестезии в своих клетках, заменяя опилки клеток животных через 24 часа после обработки для удаления радиоактивного загрязнения.
Терапевтическая эффективность, определенная с помощью МРТ
На каждой мыши проводили два исследования МРТ: (1) между 7 и 14 днями после инокуляции опухоли для рандомизации животных по группам и измерения начальных (до лечения) объемов опухоли; (2) между 16 и 21 днями после инокуляции опухоли (после лечения) для оценки терапевтической эффективности. МРТ проводилась с использованием сканеров Bruker BioSpec 7 T и Bruker BioSpec 11.7T (оба с программным обеспечением ParaVision 7), в зависимости от доступности. Это не повлияло на результаты, поскольку внешнее поле не имеет решающего значения для анатомической визуализации.14. Эксперименты по визуализации проводились с использованием тех же параметров визуализации и обработки, которые описаны выше (Отслеживание размера опухоли). В случае сканера 11.7 Тл установка состояла из поверхностной катушки сердца мыши для приема и объемной катушки для передачи. Объемы опухолей в каждом срезе определяли на основе представляющих интерес объемов, нарисованных вручную и покрывающих область опухоли.
статистический анализ
В исследованиях ПЭТ-визуализации процент введенной дозы (% ID) и введенной дозы на объем опухоли (% ID см-3) сравнивались с использованием однофакторного дисперсионного анализа. Различия между группами определяли с помощью теста множественных сравнений Тьюки. НТВ в разделе РНТ получено от t-тест непарных значений. Распределение данных предполагалось нормальным, но формально это не проверялось. Статистический анализ проводился с помощью GraphPad Prism v.8.
Отчетная сводка
Дополнительная информация о дизайне исследований доступна в Резюме отчета по портфелю природы ссылка на эту статью
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://www.nature.com/articles/s41565-023-01577-y
- :является
- :нет
- ][п
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- О нас
- выше
- соответствие
- накопление
- Достигать
- достигнутый
- приобретенный
- приобретение
- приобретение
- через
- активированный
- активный
- деятельность
- добавленный
- добавить
- Дополнительно
- администрация
- влиять на
- После
- потом
- снова
- Нацеленный
- AIR
- AL
- Alex
- алгоритм
- Все
- разрешено
- вдоль
- Альцгеймера
- среди
- количество
- амилоид
- an
- анализирует
- анализ
- Ведущий
- и
- животное
- животные
- антитело
- любой
- Приложения
- прикладной
- Применение
- соответствующий
- утвержденный
- вода
- МЫ
- ПЛОЩАДЬ
- гайд
- AS
- предполагается,
- предположения
- At
- Власти
- автоматически
- свободных мест
- доступен
- в среднем
- усреднение
- b
- Бабб
- Пропускная способность
- основа
- BE
- до
- поведение
- не являетесь
- ниже
- между
- Заблокировать
- тело
- вареный
- изоферменты печени
- Мозг
- бремя
- но
- by
- садки
- рассчитанный
- вызова
- камера
- рак
- случаев
- случаев
- CCD
- ячейка
- Клетки
- изменения
- заряд
- химический
- Очистка
- нажмите на
- Клинический
- Закрыть
- катушка
- сочетание
- комбинируя
- коммерческая
- комитет
- сравнимый
- сравненный
- сравнения
- полностью
- комплектующие
- концентрации
- состояние
- Условия
- проводятся
- доверие
- ПОДТВЕРЖДЕНО
- последовательный
- непрерывность
- непрерывно
- контроль
- контроль
- наоборот
- Холодные
- исправленный
- исправления
- соответствующий
- Совет
- соединенный
- покрытие
- Создайте
- создали
- Создающий
- творческий
- Критерии
- критической
- Компьютерная томография
- изготовленный на заказ
- Порез
- темно
- данным
- Наборы данных
- день
- Дней
- de
- определенный
- доставки
- в зависимости
- описано
- Проект
- желанный
- подробнее
- обнаруженный
- обнаружение
- Определять
- определены
- определения
- развитый
- устройство
- диагностика
- DID
- разница
- Различия
- различный
- Вещание
- Интернет
- разбавленный
- направление
- Болезнь
- блюдо
- Дисперсия
- распределение
- распределения
- Разделенный
- do
- приносит
- сделанный
- дозировать
- обращается
- Падение
- продолжительность
- динамический
- динамика
- e
- Е & Т
- каждый
- легко
- эхо
- эффективность
- или
- встроенный
- включить
- позволяет
- Конечная точка
- расширение
- Весь
- ферментативный
- оборудованный
- установленный
- создание
- оценка
- Эфир (ETH)
- этика
- Европейская кухня
- оценивать
- Каждая
- экспертиза
- Превышен
- Кроме
- ожидание
- ожидаемый
- эксперимент
- экспериментальный
- Эксперименты
- объяснены
- экспорт
- и, что лучший способ
- содействовал
- фактор
- женский пол
- поле
- Фига
- фигура
- заполненный
- фильтр
- фильтры
- окончательный
- в заключение
- Во-первых,
- примерка
- фиксированной
- Flash
- следует
- после
- Что касается
- форма
- формальдегид
- Формально
- вперед
- 4
- от
- замороженные
- функция
- далее
- разрыв
- ge
- GE Healthcare
- Общие
- порождать
- генерируется
- Отдаете
- хорошо
- градиенты
- Грамм
- Зелёная
- группы
- Группы
- Рост
- методические рекомендации
- Есть
- he
- Медицина
- здравоохранение
- здоровый
- Сердце
- HTTPS
- Хуан
- человек
- ICAP
- ID
- идентичный
- if
- изображение
- анализ изображения
- изображений
- Изображениями
- немедленно
- погруженный
- улучшается
- in
- включены
- включения
- повышение
- инкубационных
- Инкубация
- ИНКУБАЦИЯ
- независимые
- индекс
- индукционный
- информация
- начальный
- внутренний
- внутри
- инструменты
- интегрированный
- интерактивный
- интерес
- в нашей внутренней среде,
- в
- введение
- итерация
- итерации
- ЕГО
- KDA
- хранение
- комплект
- l2
- большой
- лазер
- лазеры
- слой
- слоев
- уход
- оставил
- объектив
- линзы
- ЖИЗНЬЮ
- легкий
- линия
- LINK
- связанный
- погрузка
- грузы
- локальным
- от
- Макрос
- Макрос
- поддерживать
- техническое обслуживание
- вручную
- маска
- Маски
- согласование
- материала
- материалы
- математический
- матрица
- максимальный
- означает
- проводить измерение
- измеренный
- размеры
- измерение
- Медиа
- Память
- меринос
- метанол
- методы
- мышей
- Микроскоп
- Микроскопия
- мин
- минимальный
- небольшая
- смешанный
- смесь
- ML
- Мобильный телефон
- режим
- модель
- Модели
- модифицировало
- модуль
- молекулярный
- контролируемый
- Мониторинг
- движение
- мышь
- МРТ
- MS
- MT
- с разными
- нанотехнологии
- природа
- сетей
- Нейтральные
- Новые
- нет
- Шум
- "обычные"
- цель
- наблюдается
- получать
- полученный
- of
- Старый
- on
- ONE
- операционный
- оперативный
- Операционный отдел
- оптимизированный
- or
- Orca
- оригинал
- за
- всю ночь
- Oxford
- Oxygen
- бумага & картон
- параметры
- Парк
- часть
- частица
- PBS
- Колышек
- проникновение
- для
- выполнены
- выполняет
- домашнее животное
- Петри
- фаз
- Стержень
- Pixel
- размещенный
- самолет
- Planes
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- Точка
- пунктов
- «портфель»
- должность
- расположены
- Точность
- (например,
- представить
- предварительно
- процедуры
- Процедуры
- обработка
- постепенно
- протокол
- Qi
- количественный
- Радио
- случайный
- Рандомизированное
- RAT
- Обменный курс
- соотношение
- реагировать
- реакция
- читатель
- разумный
- причины
- получила
- прием
- записанный
- Recover
- Red
- уменьшить
- Цена снижена
- снижает
- ссылка
- область
- остались
- остатки
- удаление
- удален
- удаление
- Сообщается
- Reporting
- представитель
- обязательный
- исследованиям
- стойкий
- Постановления
- соответственно
- ответ
- результат
- в результате
- Итоги
- робот
- Комната
- работает
- s
- SA
- то же
- экономия
- сканирует
- рассеянный
- SCI
- научный
- скрипт
- Во-вторых
- вторичный
- Раздел
- разделах
- посмотреть
- сегмент
- сегментация
- выбранный
- Последовательность
- служил
- настройки
- несколько
- лист
- показанный
- сигнал
- Распределение сигнала
- аналогичный
- с
- одинарной
- ШЕСТЬ
- Размер
- Ломтик
- небольшой
- So
- натрий
- Software
- Решение
- Решения
- пространственный
- Стабильность
- стек
- Стеки
- статистический
- Stellaris
- Шаги
- хранить
- полоса
- "Студент"
- исследования
- последующее
- впоследствии
- suite
- Поверхность
- симптомы
- синтез
- система
- T
- T1
- ТАБЛИЦЫ
- с
- технологии
- технологии
- телескоп
- шаблон
- 10
- тестXNUMX
- проверенный
- который
- Ассоциация
- их
- Их
- тогда
- теоретический
- Терапевтический
- терапия
- этой
- тщательно
- те
- три
- трехмерный
- Через
- по всему
- время
- раз
- туалетная бумага
- в
- вместе
- инструментом
- инструменты
- Всего
- к
- к
- превращение
- лечение
- Тритон
- пытается
- опухоли
- два
- напишите
- типично
- незатронутый
- под
- до
- на
- используемый
- Информация о пользователе
- через
- Наши ценности
- автомобиль
- Против
- с помощью
- Видео
- Видео
- Вид
- Виртуальный
- визуализации
- естественных условиях
- объем
- тома
- объемный
- ходунки
- палочка
- законопроект
- мойка
- Вода
- we
- Недели
- вес
- Благосостояние
- были
- Колесо
- , которые
- в то время как
- белый
- окна
- в
- без
- X
- Уступать
- уступая
- доходность
- зефирнет
- зум