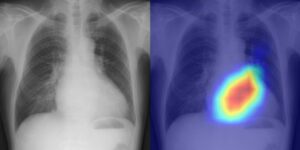
Лечение рака радиацией может стимулировать иммунный ответ организма и подавлять рост опухоли, но оно также может снизить уровень лимфоцитов, лейкоцитов, связанных с иммунным ответом, что приводит к нарушению контроля над опухолью и плохому прогнозу. Тяжесть радиационной лимфопении коррелирует с дозой, поступившей на циркулирующие клетки крови и лимфоциты. Таким образом, минимизация дозы на сердце, периферическую кровь и лимфоидные органы может помочь уменьшить этот вредный эффект.
Для дальнейшего исследования этой теории Антье Галтс и Абдельхалек Хамми из Технического университета Дортмунда исследовали, может ли FLASH-радиотерапия – облучение сверхвысокими мощностями дозы – снизить уровень истощения иммунных клеток во время протонной терапии пациентов с раком головного мозга.
«Биологический механизм наблюдаемого эффекта сохранения FLASH при высоких мощностях дозы еще не до конца понятен. Однако одной из предложенных теорий является иммунная гипотеза, которая предполагает, что мгновенная доставка дозы FLASH-облучения значительно снижает истощение циркулирующих лимфоцитов за счет минимизации времени воздействия», — объясняет Хамми. «В нашем исследовании мы показали, что гипофракционированное лечение и быстрая доставка дозы сберегают иммунные клетки до 27 раз по сравнению с традиционным планом лечения фракционированным протонным карандашным лучом».
Галтс и Хамми использовали дозиметрическая модель кровотока для моделирования дозы на циркулирующие лимфоциты во время традиционной и FLASH-протонной терапии с модуляцией интенсивности (IMPT) опухоли головного мозга. Модель динамической доставки луча имитирует план фракционированного лечения IMPT, принимая во внимание пространственно-временные изменения мощности дозы каждого отдельного протонного карандашного луча. Хамми отмечает, что модель включает реалистичные параметры доставки из коммерчески доступных циклотронов.
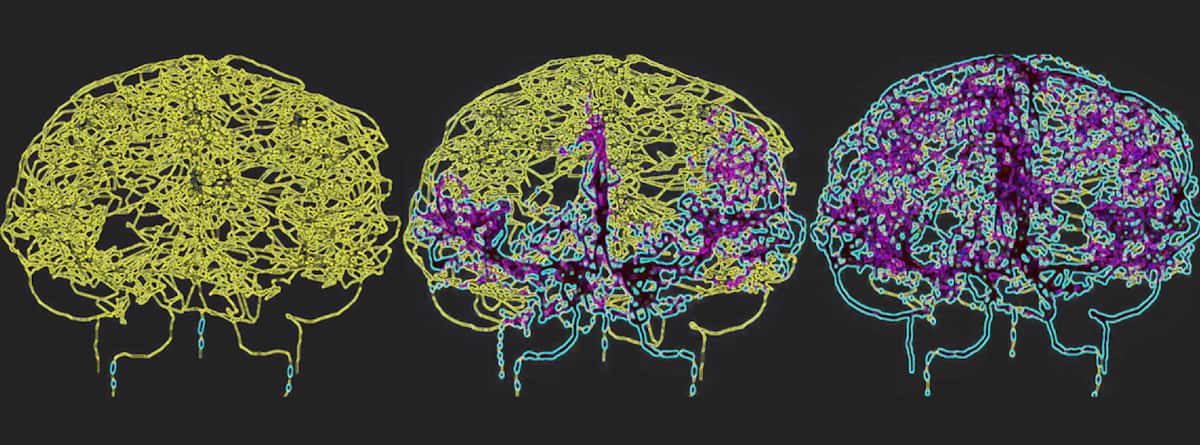
Чтобы точно отразить кровообращение в человеческом мозге, Галтс и Хамми нанесли на карту кровеносные сосуды непосредственно по изображениям МР-ангиографии головного мозга. Они использовали полученную цереброваскулярную модель, которая включала 465 кровеносных сосудов и 8841 отдельную ветвь сосуда, для моделирования циркуляции иммунных клеток в кровотоке.
Исследователи создали реалистичные планы лечения IMPT для опухоли глиобластомы, используя четыре падающих протонных пучка и клинически значимые параметры доставки. Затем они рассчитали изменяющиеся во времени поля радиации, которым подвергается циркулирующая кровь во время реализации планов протонной терапии, и накопленную дозу после лечения, сообщив о своих результатах в Физика в медицине и биологии.
Глиобластома является наиболее летальной формой рака головного мозга, и ее лечение лучевой терапией может вызвать длительную радиационно-индуцированную лимфопению. «Моделируя цереброваскулярную систему во время проведения лучевой терапии, мы надеемся получить более глубокое понимание того, как лучевая терапия влияет на иммунный ответ в этих группах пациентов, что потенциально приведет к улучшению терапевтических стратегий», — говорит Хамми.
Сравнение планов
Галтс и Хамми рассмотрели четыре сценария лечения: IMPT FLASH с одной фракцией 22.3 Гр; гипофракционированная FLASH с использованием двух фракций по 14.6 Гр и пяти фракций по 8 Гр; и традиционный IMPT с использованием тридцати двух фракций по 2 Гр. Для каждого плана лечения они оценивали дозиметрическое воздействие на циркулирующие лимфоциты и результирующую радиотоксичность.
Гистограммы «доза-объем» показали, что лучевая терапия FLASH значительно снижает долю облученных клеток по сравнению с IMPT с обычной мощностью дозы. Во время первой фракции лечения все три схемы FLASH облучали около 1.52% объема циркулирующей крови, тогда как обычная IMPT облучала 2.18%. Гипофракционированные планы FLASH, состоящие из двух или пяти фракций, увеличили этот облученный объем до 3.01% и 7.35% соответственно, в то время как обычный IMPT подвергал облучению 42.41% периферической крови.
Затем исследователи исследовали уровень циркулирующих лимфоцитов, получивших дозу не менее 7 сГр – порог, вызывающий 2%-ное истощение популяции лимфоцитов – в течение всего лечения. После завершения традиционной ИМФТ 25.65% циркулирующих лимфоцитов получили дозу не менее 7 сГр. Для одно-, двух- и пятифракционной FLASH-обработки объемы, получившие дозу, превышающую этот порог, составили 1.21%, 2.30% и 5.14% соответственно.
Объемы циркулирующих лимфоцитов, получивших дозы более 100 сГр, вызывающие 30%-ное истощение, составили 0.77%, 1.28% и 2.09% при одно-, двух- и пятифракционной FLASH соответственно и 0.10% при обычной ИМФТ.
Галтс и Хамми также изучили реакцию CD4+ и CD8+ лимфоцитов, которые имеют различное распределение в периферической крови, на различные сценарии облучения. Для обоих типов лимфоцитов гибель клеток после первой фракции составила 0.66%, 0.62%, 0.32% и 0.08% для одно-, двух- и пятифракционной FLASH и обычного IMPT соответственно.
Компьютерная модель определяет дозу в крови во время лучевой терапии
После полного лечения истощение лимфоцитов составило 1.02% и 1.56% для фракций с двумя и пятью курсами лечения соответственно и 2.14% для обычной ИМФТ. Эти результаты показывают, что протонная терапия FLASH сохраняет циркулирующие иммунные клетки во время внутричерепного лечения, при этом однофракционная FLASH снижает скорость истощения почти на 70% по сравнению с традиционным IMPT.
Хамми рассказывает Мир физики что теперь они расширяют модель, включив в нее рак головы и шеи. «Кроме того, мы изучаем различные методы доставки FLASH и их влияние на истощение иммунной системы, уделяя особое внимание конформному лечению FLASH, основанному на пассивной, индивидуальной для пациента модуляции энергии», — объясняет он. «Эта модель доставки потенциально может сэкономить больше циркулирующих лимфоцитов по сравнению со сквозной FLASH-доставкой».
- SEO-контент и PR-распределение. Получите усиление сегодня.
- PlatoData.Network Вертикальный генеративный ИИ. Расширьте возможности себя. Доступ здесь.
- ПлатонАйСтрим. Интеллект Web3. Расширение знаний. Доступ здесь.
- ПлатонЭСГ. Углерод, чистые технологии, Энергия, Окружающая среда, Солнечная, Управление отходами. Доступ здесь.
- ПлатонЗдоровье. Биотехнологии и клинические исследования. Доступ здесь.
- Источник: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :имеет
- :является
- :нет
- $UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- накопленный
- точно
- После
- Все
- почти
- причислены
- an
- и
- МЫ
- около
- AS
- оценивается
- связанный
- At
- доступен
- основанный
- Ширина
- за
- кровь
- кровеносный сосуд
- изоферменты печени
- Мозг
- рак мозга
- ветви
- но
- by
- рассчитанный
- CAN
- рак
- больных раком
- рака
- Вызывать
- Причины
- ячейка
- Клетки
- оборотный
- Обращение
- нажмите на
- клинически
- в промышленных масштабах
- сравненный
- комплектующие
- принимая во внимание
- контроль
- обычный
- может
- создали
- более глубокий
- поставляется
- поставка
- Способы доставки
- демонстрировать
- определяет
- вредный
- различный
- непосредственно
- распределение
- распределения
- дозировать
- дозы
- в течение
- динамический
- каждый
- эффект
- энергетика
- Весь
- равный
- Равновесие
- По оценкам,
- Эфир (ETH)
- расширяющийся
- Объясняет
- Разведанный
- Исследование
- подвергаться
- Экспозиция
- БЫСТРО
- Поля
- результаты
- First
- 5
- Flash
- поток
- Фокус
- после
- Что касается
- форма
- 4
- доля
- от
- полный
- полностью
- далее
- Gain
- Группы
- Рост
- Есть
- he
- Сердце
- помощь
- High
- надежды
- Как
- Однако
- HTTPS
- человек
- изображение
- изображений
- иммунный
- Иммунная система
- Влияние
- улучшенный
- ИМПТ
- in
- инцидент
- включают
- включены
- включает в себя
- расширились
- individual
- информация
- размышления
- в
- исследовать
- вопрос
- IT
- JPG
- убийство
- ведущий
- наименее
- оставил
- уровень
- дольше
- макс-ширина
- механизм
- медицина
- методы
- минимизация
- модель
- моделирование
- моделирование
- БОЛЕЕ
- самых
- mr
- Заметки
- сейчас
- наблюдается
- of
- on
- ONE
- открытый
- or
- наши
- внешний
- за
- параметры
- особый
- пассивный
- пациентов
- периферийный
- Физика
- Мир физики
- план
- Планы
- Платон
- Платон Интеллектуальные данные
- ПлатонДанные
- состояния потока
- население
- потенциал
- потенциально
- распространение
- доля
- предложило
- излучение
- радиотерапия
- Обменный курс
- Стоимость
- реалистичный
- получила
- получение
- уменьшить
- Цена снижена
- снижает
- снижение
- отражать
- соответствующие
- Reporting
- исследователи
- соответственно
- ответ
- в результате
- Показали
- правую
- s
- говорит
- сканирование
- Сценарии
- схемы
- строгость
- показал
- существенно
- одинарной
- Начало
- стимулировать
- стратегий
- поток
- учился
- Кабинет
- такие
- Предлагает
- система
- говорит
- чем
- который
- Ассоциация
- их
- тогда
- теория
- Терапевтический
- терапия
- Эти
- они
- этой
- три
- порог
- Через
- миниатюрами
- время
- раз
- в
- лечения
- лечение
- лечение
- правда
- опухоль
- два
- Типы
- понимать
- Университет
- используемый
- через
- различный
- Судно
- суд
- объем
- тома
- законопроект
- we
- были
- когда
- будь то
- который
- в то время как
- белый
- в
- Мир
- желтый
- еще
- зефирнет