Institutul Național de Standarde și Tehnologie din SUA (NIST) a lansat pe 8 decembrie linii directoare invitând comentarii cu privire la utilizarea lunii martie în drepturi. Jyotpreet Kaur, stagiar în SpicyIP, scrie despre aceste drepturi, despre modificările propuse în ghid și despre poziția Indiei cu privire la aranjamente similare. Această postare a fost creată cu contribuții de la Swaraj. Jyotpreet este un student la drept în anul trei de la Universitatea Națională de Drept, Delhi, care este interesat de drepturile de proprietate intelectuală și de dreptul concurenței și caută să studieze interacțiunea dintre ei. Postările ei anterioare pot fi accesate aici.

Revizuirea de către SUA a drepturilor de marș și câteva întrebări despre un omolog indian
De Jyotpreet Kaur
După cum ar ști mulți cititori, guvernul SUA, în special prin biroul Reprezentantului său comercial din SUA, a urmărit India de ani de zile după ce a fost acordată o singură licență obligatorie, supusă unui control judiciar mult. Doar în timpul COVID-19 această presiune a încetat să fie aplicată atât de flagrant (în schimb, cu o schimbare către „secretele comerciale”). Într-o întorsătură foarte interesantă a evenimentelor, se pare că SUA avansează acum către linii directoare care extind modul în care SUA își pot aplica propria versiune a licențelor obligatorii, a.k.a. Drepturile „March-in”, pe plan intern! Se pare că presiunea internă care rezultă din costurile lor tot mai mari de asistență medicală a ajuns la un punct în care există în sfârșit o reexaminare a modului în care sistemul lor de brevete afectează costurile. Pe 8 decembrie, Institutul Național de Standarde și Tehnologie (NIST) a lansat proiectul orientări invitând comentarii cu privire la utilizarea drepturilor „March-In” în promovarea obiectivului administrației Biden de a reduce prețurile medicamentelor. Potrivit NIST, guvernul SUA investește aproximativ 115 miliarde de dolari în cercetare și dezvoltare prin diferite universități, organizații non-profit și afaceri. Drepturile de marșă sunt prevederi care permit guvernului să solicite o licență pentru invențiile care decurg din această investiție, la îndeplinirea anumitor condiții. În mod remarcabil, deși „amenințarea” drepturilor March-In a mai fost adusă în discuție, acestea nu au fost efectiv exercitate în cei 44 de ani de la intrarea în vigoare a actului de guvernare. Obiectivul acestui proiect de orientări pare a fi extinderea criteriilor în baza cărora pot fi exercitate drepturile de March-in. Secretarul SUA pentru Sănătate și Servicii Umane salutat acesta ca un „instrument puternic pentru a se asigura că contribuabilul american primește o rentabilitate echitabilă a investiției lor”.
Echilibrarea inovației și interesului public: obiectivele Legii Bayh-Dole față de drepturile de marș
Actul Bayh-Dole, promulgat în 1980, a scos în prim-plan, printre altele, drepturile de „March-in” ale guvernului federal. După cum s-a menționat mai sus, drepturile de marșă sunt asemănătoare cu măsurile inerente disponibile guvernului în cazul în care cei care dezvoltă DPI din cercetarea finanțată de guvern nu au comercializat în mod adecvat proprietatea intelectuală. Atunci când își exercită această competență, guvernelor li se permite să intervină și să direcționeze utilizarea DPI sau să îl licențieze unei terțe părți. Proprietatea brevetului rămâne în sarcina institutului – este doar un drept de licență către terți care se acumulează în favoarea guvernului dacă acesta alege să-și exercite acest drept. Scopul acestui drept este de a permite guvernului să realizeze pe deplin potențialul DPI finanțat din fonduri publice în cauză dacă acesta este subutilizat de către institutul inventatorului.
Exercitarea drepturilor de marș în conformitate cu Legea Bayh-Dole este avută în vedere în conformitate cu 35 U.S.C. § 203, care impune îndeplinirea a 4 criterii statutare. Acestea sunt (i) eșecul în realizarea efectivă a inovației subiectului; (ii) necesitatea de a atenua nevoile de sănătate sau siguranță neabordate; (iii) nerespectarea cerințelor de utilizare publică a invenției; și (iv) nerespectarea obligațiilor contractuale, în special în temeiul art. 204., care impune ca produsele brevetate să fie fabricate în mod semnificativ în SUA până când nu este posibil din punct de vedere comercial.
Până în prezent, drepturile de marș nu au fost exercitate de către guvernul SUA, în ciuda petițiilor care solicită același lucru. Prima dată a fost depusă o petiție pentru exercitarea drepturilor de marș-in re CellPro unde Guvernul a refuzat exercitarea acestui drept. Această tendință a continuat până în prezent, după cum se poate vedea din opt petiții care au fost depuse în fața NIH și au fost eliminate.
Renovarea drepturilor de marș: o rețetă pentru dezastru sau o formulă de succes?
Una dintre modificările introduse prin orientări a fost clarificarea procesului informal de consultare a agenției cu contractantul înainte de exercitarea drepturilor de marș și creșterea intervalului de timp permis pe care o agenție trebuie să răspundă contractorului în urma consultării informale de la 60 de ani. zile până la 120 de zile.
În afară de aceasta, noile linii directoare introduc o metodă în trei pași care pare să clarifice procesul de invocare a drepturilor de marș (vezi imaginea). În primul rând, trebuie văzut dacă Legea Bayh-Dole se aplică invențiilor în cauză – aici se verifică dacă respectivele invenții sunt „invenții subiect” și dacă sunt finanțate de guvern. În al doilea rând, dacă vreunul dintre cele patru criterii statutare, așa cum s-a menționat mai sus, este aplicabil în cazul în cauză și, în sfârșit, dacă exercitarea dreptului de marșă este în conformitate cu spiritul general al legislației Bayh-Dole și cu obiectivele acesteia.
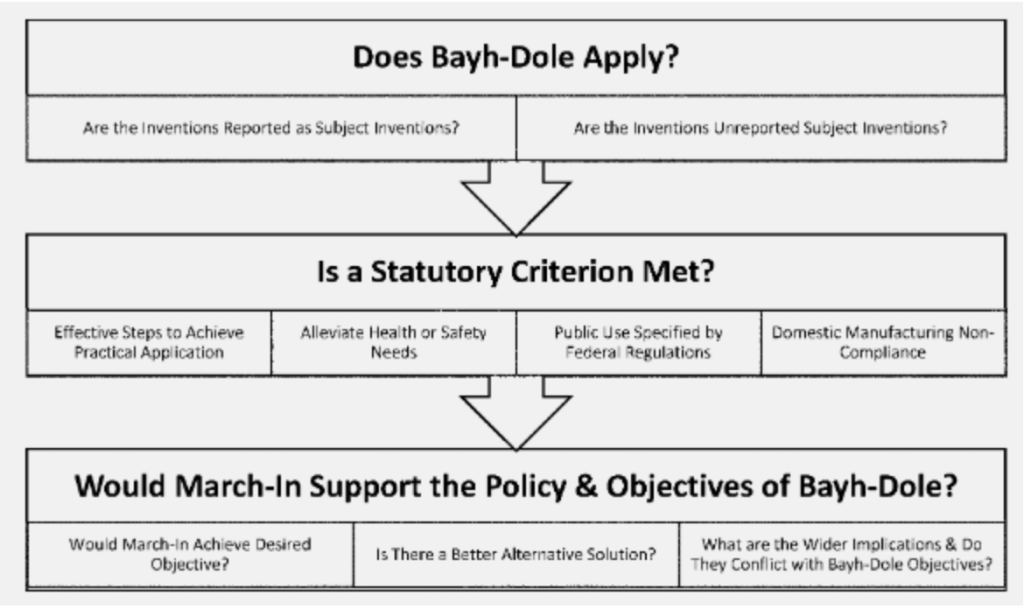
Poate cea mai importantă schimbare este văzută în a doua etapă în timp ce invocă primul criteriu statut, adică atunci când titularul brevetului nu a reușit sau nu va lua măsuri efective pentru realizarea „inovației subiectului” în domeniul său de utilizare. Orientările au adăugat o luare în considerare a factorilor care pot „limita în mod nerezonabil disponibilitatea invenției pentru public”. Aici, orientările au introdus o cerință de preț rezonabil, care anterior nu a fost recunoscută ca un criteriu pentru exercitarea drepturilor de „March-in”. Orientările presupun întrebarea dacă „antreprenorul sau licențiatul a făcut produsul disponibil doar unui număr restrâns de consumatori sau clienți din cauza prețurilor ridicate”.
Acest lucru este în contrast cu poziția anterioară a guvernului, care poate fi evidențiată din interacțiunile sale anterioare cu prețurile ridicate ca motiv pentru a exercita marșul. În 2004, petiționarul a solicitat NIH să invoce această măsură din cauza prețului ridicat al unui medicament pentru tratamentul HIV numit Norvir și un medicament pentru tratamentul glaucomului intitulat Xalatan. În 2012, îngrijorarea legată de prețul ridicat al Norvir a fost ridicat din nou în fața NIH. Din nou, în 2016, petiționarii și-au exprimat îngrijorarea cu privire la prețul ridicat al Xtandi medicament care a costat în jur de 98 USD per pilula în comparație cu alte țări cu venituri mari. Cu toate acestea, în toate aceste cazuri, NIH a refuzat să își exercite drepturile de marș-in pur și simplu pe motivul prețurilor, invocând alte motive pentru refuzul de a face acest lucru.
Acolo unde orientările vorbesc despre prețuri rezonabile, ele nu reușesc să abordeze ce poate fi un preț „rezonabil”, lăsând acest lucru la latitudinea guvernului federal.
Susținătorii salută aceste linii directoare drept măsuri progresive pentru a face medicamentele exorbitante mai accesibile publicului larg american și pentru a returna publicului ceea ce este „pe drept” al lor, deoarece cercetarea finanțată de la nivel federal este acoperită în esență folosind banii contribuabililor.
Pe de altă parte, cei care se opun orientărilor susțin că acestea sunt antitetice cu obiectivele Legii Bayh-Dole, deoarece prețurile nu au fost niciodată avute în vedere ca un motiv pentru exercitarea drepturilor de „March-in”. Camera de Comerț a SUA a numit aceste linii directoare o formă de „confiscare guvernamentală”. Alții susțin că o astfel de clauză ar inhiba inovația și concurența – care sunt obiectivele principale ale legii. Unii s-au certat că scopul Legii a fost de a încuraja colaborarea între sectorul public și cel privat în scopul introducerii de idei noi pe piață, spre deosebire de ceea ce urmăresc să atingă prezentele linii directoare – atenuarea problemelor de acces la droguri și a ineficiențelor pieței. Joseph Allen a susținut, de asemenea, că aceste orientări sunt o „pilulă otrăvitoare”, deoarece, deși vizează „big-pharma”, vor ajunge să dăuneze micilor inventatori care sunt de fapt acoperiți de Legea Bayh-Dole, deoarece majoritatea „Big-Pharma” „cercetarea nu este finanțată de guvern. În același timp, el susține că aceste orientări au fost elaborate ținând cont (doar) de prețurile mari ale medicamentelor și ignorând faptul că Bayh-Dole acoperă și alte industrii precum energia, agricultura și protecția mediului, care vor fi acum afectate de adversitățile acestor linii directoare.
Ce se întâmplă pe frontul indian?
Acum că această dezbatere este luată mai în serios în SUA, va avea acest lucru vreun efect de propagare în India? În timp ce flexibilitățile de brevet pe hârtie ale Indiei sunt destul de robuste, iar unele, cum ar fi Secțiunea 3(d) și-au făcut simțită prezența, încă nu am văzut traducerea sau practica multor alte prevederi în efecte din lumea reală. De exemplu, deși au existat discuții despre licențe obligatorii pentru alte două medicamente, nu a ieșit nimic din aceste discuții. Nu este clar cât de mult se datorează presiunii externe, de exemplu, diverse ALS și, bineînțeles, USTR; și cât de mult din aceasta se datorează posibil și altor motive. De exemplu, deși India s-a numărat printre cei în frunte când a cerut scutiri de IP în timpul pandemiei de Covid-19, în mod ironic, la nivel intern, deși guvernul a avut o numărul de opțiuni pe care le-ar fi putut lua, nu s-au luat prea multe măsuri. De exemplu, Guvernul nu a oferit claritate asupra dreptului de proprietate asupra DPI (Covaxin) și actul său de „acordare a aprobării” Institutului Haffkine a fost ceva care ar fi trebuit să fie subminat de interesul public în „dreptul la sănătate”, așa cum s-a susținut aici și aici. În mod similar, guvernul indian a refuzat să dezvăluie Datele din studiile clinice prin RTI, invocând Secțiunea 8(1)(d) și (e) care oferă drepturi de proprietate intelectuală drept motiv pentru scutirea dezvăluirii. Statul a invocat protecția DPI prin respingerea publicării datelor fără a se angaja în actul de echilibrare al punerii în balanță a acestei protecție față de interesul public în joc (care a fost prevăzut și în S. 39(3) din TRIPS). Astfel, statul nu a reușit să-și exercite propria proprietate intelectuală într-o manieră deschisă, în contrast cu poziția sa internațională.
Oricum, discuția internă a SUA despre ceva față de care au luat poziții internaționale puternice până în prezent, este o evoluție interesantă de urmat. Acasă, Departamentul de Bio-Tehnologie a lansat recent propriul set de linii directoare IP pentru invențiile care decurg din finanțarea DBT. Cum merge acest lucru și marchează începutul unei alte încercări de a resuscita proiectul eșuat de „Protecția și utilizarea proiectului de lege IP cu finanțare publică”? În același timp, Guvernul a ieșit cu Politica Națională de Cercetare și Dezvoltare și Inovare în Sectorul Pharma-MedTech (vezi proiectul de politică aici) în septembrie 2023 pentru a „transforma” sectorul farmaceutic al Indiei și a „cataliza” cercetarea și dezvoltarea în aceste sectoare într-o manieră dublă – consolidarea infrastructurii de cercetare și promovarea cercetării în sectorul farmaceutic. În special, această politică nu abordează deloc întrebările referitoare la IP. Poate că acestea sunt toate întrebările la care merită să ne gândim și despre care vom încerca să punem împreună o postare separată!
- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- PlatoData.Network Vertical Generative Ai. Împuterniciți-vă. Accesați Aici.
- PlatoAiStream. Web3 Intelligence. Cunoștințe amplificate. Accesați Aici.
- PlatoESG. carbon, CleanTech, Energie, Mediu inconjurator, Solar, Managementul deșeurilor. Accesați Aici.
- PlatoHealth. Biotehnologie și Inteligență pentru studii clinice. Accesați Aici.
- Sursa: https://spicyip.com/2024/01/the-us-review-of-march-in-rights-and-some-questions-on-an-indian-counterpart.html
- :are
- :este
- :nu
- :Unde
- $UP
- 1
- 120
- 1
- 20
- 2012
- 2016
- 2023
- 203
- 35%
- 41
- 60
- 8
- 8
- a
- Despre Noi
- mai sus
- acces
- accesate
- accesibil
- Conform
- Obține
- act
- Acțiune
- de fapt
- adăugat
- adresa
- adecvat
- care afectează
- După
- din nou
- împotriva
- agenție
- agricultură
- vizează
- înrudit
- TOATE
- atenua
- permite
- de asemenea
- Cu toate ca
- american
- printre
- între
- an
- și
- O alta
- Orice
- apare
- aplicabil
- aplicat
- se aplică
- Aplică
- aproximativ
- SUNT
- argumenta
- a susținut
- susține
- în jurul
- aranjamente
- AS
- solicitând
- At
- încercare
- Authored
- disponibilitate
- disponibil
- înapoi
- de echilibrare
- BE
- deoarece
- fost
- înainte
- Început
- fiind
- între
- biden
- Miliard
- adus
- întreprinderi
- by
- denumit
- a venit
- CAN
- caz
- cazuri
- sigur
- Cameră
- Schimbare
- Modificări
- verificat
- împrejurări
- citând
- clinic
- colaborare
- cum
- comentarii
- Comerț
- comercial
- comparație
- concurs
- Îngrijorare
- preocupările
- Condiții
- considerare
- consultare
- Consumatorii
- continuarea
- Antreprenor
- contractual
- contrast
- A costat
- Cheltuieli
- Echivalent
- țări
- Cuplu
- înscrie-te la cursul
- acoperit
- acoperă
- Covid-19
- Pandemie COVID-19
- Criteriile de
- clienţii care
- de date
- Data
- Zi
- dezbatere
- decembrie
- Delhi
- Departament
- În ciuda
- în curs de dezvoltare
- Dezvoltare
- direcționa
- dezastru
- dezvălui
- dezvăluire
- discreție
- discuţie
- discuții
- do
- face
- Intern
- proiect
- proiect de orientări
- medicament
- Droguri
- două
- în timpul
- în timpul COVID-19
- e
- fiecare
- Mai devreme
- Eficace
- în mod eficient
- efecte
- permite
- încuraja
- capăt
- energie
- captivant
- asigura
- Mediu inconjurator
- mai ales
- În esență,
- Eter (ETH)
- evenimente
- tot mai mare
- materializate
- exemplu
- Exercita
- Extinde
- expansiune
- extern
- factori
- FAIL
- A eșuat
- în lipsa
- Eșec
- echitabil
- federal
- Guvernul federal
- federal
- eroare
- camp
- depusă
- În cele din urmă
- First
- prima dată
- urma
- următor
- Pentru
- proră
- frunte
- formă
- formulă
- Înainte
- patru
- FRAME
- din
- faţă
- complet
- finanțate
- de finanțare
- General
- obtinerea
- Da
- scop
- guvernare
- Guvern
- guvernele
- Guv
- acordate
- Teren
- orientări
- HAD
- mână
- lucru
- a răni
- Avea
- he
- Sănătate
- de asistență medicală
- ei
- aici
- aici
- Înalt
- HIV
- Acasă
- Cum
- Totuși
- HTML
- HTTPS
- uman
- i
- idei
- if
- ii
- III
- imagine
- afectate
- important
- in
- Crește
- India
- indian
- guvernul indian
- industrii
- ineficiențe
- neoficial
- Infrastructură
- inerent
- Inovaţie
- intrări
- instanță
- in schimb
- Institut
- intelectual
- de proprietate intelectuală
- interacţiune
- interacţiuni
- interes
- interesat
- interesant
- intern
- Internațional
- interveni
- în
- introduce
- introdus
- introducerea
- Invenţie
- inventii
- inventatori
- investiţie
- investeste
- îmbietor
- invocat
- IP
- Ironic
- problema
- probleme de
- IT
- ESTE
- judiciar
- păstrare
- Cunoaște
- Drept
- lăsând
- Legislație
- Nivel
- licență
- licențiere
- Licență
- ca
- LIMITĂ
- Se pare
- scăderea
- făcut
- face
- manieră
- fabricat
- multe
- Martie
- marca
- Piață
- max-width
- Mai..
- măsura
- măsuri
- Întâlni
- menționat
- metodă
- minte
- bani
- mai mult
- cele mai multe
- mutat
- mult
- național
- Nevoie
- nevoilor
- nu
- Nou
- NIH
- nist
- Nonprofit
- în special
- nimic
- roman
- acum
- obiectiv
- Obiectivele
- obligațiuni
- of
- Birou
- on
- cele
- afară
- deschide
- opune
- Opţiuni
- or
- Altele
- Altele
- afară
- peste
- global
- propriu
- proprietate
- pandemie
- petreceri
- parte
- brevet
- patentat
- pentru
- poate
- Pharma
- Farmaceutic
- Plato
- Informații despre date Platon
- PlatoData
- Punct
- Politica
- poziţie
- poziţii
- eventual
- Post
- postări
- potenţial
- putere
- practică
- prezenţă
- prezenta
- presiune
- precedent
- preţ
- Prețuri
- de stabilire a prețurilor
- primar
- anterior
- privat
- proces
- Produs
- Produse
- progresiv
- Promovarea
- proprietate
- Drepturi de proprietate
- propus
- protecţie
- furniza
- prevăzut
- public
- Publicare
- scop
- împingerea
- pune
- întrebare
- Întrebări
- cu totul
- C&D
- ridicat
- atins
- cititori
- lumea reală
- rezonabil
- motive
- recent
- reţetă
- reteta pentru dezastru
- recunoscut
- refuzare
- eliberat
- rămășițe
- necesita
- cerință
- Cerinţe
- Necesită
- cercetare
- cercetare și dezvoltare
- Răspunde
- rezultând
- reveni
- revizuiască
- dreapta
- Drepturile
- robust
- RTI
- s
- Siguranţă
- Said
- acelaşi
- control
- Al doilea
- secretar
- Secțiune
- sector
- sectoare
- vedea
- Căuta
- caută
- pare
- văzut
- distinct
- Septembrie
- Serios
- Servicii
- set
- schimbare
- să
- semnificativ
- asemănător
- asemănător
- pur şi simplu
- întrucât
- singur
- mic
- So
- unele
- ceva
- vorbi
- spirit
- miză
- atitudine
- standarde
- Stat
- Pas
- paşi
- oprit
- întărire
- puternic
- student
- Studiu
- subiect
- succes
- astfel de
- a sustine
- Înconjurător
- sistem
- Lua
- luate
- direcționare
- contribuabil
- Tehnologia
- acea
- Statul
- lor
- Acolo.
- Acestea
- ei
- lucruri
- Al treilea
- terțe părți
- acest
- aceste
- deşi?
- în trei pași
- Prin
- Prin urmare
- timp
- la
- împreună
- instrument
- față de
- comerţului
- Traducere
- tratament
- tendință
- proces
- încerca
- ÎNTORCĂ
- dublu
- ne
- neclar
- în
- Universități
- universitate
- spre deosebire de
- până la
- pe
- us
- guvernul SUA
- Folosire
- utilizare
- folosind
- folosire
- diverse
- versiune
- foarte
- a fost
- we
- cântar
- Ce
- Ce este
- cand
- dacă
- care
- în timp ce
- OMS
- voi
- cu
- fără
- valoare
- ar
- ani
- încă
- zephyrnet