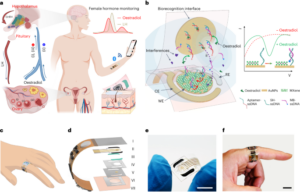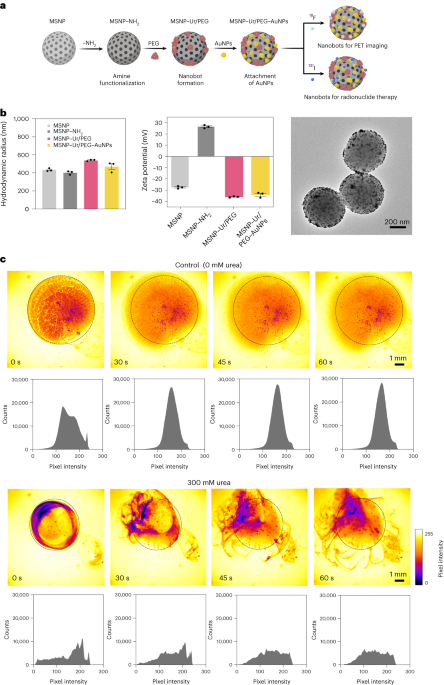
Sinteza nanobot
Nanoboții au fost pregătiți așa cum s-a descris anterior33. Pe scurt, MSNP-urile au fost sintetizate folosind o metodă Stöber modificată41reacționând trietanolamină (35"g), apă ultrapură (20"ml) și bromură de hexadeciltrimetilamoniu (CTAB; 570"mg) la 95°C timp de 30"min în timp ce se agită. Sa adăugat ulterior prin picurare ortosilicat de tetraetil (1.5 ml); amestecul a fost lăsat să reacționeze timp de 2 ore la 95 °C, iar MSNP-urile rezultate au fost colectate prin centrifugare și spălate în etanol (de trei ori, 2,500g, 5 minute). Pentru a îndepărta șablonul CTAB, MSNP-urile au fost plasate la reflux în metanol acid (1.8 ml HCI, 30 ml metanol) timp de 24 h. Apoi, MSNP-urile au fost colectate prin centrifugare și spălate de trei ori în etanol (2,500g, 5 min) înainte de a încorpora modificarea aminei prin adăugarea de APTES (6 µl per mg de MSNP) la MSNP-uri (1 mg ml-1) într-o soluție etanolică 70% la 70°C, agitând energic timp de 1 h. MSNP-NH2 au fost colectate și spălate de trei ori în etanol și de trei ori în apă prin centrifugare (de trei ori, 1,150g, 5 minute). MSNP-NH2 au fost resuspendate în PBS la o concentrație de 1 mg ml-1 și volum total de 900 ui și activat cu glutaraldehidă (100 ui) timp de 2.5 ore la temperatura camerei. MSNPs-NH activat2 au fost colectate și spălate în PBS de trei ori prin centrifugare (1,150g, 5 min), resuspendat într-o soluție de urază (3 mg ml-1) și PEG heterobifuncțional (1 μg PEG per mg de 5 kDa HS-MSNPs-NH2) în PBS și a reacționat timp de 24 h la temperatura camerei. Nanoboții rezultați au fost apoi colectați și spălați de trei ori în PBS prin centrifugare (1,150g, 5 min) înainte de a le resuspenda într-o dispersie de AuNP, preparate așa cum s-a descris anterior51, lăsându-le să reacționeze timp de 10 min și spălându-le bine prin centrifugare (de trei ori, 1,150g, 5 minute).
Distribuția hidrodinamică a mărimii și sarcina de suprafață a MSNP-urilor, MSNPs-NH2, nanoboții și nanoboții decorați cu AuNP au fost determinați folosind un sistem dinamic de împrăștiere a luminii Wyatt Mobius și, respectiv, un Malvern Zetasizer. În toate cazurile, concentrația a fost de 20 µg ml-1 și timpul de achiziție 5 s, folosind trei rulări per experiment. Au fost efectuate trei măsurători pe tip de particule.
Sinteza MSNP-urilor FITC
Un amestec de FITC (2'mg), etanol (5'ml) şi APTES (400'ul) a fost preparat şi agitat timp de 30'min. Apoi, a fost urmat protocolul descris anterior pentru sinteza MSNP, cu excepția faptului că am adăugat ortosilicat de tetraetil (1.25 ml) prin picurare în combinație cu amestecul FITC-APTES (250 µl). Etapele de funcționalizare pentru obținerea nanoboților marcați cu FITC au fost cele menționate mai sus.
Sinteza AuNP-urilor
AuNP-urile au fost sintetizate folosind o metodă raportată33. Pe scurt, toate materialele au fost curățate folosind apă regia proaspăt preparată, clătite bine cu apă și uscate la aer. Ulterior, un AuCl de 1 mM4 soluția a fost încălzită până la punctul de fierbere în timp ce se agită într-un balon cu fund rotund integrat într-un sistem de reflux. După aceasta, s-au adăugat 10 ml de soluție de citrat de sodiu (30.8 mM) și soluția s-a fiert timp de 20 min, rezultând o culoare roșie. Soluția a fost apoi lăsată să se răcească la temperatura camerei în timp ce se agită timp de 1 oră. AuNP-urile rezultate au fost stocate la întuneric și caracterizarea a fost efectuată folosind microscopia electronică cu transmisie.
Activitate enzimatică
Activitatea enzimatică a nanoboților, 18F-nanoboți și 131I-nanoboții a fost măsurat folosind roșu de fenol. Pentru a face acest lucru, 2 µl de nanoboți (1 mg ml-1) s-au adăugat la o placă cu 96 de godeuri și s-au amestecat cu 200 pl de diferite soluții de uree (0, 50, 100, 200 mM) în roșu fenol 1.1 mM. Absorbanța la 560 nm a fost măsurată în timp la 37°C.
Dinamica mișcării nanobot prin microscopie optică
Videoclipurile optice ale nanoboților au fost achiziționate folosind un microscop Leica Thunder, cuplat cu o cameră CCD de mare viteză Hamamatsu și un obiectiv ×1.25. Pentru aceasta, nanoboții au fost centrifugați și resuspendați în 50 µl de PBS (concentrație finală de 20 mg ml-1). Apoi, un vas Petri a fost umplut cu 3 ml fie de PBS, fie o soluție de uree 300 mM (în PBS) și observat la microscop. O picătură de 5 µl cu nanoboți (20 mg ml-1) a fost apoi adăugată în placa Petri umplută cu lichid și videoclipurile au fost înregistrate la 25 de cadre pe secundă. Distribuțiile de intensitate a pixelilor video în ROI au fost analizate la intervale de 15 s folosind software-ul ImageJ.
Radiomarcarea nanoboților cu [18F]F-PyTFP
Sinteza [18F]F-PyTFP
[18F]F-PyTFP a fost sintetizat într-un modul Neptis xSeed (Aplicații radiochimice optimizate), urmând o metodă raportată anterior33.
Sinteza de 18Nanoboți marcați F
Nanoboții au fost etichetați cu [18F]F-PyTFP, pe baza unei proceduri stabilite anterior cu mici modificări33. Pe scurt, 200 µl de soluție de nanobot (1 mg ml-1) a fost centrifugat (10 min, 13,853g), resuspendat în 10 µl de PBS (1 mM, pH 8) și incubat cu 4 µl de [18F]F-PyTFP în acetonitril (aproximativ 37 MBq) timp de 35 min la temperatura camerei. După incubare, amestecul de reacție a fost diluat cu apă (200 µl) și purificat prin centrifugare (5 min, 13,853).g). Peletul rezultat a fost apoi clătit de trei ori cu apă înainte de a fi măsurat într-un calibrator de doză (CPCRC-25R, Capintec). Randamentul radiochimic a fost calculat ca raport între cantitatea de radioactivitate prezentă în nanoboți după spălare și cantitatea inițială de radioactivitate. Puritatea radiochimică după purificare a fost ≥99%, așa cum a fost determinată prin cromatografie radio în strat subțire (radio-TLC) folosind hârtie de cromatografie iTLC-SG (Agilent Technologies) și diclormetan și metanol (2:1) ca faze staționare și, respectiv, mobilă. Plăcile TLC au fost analizate folosind un cititor TLC (MiniGITA, Raytest).
Stabilitatea de 18F-nanoboți
Stabilitatea lui 18Nanoboții marcați cu F au fost determinați folosind următoarele medii: (1) uree 300 mM, (2) apă și (3) urină de la animale purtătoare de tumori. 18Nanoboții marcați cu F (10 µl) au fost incubați cu soluția corespunzătoare (100 µl) timp de 1 oră la temperatura camerei. Apoi, nanoboții și supernatantul au fost separați prin centrifugare și colectați, iar radioactivitatea a fost măsurată într-un calibrator de doză (CPCRC-25R).
Radiomarcarea nanoboților cu 131I
Iodarea radioactivă a nanoboților cu urează a fost realizată prin incubarea nanoboților cu injectabil [131Soluție I]NaI (925 MBq ml-1; GE HealthCare). Pe scurt, 400 µl de soluție de urează nanobot (1 mg ml-1) a fost centrifugat (13,853g, 5 min), resuspendat în 100 µl de PBS (10 mM, pH 7.4) și incubat cu 25 µl sau 185 µl de injectabil [131I]NaI (aproximativ 42.55 sau respectiv 277.5 MBq) timp de 30 min, în funcție de activitatea finală dorită. După incubare, amestecul de reacție a fost purificat prin centrifugare (13,853g, 5 minute). Precipitatul rezultat a fost spălat de trei ori cu apă (100 ui). Radioactivitatea în supernatant și precipitat a fost determinată folosind un calibrator de doză (CPCRC-25R) și ambele fracții au fost analizate prin radio-TLC, ca și pentru 18F-nanoboți.
Dezvoltarea modelului animal
Șoarecii au fost întreținuți și manipulați în conformitate cu Directiva 2010/63/UE a Consiliului European și cu ghidurile interne. Toate procedurile experimentale au fost aprobate de comitetul de etică CIC biomaGUNE și de autoritățile locale (Diputación Foral de Guipuzcoa, PRO-AE-SS-276). Analiza imaginii (atât PET, cât și RMN) a fost orbită față de distribuția de grup a animalelor.
Modelul ortotopic murin al cancerului vezicii urinare a fost generat prin administrarea intravezicală a celulelor MB49 (linia celulară a vezicii urinare de carcinom murin) la șoareci femele C57BL/6JRj (în vârstă de 8 săptămâni, Janvier). Pentru experimentele care vizează determinarea acumulării tumorale (patru grupuri; detalii mai jos), au fost inoculate șase animale per grup, determinate prin analiza de precizie, cu următoarele ipoteze: precizie necesară, 20%; s.d. aşteptat, ±20%; încredere, 95%; pierderi de animale, 20%. Pentru experimentele de eficacitate terapeutică (șase grupuri; detalii de mai jos), zece animale au fost incluse per grup, calculate folosind un Student cu o singură coadă. t-test, diferenta intre doua mijloace independente, cu urmatoarele ipoteze: ipoteza nula, tratamentul nu afecteaza cresterea tumorii; α, 0.05; 1 − β, 0.95; s.d., ±50%; diferențe așteptate între grupuri, 50%; pierderi de animale, 20%. Deoarece experimentul a fost efectuat în două loturi din motive operaționale, un grup de control a fost inclus în ambele loturi (Tabel 2), și apoi toate animalele au fost reunite. Pentru stabilirea tumorii, șoarecii au fost anesteziați prin inhalarea a 3% izofluran în O pur.2 și menținut cu 1.0-1.5% izofluran în 100% O2. Apoi, vezica urinară a fost golită și leziuni chimice induse pe uroteliu prin instilarea intravezicală a 50 µl de poli-l-lizină (Sigma-Aldrich) printr-un cateter de calibrul 24 timp de 15 min. Ulterior, vezica urinară a fost golită din nou și celulele MB49 (105 celulele) în DMEM cu conținut ridicat de glucoză (100 µl) au fost instilate timp de 1 oră înainte de îndepărtarea cateterului și golirea vezicii urinare prin masaj abdominal. Pe parcursul experimentelor, șoarecii au fost monitorizați și cântăriți pentru monitorizarea sănătății și bunăstării. A fost aplicat un obiectiv uman dacă pierderea în greutate a depășit 20% sau pe baza simptomelor clinice, conform criteriilor medicului veterinar responsabil.
Urmărirea dimensiunii tumorii
Studiile RMN au fost efectuate la 7 și la 14 zile după inducerea tumorii, utilizând un scaner 7 T Bruker BioSpec USR 70/30 (Bruker BioSpin) echipat cu o inserție de gradient BGA-12S de 440 mT m-1 și un rezonator QSN 112/086 (T12053V3) pentru radiofrecvență14 transmisie și o bobină de suprafață a creierului de șobolan (T11205V3) pentru recepția RF (ambele funcționând la 300 MHz). Animalele au fost anesteziate cu izofluran (4% pentru inducție și 1.5% pentru întreținere într-o 50% O2/50% N2 amestec) și așezate pe un leagăn compatibil MR. Temperatura corpului și rata respirației au fost monitorizate continuu folosind un dispozitiv de monitorizare compatibil MR (modelul 1030 SA, Instrumente pentru animale mici), interfațat cu un sistem de încălzire a aerului pentru rozătoare mici pentru a menține temperatura corpului. După achiziționarea imaginilor de referință, a fost utilizată o secvență de imagistică ponderată prin difuzie bazată pe spin-eco pentru imaginea tumorilor, utilizând următorii parametri: timpul ecou (TE) = 22.3 ms, timp de repetiție (TR) = 2,500 ms, n = 2 medii, o imagine A0 (imagine bazală cu b = 0 s mm-2) și o imagine DW dobândită folosind gradienți de difuzie în direcția (1, 0, 0) cu o durată de gradient δ = 4.5 ms și o separare în gradient Δ = 10.6 ms, dând b = 650 s mm-2, un 16 × 16 mm2 câmp de vedere, dimensiunea matricei imaginii de 160 × 160 de puncte, 20 de bucăți consecutive de 0.5 mm grosime (fără spațiu, achiziționat în modul intercalat) și o lățime de bandă de 192.9 Hz per pixel. Pentru a vizualiza tumorile, imaginile au fost postprocesate cu software-ul ImageJ, împărțind imaginile dobândite cu un gradient de difuzie (b = 650 s mm-2) de cei dobanditi fara (b = 0 s mm-2) și aplicarea unui filtru gaussian 3D (σx = σy = σz = 0.7) la rezultat. Tumorile au fost delimitate manual pentru a le determina volumul.
Biodistribuția in vivo
În ziua 15 după inducerea tumorii, șoarecii au fost randomizați în patru grupuri pentru a obține distribuții medii omogene ale volumului tumorii între grupuri. Scanere PET-CT (scanere MOLECUBES β și X-CUBE) au fost obținute la 3 ore după administrarea intravezical a 100 µl de 18F-BSA (grupele 1 și 2) sau 18Nanoboți F-urează (grupele 3 și 4) la o concentrație de 200 µg ml-1, folosind fie apă (grupele 1 și 3) fie 300 mM uree în apă (grupele 2 și 4) ca vehicul (Tabel 1). Pentru achiziția imaginii, animalele au fost induse cu anestezie (5% izofluran în oxigen pur) și plasate în decubit dorsal înainte de a masa regiunea abdominală pentru evacuarea vezicii urinare. Imediat după aceea, corespunzătoare 18Nanoboți marcați F (18F-BSA/18F-urează în apă/uree) au fost instilate în vezică printr-un cateter de calibrul 24 și incubate timp de 1 oră, înainte de îndepărtarea cateterului, golirea vezicii urinare și lăsarea șoarecilor să-și revină după anestezie. La t = 3 h după administrare, animalele au fost reanesteziate și au fost obținute imagini PET statice ale întregului corp la 10 min, urmate de scanări CT. Imaginile PET au fost reconstruite folosind algoritmul de reconstrucție de maximizare a așteptărilor subsetului ordonat 3D cu corecții aleatoare, de împrăștiere și de atenuare. Imaginile PET-CT ale aceluiași mouse au fost co-înregistrate și analizate folosind instrumentul de procesare a imaginii PMOD. Graficele concentrației radioactivității în funcție de timp au fost obținute prin crearea unui volum de interes pe regiunea superioară a vezicii urinare folosind un instrument de contur 3D și măsurarea activității (dezintegrarea corectată) în kilobecquerele pe organ. Rezultatele au fost corectate prin aplicarea unui factor de calibrare și apoi normalizate prin volumul tumorii derivat din RMN.
Studii ex vivo
Analize histopatologice
După finalizarea tuturor imaginilor, veziciile selectate (n = 3 per grup) de la animalele purtătoare de tumori și sănătoase au fost îndepărtate în condiții aseptice și fixate imediat în formaldehidă 4%. Apoi, vezica urinară a fost încorporată în parafină înainte de a lua secțiuni de 2-3 µm pentru colorarea cu hematoxilină-eozină. Imaginile reprezentative au fost obținute din toate condițiile pentru examenul histopatologic.
Analiza ICP-MS
Măsurătorile au fost efectuate pe un Thermo iCAP Q ICP-MS (Thermo Fisher Scientific) cuplat cu un autosampler ASX-560 (CETAC Tech). După finalizarea tuturor imaginilor, animalele au fost ucise și vezicile selectate (n = 2 pe grup; patru grupe) colectate și digerate în 1 ml de HNO3:HCI (amestec 4:1). Dispersia a fost fiartă până când organele au fost complet dizolvate. Apoi, soluția a fost răcită la temperatura camerei și analizată folosind ICP-MS pentru a determina concentrația de Au din fiecare probă, transformând rezultatele în procente din doza injectată per gram de țesut (%ID g-1).
Imunohistochimie și imagistica microscopică confocală
Pentru analizele imunohistochimice, animalele purtătoare de tumori au primit nanoboți marcați cu FITC în apă sau uree 300 mM (n = 4 per grup), așa cum este descris mai sus, pentru studiile PET-CT. În plus, animalele purtătoare de tumori fără nanoboți au servit ca grup de control (n = 2). În toate cazurile, vezica urinară a fost colectată, congelată și tăiată în secțiuni de 10 µm care au fost imediat fixate în formaldehidă 10% timp de 15 min, spălate cu PBS 10 mM și apoi incubate în 50 mM NH.4CI în PBS timp de 5 minute înainte de clătire din nou cu PBS. Permeabilizarea a fost efectuată cu metanol:acetonă (1:1) timp de 5 min la temperatura camerei și 0.1% Triton în PBS timp de 5 min. După spălarea cu PBS, probele au fost saturate cu o soluție de 5% BSA–0.5% Tween în PBS timp de 15 minute la temperatura camerei și incubate timp de 1 oră la temperatura camerei cu anti-FITC de șoarece (1:100, Abcam) în 5% BSA. –0.5% Tween. Secțiunile au fost spălate de trei ori cu 10 mM PBS timp de 5 min și incubate timp de 30 min la temperatura camerei cu anticorp secundar Alex Fluor 647 măgar IgG anti-șoarece (Molecular Probes, Life Technologies, 1:1,000) în 5% BSA-0.5% Tween în PBS, spălat din nou în PBS (3 × 5 min) și montat cu un kit antidecolorare ProLong cu 4,6-diamidino-2-fenilindol (DAPI; Molecular Probes, Life Technologies). Imaginile au fost achiziționate cu un microscop confocal Leica STELLARIS 5 (Parcul științific UPV/EHU) cu setări identice pentru toate secțiunile: mărire ×10 cu imagistica și cusătură (de obicei 4 × 5 câmp vizual). Linia laser și ferestrele de detectare au fost 405 nm și 440–503 nm pentru DAPI, 489 nm și 494–602 nm pentru laserul alb FITC și 653 nm și 660–836 nm pentru laserul alb Alexa647.
Curățare optică
După perfuzia cu paraformaldehidă 4% și PBS, probele de vezică urinară au fost îndepărtate și fixate în continuare în paraformaldehidă 4% peste noapte la 4 °C, apoi încorporate într-o seringă de 5 ml cu agaroză cu punct de topire scăzut de 0.8% pentru a forma un bloc cilindric și a permite ușor. montarea în cuva de cuarț. Întregul bloc a fost deshidratat progresiv folosind metanol:H2O la 4°C (30%:70% pentru 1 oră, 50%:50% pentru 1 oră, 70%:30% pentru 1 oră, 100%:0% pentru 1 oră, apoi 100% metanol peste noapte și din nou pentru 4 h) și în cele din urmă scufundat în alcool benzilic-benzoat de benzii (BABB) ca soluție de potrivire a indicelui de refracție pentru imagistică. Pentru comparații in vitro ale nanoboților FITC verzi cu particule roșii comerciale, am folosit nanoparticule de siliciu fluorescent de culoare roșie DiagNano (Creative Diagnostics), cu diametrul de 1 µm, rezistente la curățarea BABB.
Autofluorescență și imagistica sLS polarizată
Imaginile cu foi de lumină au fost efectuate pe MacroSPIM, un sistem personalizat pentru imagistica cu întregul organ dezvoltat la IRB Barcelona44,45. Pe scurt, probele sunt încorporate într-un bloc de agaroză, curățate împreună cu proba și fotografiate în interiorul unei cuve de cuarț. Imaginile cu autofluorescență au folosit lasere la 488, 561 sau 638 nm care furnizează iluminare printr-o lentilă cilindrică dublu acromatică de 50 mm (ACY254-050-A, Thorlabs). Pentru a reduce artefactele cu dungi, foaia de lumină este pivotată cu un scaner rezonant SC-10 (EOPC) de-a lungul unui telescop 4f cu lentile dublete acromatice G322288322 de 100 mm (QI Optic Photonics). Autofluorescența tisulară este colectată prin filtre de fluorescență cu bandă sau trecere lungă și înregistrată cu o cameră ORCA Flash v2 (Hamamatsu Photonics). Imaginile au fost efectuate la ×9.6 cu un zoom ×8, lentilă ×2 și obiectiv cu tub ×0.6. Foaia de lumină a fost aplatizată pe câmpul vizual, dând 5–6 µm de rezoluție axială. Imaginile 3D au fost realizate în pași de 2.5 µm. Imagistica întregii vezici urinare a fost efectuată în 2 × 3 sau 3 × 4 XY plăci, în funcție de dimensiunea organului.
Imagistica sLS a fost realizată prin îndepărtarea filtrului de fluorescență sau prin utilizarea oricărui filtru care transmite laserul. Pivotarea foii de lumină a redus zgomotul de pete laser, rezultând o medie temporală a coerenței laserului, așa cum a fost arătat mai devreme52. Orientarea polarizării liniare a foii de lumină în iluminare a fost controlată prin rotirea unei plăci cu jumătate de undă (AHWP05M-600, Thorlabs) înaintea scanerului pivot. Semnalul detectat a fost selectat în polarizare folosind un polarizator liniar rotativ (LPVISC100, Thorlabs) înainte ca roata de filtrare în detecție, introducând pierderi de intensitate >50% în detectarea fluorescenței. În timp ce distribuția semnalului sLS în general se modifică odată cu orientarea polarizatorului, semnalul de autofluorescență tisulară rămâne neafectat de rotația polarizatorului. sLS oferă o rezoluție spațială de 2.4 ± 0.3 µm în BABB, care este comparabilă cu rezoluția în imaginile cu foi de lumină fluorescentă (confirmată prin potrivirea unei funcții gaussiene la XY Răspunsul la imagine al unei singure particule, Fig. 8l–m) și aproape de rezoluția teoretică în aer (1.53 µm cu deschidere numerică (NA) = 0.2 la zoom macro maxim ×8).
Procesarea imaginilor și analiza 3D
Prelucrarea imaginii, segmentarea și analiza seturilor de date din foile de lumină au fost realizate cu ImageJ/Fiji, în timp ce Fig. 3 și 4 au fost generate cu Imaris Viewer 9.9 (https://imaris.oxinst.com/imaris-viewer) și Video suplimentar 3 a fost generat cu Imaris 9 (https://imaris.oxinst.com/) (Bitplane, Oxford Instruments). Seturile de date din foile luminoase au fost cusute cu MosaicExplorerJ53. Segmentarea 3D a țesutului vezicii urinare a fost efectuată folosind macro-uri personalizate ImageJ/Fiji pentru adnotarea 3D semi-automatizată a volumelor mari în modul virtual. Pe scurt, un prim script, „Macro1”, încarcă stive de imagini 3D, permite utilizatorului adnotarea ROI-urilor în mai multe planuri și interpolează automat ROI-urile pentru a genera și exporta măști 3D. ROI-urile au fost desenate la fiecare 15 plane (la fiecare 37.5 µm) pentru a facilita o bună continuitate a segmentării, păstrând în același timp adnotările la un minim rezonabil. Un al doilea script, ‘Macro2’, efectuează operațiunile matematice sau booleene, plan cu plan, fără a încărca în memorie întregul stivă, fie între măști 3D, fie între o mască 3D și datele originale, salvând rezultatul ca o stivă nouă. Toate măștile au fost generate prin adnotarea imaginilor cu autofluorescență.
Atât straturile suprafeței tumorale, cât și ale țesutului sănătos (Fig. 3) au fost delimitate folosind bagheta și instrumentele lasso ale lui Fiji pe cavitatea vezicii urinare într-o mască. Apelând această primă iterație BC1, rulările ulterioare ale Macro1 dilată apoi automat acest contur 3D cu o cantitate definită de pixeli pentru a produce noi iterații de măști, BC2, BC3 și așa mai departe, cu dilatații crescânde. Primul strat care conține atât tumora, cât și țesut sănătos, masca L1, se obține prin scăderea mascai BC1 din BC2 și așa mai departe, obținând L2 și L3 ca straturi concentrice. Volumul tumorii cel mai apropiat de cavitate a fost obținut prin adnotarea tumorii cu baghetă și instrumente lasso pentru a crea o mască T1, în timp ce stratul sănătos de uroteliu 3D a fost detectat separat în masca U1. Scăzând U1 din L1, se obține stratul de suprafață al tumorii și așa mai departe: L2 − U1, L3 − U1. În schimb, primul strat al uroteliului se obține prin scăderea T1 din L1. Toate straturile din fig. 3 au fost definite ca având o grosime de 33 µm.
Aceeași suită de macro-uri și proceduri (instrument baghetă ImageJ, eroziune digitală de 500 µm și așa mai departe) au fost folosite pentru a delimita și a segmenta partea interioară a țesutului vezicii urinare și apoi a estima volumul de țesut intern al vezicii urinare (Fig. 4, vezi mai sus pentru detalii). Histogramele intensității semnalului împrăștiat au fost create în Fiji prin combinarea semnalului împrăștiat și masca.
RNT folosind 131I-nanoboți
Între zilele 8 și 15 de la implantarea tumorii, animalele au fost împărțite în șase grupuri (grupele 1-6), încercând să obțină volume tumorale medii similare între grupuri (Tabelul 2). Pentru experimente, animalele au fost induse cu anestezie (5% izofluran în O pur2) și poziționat în decubit dorsal înainte de golirea vezicii urinare prin masarea regiunii abdominale. Imediat după aceea, 100 µl de tratament adecvat la o concentrație de 400 µg ml-1 (Masa 2) a fost instilat în vezică folosind un cateter de calibrul 24. Tratamentul și vehiculul (apă sau uree) au rămas în vezică timp de 1 oră înainte de îndepărtarea cateterului. Vezica urinară a fost golită din nou prin masaj abdominal și șoarecii s-au recuperat de la anestezie în cuștile lor, înlocuind rumegușul din cuștile animalelor la 24 de ore după tratament pentru a elimina contaminarea radioactivă.
Eficacitatea terapeutică determinată prin RMN
Au fost efectuate două studii RMN pe fiecare șoarece: (1) între zilele 7 și 14 după inocularea tumorii pentru a randomiza animalele între grupuri și pentru a măsura volumele tumorale inițiale (pretratament); (2) între zilele 16 și 21 după inocularea tumorii (post-tratament) pentru a evalua eficacitatea terapeutică. RMN a fost efectuat folosind scanere 7 T Bruker BioSpec și 11.7 T Bruker BioSpec (ambele cu software ParaVision 7), în funcție de disponibilitate. Acest lucru nu a afectat rezultatele, deoarece câmpul extern nu este critic pentru imagistica anatomică14. Experimentele de imagistică au fost efectuate folosind aceiași parametri de imagistică și procesare așa cum s-a explicat mai sus (Urmărirea dimensiunii tumorii). În cazul scanerului de 11.7 T, configurația a constat dintr-o bobină de suprafață a inimii de șoarece pentru recepție și o bobină volumetrică pentru transmisie. Volumele tumorii din fiecare felie au fost determinate din volumele de interes desenate manual care acoperă zona tumorii.
analize statistice
În studiile imagistice PET, procentele din doza injectată (% ID) și doza injectată pe volumul tumorii (% ID cm-3) au fost comparate folosind ANOVA unidirecțional. Diferențele dintre grupuri au fost determinate folosind testul de comparații multiple al lui Tukey. NTV în secțiunea RNT a fost obținut de la a t-testul valorilor nepereche. Distribuția datelor sa presupus a fi normală, dar acest lucru nu a fost testat oficial. Analizele statistice au fost efectuate cu GraphPad Prism v.8.
Sinteza de raportare
Informații suplimentare privind designul de cercetare sunt disponibile în Rezumatul raportării portofoliului de natură legată de acest articol.
- Distribuție de conținut bazat pe SEO și PR. Amplifică-te astăzi.
- PlatoData.Network Vertical Generative Ai. Împuterniciți-vă. Accesați Aici.
- PlatoAiStream. Web3 Intelligence. Cunoștințe amplificate. Accesați Aici.
- PlatoESG. carbon, CleanTech, Energie, Mediu inconjurator, Solar, Managementul deșeurilor. Accesați Aici.
- PlatoHealth. Biotehnologie și Inteligență pentru studii clinice. Accesați Aici.
- Sursa: https://www.nature.com/articles/s41565-023-01577-y
- :este
- :nu
- ][p
- 000
- 1
- 10
- 100
- 11
- 13
- 14
- 15%
- 16
- 160
- 20
- 200
- 2015
- 2017
- 2018
- 2019
- 2020
- 2021
- 22
- 23
- 24
- 25
- 250
- 30
- 300
- 33
- 35%
- 3d
- 400
- 41
- 50
- 500
- 51
- 52
- 53
- 7
- 70
- 8
- 9
- 95%
- a
- Despre Noi
- mai sus
- conform
- acumulare
- Obține
- realizat
- dobândite
- dobândirea
- achiziție
- peste
- activată
- activ
- activitate
- adăugat
- adăugare
- În plus,
- administrare
- afecta
- După
- după aceea
- din nou
- vizează
- AIR
- AL
- alex
- Algoritmul
- TOATE
- permis
- de-a lungul
- Alzheimer
- printre
- sumă
- amiloid
- an
- analize
- analiză
- Ancoră
- și
- animal
- animale
- anticorp
- Orice
- aplicatii
- aplicat
- Aplicarea
- adecvat
- aprobat
- apă
- SUNT
- ZONĂ
- articol
- AS
- asumat
- ipoteze
- At
- Autoritățile
- în mod automat
- disponibilitate
- disponibil
- in medie
- medie
- b
- Babb
- Lățime de bandă
- bază
- BE
- înainte
- comportament
- fiind
- de mai jos
- între
- Bloca
- corp
- fiert
- atât
- Creier
- povară
- dar
- by
- cuști
- calculată
- apel
- aparat foto
- Rac
- caz
- cazuri
- CCD
- celulă
- Celule
- Modificări
- taxă
- chimic
- Cliring
- clic
- clinic
- Închide
- bobina
- combinaţie
- combinând
- comercial
- comitet
- comparabil
- comparație
- comparații
- complet
- completarea
- concentrare
- condiție
- Condiții
- efectuat
- încredere
- CONFIRMAT
- consecutiv
- continuitate
- continuu
- Control
- controlată
- invers
- Rece
- corectat
- Corectarea
- Corespunzător
- Consiliu
- cuplat
- acoperire
- crea
- a creat
- Crearea
- Creator
- Criteriile de
- critic
- CT scanează
- personalizat
- Tăiat
- Întuneric
- de date
- seturi de date
- zi
- Zi
- de
- definit
- livrarea
- În funcție
- descris
- Amenajări
- dorit
- detalii
- detectat
- Detectare
- Determina
- determinat
- determinarea
- dezvoltat
- dispozitiv
- diagnostic
- FĂCUT
- diferenţă
- diferenţele
- diferit
- difuziune
- digital
- diluat
- direcţie
- Boală
- fel de mâncare
- Dispersia
- distribuire
- distribuții
- împărțit
- do
- face
- făcut
- doză
- elaborate
- Picătură
- durată
- dinamic
- dinamică
- e
- E&T
- fiecare
- uşor
- ecou
- eficacitate
- oricare
- încorporat
- permite
- permite
- Punct final
- sporită
- Întreg
- enzimatic
- echipat
- stabilit
- stabilire
- estima
- Eter (ETH)
- etică
- european
- evalua
- Fiecare
- examinare
- depășit
- Cu excepția
- aşteptare
- de aşteptat
- experiment
- experimental
- experimente
- a explicat
- exporturile
- extern
- facilita
- factor
- Femeie
- camp
- Smochin
- Figura
- umplut
- filtru
- Filtre
- final
- În cele din urmă
- First
- montaj
- fixată
- bliț
- a urmat
- următor
- Pentru
- formă
- formaldehidă
- Oficial
- mai departe
- patru
- din
- congelate
- funcţie
- mai mult
- decalaj
- ge
- GE Healthcare
- General
- genera
- generată
- Oferirea
- bine
- gradienți
- Gram
- Verde
- grup
- Grupului
- Creștere
- orientări
- Avea
- he
- Sănătate
- de asistență medicală
- sănătos
- inimă
- HTTPS
- huang
- uman
- nevoie
- ID
- identic
- if
- imagine
- analiza imaginii
- imagini
- Imaging
- imediat
- cufundat
- îmbunătăţeşte
- in
- inclus
- care încorporează
- crescând
- incubate
- Incubând
- INCUBATIE
- independent
- index
- inducţie
- informații
- inițială
- interior
- în interiorul
- instrumente
- integrate
- interactiv
- interes
- intern
- în
- introducerea
- repetare
- iterații
- ESTE
- KDA
- păstrare
- trusă
- l2
- mare
- cu laser
- lasere
- strat
- straturi
- lăsând
- stânga
- Obiectiv
- Lentilele
- Viaţă
- ușoară
- Linie
- LINK
- legate de
- încărcare
- loturile
- local
- de pe
- Macro
- macro-uri
- menține
- întreținere
- manual
- masca
- Măști
- potrivire
- material
- Materiale
- matematic
- Matrice
- maxim
- mijloace
- măsura
- măsurat
- măsurători
- măsurare
- Mass-media
- Memorie
- merinos
- metanol
- Metode
- soareci
- Microscop
- Microscopie
- minute
- minim
- minor
- mixt
- amestec
- ML
- Mobil
- mod
- model
- Modele
- modificată
- modul
- molecular
- monitorizate
- Monitorizarea
- mişcare
- mouse
- RMN
- MS
- MT
- multiplu
- nanotehnologie
- Natură
- rețele
- Neutru
- Nou
- Nu.
- Zgomot
- normală.
- obiectiv
- observate
- obține
- obținut
- of
- Vechi
- on
- ONE
- de operare
- operațional
- Operațiuni
- optimizate
- or
- Orca
- original
- peste
- peste noapte
- Oxford
- Oxigen
- Hârtie
- parametrii
- Parc
- parte
- particulă
- PBS
- țăruș
- pătrundere
- pentru
- efectuată
- efectuează
- animale de companie
- Petri
- faze
- Pivot
- Pixel
- plasat
- plan
- Avioane
- Plato
- Informații despre date Platon
- PlatoData
- Punct
- puncte
- portofoliu
- poziţie
- poziţionat
- Precizie
- pregătit
- prezenta
- în prealabil
- procedură
- Proceduri
- prelucrare
- progresiv
- protocol
- Qi
- cantitativ
- radio
- aleator
- randomized
- ŞOBOLAN
- rată
- raport
- Reacţiona
- reacţie
- Cititor
- rezonabil
- motive
- primit
- recepție
- inregistrata
- Recupera
- Roșu
- reduce
- Redus
- reduce
- referință
- regiune
- a ramas
- rămășițe
- scoate
- îndepărtat
- eliminarea
- Raportat
- Raportarea
- reprezentant
- necesar
- cercetare
- rezistent
- Rezoluţie
- respectiv
- răspuns
- rezultat
- rezultând
- REZULTATE
- robot
- Cameră
- ruleaza
- s
- SA
- acelaşi
- economisire
- scanări
- risipit
- SCI
- ştiinţific
- scenariu
- Al doilea
- secundar
- Secțiune
- secțiuni
- vedea
- segment
- segmentarea
- selectate
- Secvenţă
- servit
- setări
- câteva
- coală
- indicat
- Semnal
- Distribuția semnalului
- asemănător
- întrucât
- singur
- SIX
- Mărimea
- Felie
- mic
- So
- sodiu
- Software
- soluţie
- soluţii
- spațial
- Stabilitate
- stivui
- Stive
- statistic
- stellaris
- paşi
- stocate
- dungă
- student
- studiu
- ulterior
- Ulterior
- suită
- Suprafață
- Simptome
- sinteză
- sistem
- T
- T1
- tabel
- luare
- tech
- Tehnologii
- telescop
- șablon
- zece
- test
- testat
- acea
- lor
- Lor
- apoi
- teoretic
- Terapeutic
- terapie
- acest
- complet
- aceste
- trei
- tri-dimensională
- Prin
- de-a lungul
- timp
- ori
- țesut
- la
- împreună
- instrument
- Unelte
- Total
- spre
- față de
- transformare
- tratament
- Triton
- încercat
- tumori
- Două
- tip
- tipic
- neafectat
- în
- până la
- pe
- utilizat
- Utilizator
- folosind
- Valori
- vehicul
- Impotriva
- de
- Video
- Video
- Vizualizare
- Virtual
- imagina
- in vivo
- volum
- volume
- volumetric
- Walker
- baghetă
- a fost
- spălat
- Apă
- we
- săptămâni
- greutate
- Asistență socială
- au fost
- Roată
- care
- în timp ce
- alb
- ferestre
- cu
- în
- fără
- X
- Randament
- elastic
- randamentele
- zephyrnet
- zoom