O Departamento de Saúde e Serviços Humanos (HHS) dos EUA concedeu US$ 49.5 milhões à MaximBio, com sede em Maryland, para fortalecer suas capacidades de fabricação de testes de diagnóstico.
O financiamento foi concedido através da Administração de Preparação e Resposta Estratégica dos EUA (ASPR) e faz parte de uma iniciativa mais ampla da administração Biden-Harris.
A iniciativa Biden-Harris incluiu o desembolso de uma doação de 600 milhões de dólares para 12 fabricantes de testes Covid-19 sediados nos EUA. Além disso, o HHS reabriu o COVIDTests.gov para entregar testes Covid-19 gratuitamente para famílias nos EUA.
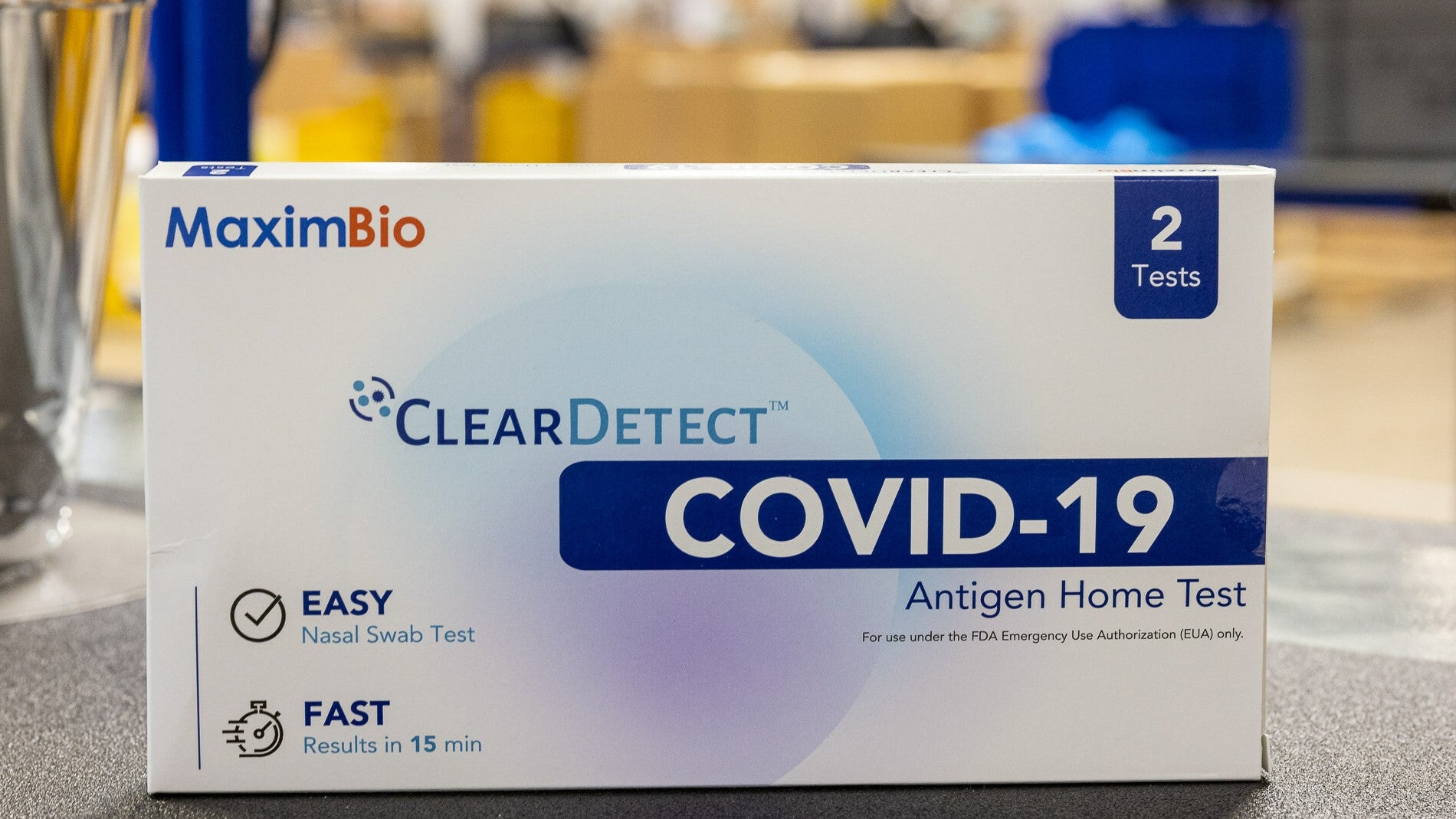
O teste doméstico de antígeno ClearDetect Covid-19 da MaximBio foi desenvolvido usando doações do Departamento de Defesa dos EUA (DoD) e dos Institutos Nacionais de Saúde (NIH) por meio da iniciativa de Aceleração Rápida de Diagnóstico (RADx). O teste detecta antígenos específicos da Covid-19 no esfregaço nasal.
Teste ClearDetect da MaximBio foi liberado para uso em diagnóstico in vitro pela autorização de uso emergencial da Food and Drug Administration (FDA) dos EUA em 2022. Em setembro de 2023, a MaximBio atualizou os testes ClearDetect para aumentar o prazo de validade do teste para 24 meses, quando armazenado a 4° C-30°C.
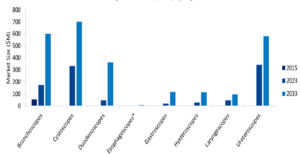
Houve um interesse renovado na Covid-19 diagnóstico e tratamento à luz das novas subvariantes do Omicron. O mercado de diagnóstico in vitro da Covid-19 deverá valer aproximadamente US$ 3 bilhões em 2030, de acordo com Modelo de mercado da GlobalData.
Acesse os perfis de empresas mais abrangentes
no mercado, alimentado pela GlobalData. Economize horas de pesquisa. Ganhe vantagem competitiva.

Perfil da Empresa – gratuito
amostra
Seu e-mail de download chegará em breve
Estamos confiantes sobre o
único
qualidade dos nossos Perfis de Empresa. No entanto, queremos que você aproveite ao máximo
benéfico
decisão para o seu negócio, por isso oferecemos uma amostra grátis que você pode baixar
enviando o formulário abaixo
Por GlobalData
Em novembro de 2023, os Laboratórios ACON, com sede nos EUA recebeu autorização de marketing 510(k) do FDA para seu teste doméstico de antígeno Flowflex Covid-19. O teste rápido de antígeno de venda livre pode detectar a nova variante da Covid-19.
Último Junho, Cue Saúde também recebeu autorização de novo do FDA para seu teste caseiro de Covid-19, o teste molecular Cue Covid-19. O teste molecular de amplificação de ácido nucleico pode detectar o vírus SARS-CoV-2 e pode ser usado tanto no local de atendimento quanto em casa.
Outros beneficiários da subvenção de 600 milhões de dólares do HHS dos EUA incluíram o iHealth Lab, com sede na Califórnia, que recebeu 167 milhões de dólares pelo seu teste rápido de antigénio iHealth Covid-19. A Access Bio, com sede em Nova Jersey, e a CorDx, com sede na Califórnia, receberam US$ 88.7 milhões e 86.4 milhões, respectivamente, por seus imunoensaios de fluxo lateral, teste CorDx Covid-19 Ag e Teste doméstico de antígeno CareStart Covid-19.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://www.medicaldevice-network.com/news/maximbio-wins-49-5m-us-health-award-to-manufacture-covid-19-tests/
- :tem
- :é
- $UP
- 11
- 12
- 2022
- 2023
- 2030
- 24
- 7
- 8
- 9
- a
- Sobre
- aceleração
- Acesso
- em
- administração
- AG
- tb
- Amplificação
- an
- e
- aproximadamente
- SOMOS
- artigo
- AS
- At
- permissão
- prêmio
- premiado
- bandeira
- BE
- sido
- abaixo
- benéfico
- ambos
- mais amplo
- negócio
- by
- CAN
- capacidades
- Empresa
- competitivo
- compreensivo
- confiante
- Covid-19
- crédito
- diariamente
- Notícias diárias
- Data
- decisão
- Defesa
- entregar
- Departamento
- Departamento de Defesa
- descobrir
- diagnóstico
- diagnósticos
- DoD
- download
- droga
- borda
- kit
- final
- expiração
- fda
- fluxo
- comida
- Escolha
- formulário
- fortalecer
- Gratuito
- da
- financiamento
- Ganho
- GlobalData
- conceder
- Saúde
- Início
- HORÁRIO
- famílias
- Contudo
- HTTPS
- humano
- ÍCONE
- imagem
- in
- incluído
- Crescimento
- indústria
- Insights do setor
- Iniciativa
- insights
- interesse
- ESTÁ
- jpg
- Junho
- laboratório
- laboratórios
- principal
- leve
- fazer
- Fabricantes
- fabrica
- mercado
- Marketing
- molecular
- mês
- a maioria
- nasal
- Nacional
- National Institutes of Health
- Novo
- notícias
- Newsletter
- NIH
- Novembro
- Novo
- of
- oferecer
- on
- A Nossa
- Sobre a empresa
- sem receita
- parte
- para
- platão
- Inteligência de Dados Platão
- PlatãoData
- alimentado
- Perfil
- Perfis
- qualidade
- rápido
- recebido
- destinatários
- pesquisa
- respectivamente
- resposta
- SARS-CoV-2
- Salvar
- Setembro
- Serviços
- Configurações
- So
- começo
- armazenadas
- Estratégico
- SVG
- teste
- testes
- que
- A
- deles
- isto
- Através da
- para
- tratamento
- único
- Atualizada
- us
- Departamento de Defesa dos EUA
- Comida dos EUA
- usar
- usava
- utilização
- Variante
- vírus
- queremos
- foi
- we
- quando
- qual
- precisarão
- Vitórias
- de
- Equivalente há
- Você
- investimentos
- zefirnet