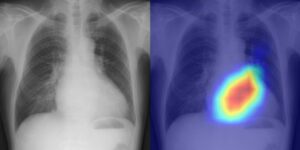
O tratamento do câncer com radiação pode estimular a resposta imunológica do corpo e inibir o crescimento do tumor, mas também pode reduzir o nível de linfócitos, os glóbulos brancos associados à resposta imunológica, resultando em comprometimento do controle do tumor e mau prognóstico. A gravidade desta linfopenia induzida por radiação correlaciona-se com a dose administrada às células sanguíneas e linfócitos circulantes. Como tal, minimizar a dose no coração, no sangue periférico e nos órgãos linfóides poderia ajudar a reduzir este efeito prejudicial.
Para investigar mais esta teoria, Antje Galts e Abdelkhalek Hammi da TU Dortmund University explorou se a radioterapia FLASH – radiação administrada em taxas de dose ultra-altas – poderia reduzir o nível de depleção de células imunológicas durante a terapia de prótons em pacientes com câncer cerebral.
“O mecanismo biológico por trás do efeito poupador de FLASH observado em altas taxas de dose ainda não é totalmente compreendido. No entanto, uma das teorias propostas é a hipótese imunológica, que sugere que a aplicação instantânea da dose de irradiação FLASH reduz significativamente a depleção de linfócitos circulantes, minimizando o tempo de exposição”, explica Hammi. “Em nosso estudo, mostramos que um tratamento hipofracionado e uma administração rápida de dose pouparam as células do sistema imunológico em até 27 vezes em comparação com um plano de tratamento convencional de varredura por feixe de prótons fracionado.”
Galts e Hammi usaram um modelo dosimétrico de fluxo sanguíneo para simular a dose para linfócitos circulantes durante a terapia de prótons convencional e baseada em FLASH (IMPT) de um tumor cerebral. O modelo dinâmico de entrega de feixe simula um plano de tratamento fracionado IMPT enquanto considera a variação espaço-temporal da taxa de dose de cada feixe de prótons único. Hammi observa que o modelo incorpora parâmetros de entrega realistas de ciclotrons disponíveis comercialmente.
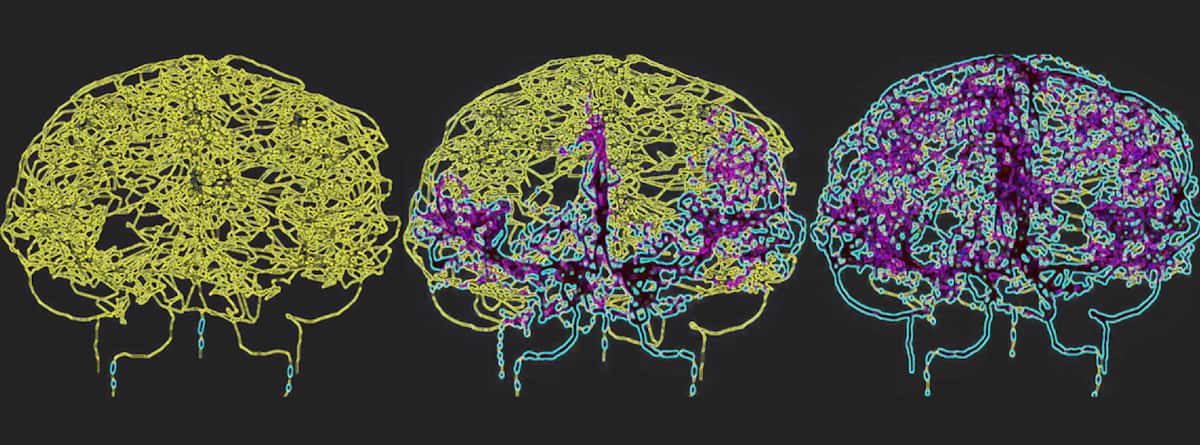
Para refletir com precisão a circulação sanguínea no cérebro humano, Galts e Hammi mapearam os vasos sanguíneos diretamente das imagens de angiografia por RM do cérebro. Eles usaram o modelo cerebrovascular resultante, que incluiu 465 vasos sanguíneos e 8841 ramos de vasos individuais, para simular a circulação de células imunológicas na corrente sanguínea.
Os pesquisadores criaram planos de tratamento IMPT realistas para um tumor de glioblastoma, usando quatro feixes de prótons incidentes e parâmetros de entrega clinicamente relevantes. Eles então calcularam os campos de radiação variáveis no tempo aos quais o sangue circulante é exposto durante a aplicação dos planos de terapia de prótons e a dose acumulada após o tratamento, relatando suas descobertas em Física em Medicina e Biologia.
O glioblastoma é a forma mais letal de câncer cerebral e tratá-lo com radioterapia pode causar linfopenia prolongada induzida por radiação. “Ao modelar um sistema cerebrovascular durante a administração de radiação, esperamos obter insights mais profundos sobre como a radioterapia afeta a resposta imunológica nesses grupos de pacientes, levando potencialmente a melhores estratégias terapêuticas”, diz Hammi.
Comparações de planos
Galts e Hammi examinaram quatro cenários de tratamento: IMPT FLASH com uma única fração de 22.3 Gy; FLASH hipofracionado usando duas frações de 14.6 Gy e cinco de 8 Gy; e IMPT convencional usando trinta e duas frações de 2 Gy. Para cada plano de tratamento, avaliaram o impacto dosimétrico nos linfócitos circulantes e estimaram a radiotoxicidade resultante.
Os histogramas dose-volume revelaram que a radioterapia FLASH reduziu significativamente a proporção de células irradiadas em comparação com a taxa de dose convencional IMPT. Durante a primeira fração de tratamento, todos os três esquemas FLASH irradiaram cerca de 1.52% do volume sanguíneo circulante, enquanto o IMPT convencional irradiou 2.18%. Os planos FLASH hipofracionados, administrados em duas ou cinco frações, aumentaram esse volume irradiado para 3.01% e 7.35%, respectivamente, enquanto o IMPT convencional expôs 42.41% do sangue periférico à radiação.
Em seguida, os investigadores examinaram o nível de linfócitos circulantes que receberam uma dose de pelo menos 7 cGy – um limite que provoca uma depleção de 2% na população de linfócitos – durante todo o tratamento. Após completar o IMPT convencional, 25.65% dos linfócitos circulantes receberam dose de pelo menos 7 cGy. Para tratamentos FLASH de uma, duas e cinco frações, os volumes que receberam mais do que esse limite de dose foram 1.21%, 2.30% e 5.14%, respectivamente.
Os volumes de linfócitos circulantes que receberam doses superiores a 100 cGy, o que causa depleção de 30%, foram de 0.77%, 1.28% e 2.09% para FLASH de fração única, duas e cinco frações, respectivamente, e 0.10% durante IMPT convencional.
Galts e Hammi também estudaram a resposta dos linfócitos CD4+ e CD8+, que apresentam distribuições diferentes no sangue periférico, aos diversos cenários de irradiação. Para ambos os tipos de linfócitos, a morte celular após a primeira fração foi de 0.66%, 0.62%, 0.32% e 0.08% para FLASH de fração única, duas e cinco frações e IMPT convencional, respectivamente.
Modelo computacional determina dose no sangue durante radioterapia
Após o tratamento completo, a depleção de linfócitos foi de 1.02% e 1.56% para frações de dois e cinco tratamentos, respectivamente, e 2.14% para IMPT convencional. Essas descobertas demonstram que a terapia com prótons FLASH poupa as células imunes circulantes durante o tratamento intracraniano, com o FLASH de fração única reduzindo a taxa de depleção em quase 70% em comparação com o IMPT convencional.
Hammi conta Mundo da física que agora estão expandindo o modelo para incluir o câncer de cabeça e pescoço. “Além disso, estamos explorando vários métodos de administração de FLASH e seu impacto no esgotamento do sistema imunológico, com foco particular no tratamento FLASH conformado que se baseia na modulação de energia passiva específica do paciente”, explica ele. “Este modelo de entrega tem o potencial de poupar mais linfócitos circulantes em comparação com a entrega FLASH por disparo.”
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- :tem
- :é
- :não
- $UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- Acumulado
- exatamente
- Depois de
- Todos os Produtos
- quase
- tb
- an
- e
- SOMOS
- por aí
- AS
- avaliado
- associado
- At
- disponível
- baseado
- viga
- atrás
- sangue
- veias de sangue
- ambos
- Cérebro
- Cancer cerebral
- ramos
- mas a
- by
- calculado
- CAN
- Câncer
- pacientes com câncer
- cancros
- Causar
- causas
- célula
- Células
- circulantes
- Circulação
- clique
- Clinicamente
- comercialmente
- comparado
- completando
- considerando
- ao controle
- convencional
- poderia
- criado
- mais profunda
- entregue
- Entrega
- métodos de entrega
- demonstrar
- determina
- prejudicial
- diferente
- diretamente
- distribuição
- distribuições
- dosar
- doses
- durante
- dinâmico
- cada
- efeito
- energia
- Todo
- igual
- Equilíbrio
- estimado
- Éter (ETH)
- expansão
- Explica
- Explorado
- Explorando
- exposto
- Exposição
- RÁPIDO
- Campos
- descobertas
- Primeiro nome
- cinco
- Flash
- fluxo
- Foco
- seguinte
- Escolha
- formulário
- quatro
- fração
- da
- cheio
- totalmente
- mais distante
- Ganho
- Do grupo
- Growth
- Ter
- he
- Coração
- ajudar
- Alta
- esperança
- Como funciona o dobrador de carta de canal
- Contudo
- HTTPS
- humano
- imagem
- imagens
- imune
- Sistema imunológico
- Impacto
- melhorado
- IMPOSTO
- in
- incidente
- incluir
- incluído
- incorpora
- aumentou
- Individual
- INFORMAÇÕES
- insights
- para dentro
- investigar
- emitem
- IT
- jpg
- matança
- principal
- mínimo
- esquerda
- Nível
- mais
- max-width
- mecanismo
- medicina
- métodos
- minimizando
- modelo
- modelagem
- modelagem
- mais
- a maioria
- mr
- Notas
- agora
- observado
- of
- on
- ONE
- aberto
- or
- A Nossa
- Fora
- Acima de
- parâmetros
- particular
- passiva
- pacientes
- periférico
- Física
- Mundo da física
- plano
- planos
- platão
- Inteligência de Dados Platão
- PlatãoData
- pobre
- população
- potencial
- potencialmente
- propagação
- proporção
- proposto
- Radiação
- Radioterapia
- Taxa
- Preços
- realista
- recebido
- receber
- reduzir
- Reduzido
- reduz
- redução
- refletir
- relevante
- Relatórios
- pesquisadores
- respectivamente
- resposta
- resultando
- Revelado
- certo
- s
- diz
- exploração
- cenários
- esquemas
- gravidade
- mostrou
- de forma considerável
- solteiro
- começo
- estimular
- estratégias
- transmitir canais
- estudado
- Estudo
- tal
- Sugere
- .
- conta
- do que
- que
- A
- deles
- então
- teoria
- Terapêutico
- terapia
- Este
- deles
- isto
- três
- limiar
- Através da
- miniaturas
- tempo
- vezes
- para
- tratamento
- tratamento
- tratamentos
- verdadeiro
- tumor
- dois
- tipos
- Entendido
- universidade
- usava
- utilização
- vário
- Navio
- vasos
- volume
- volumes
- foi
- we
- foram
- quando
- se
- qual
- enquanto
- branco
- de
- dentro
- mundo
- amarelo
- ainda
- zefirnet