Todos os reagentes foram utilizados como recebidos, salvo indicação em contrário. Todos os produtos químicos foram adquiridos da Sigma Aldrich, exceto as contas de contagem (CountBright Absolute Counting Beads, Invitrogen). ζ-O potencial foi medido usando um Zetasizer NanoZS90 (Malvern Instruments). O tamanho e a morfologia das partículas foram estudados por MEV num microscópio JEOL JSM 7800F Prime com EDS integrado para fornecer a análise elementar. O tamanho de partícula foi determinado medindo 50 partículas independentes. A cromatografia de camada fina instantânea por rádio (ITLC) foi desenvolvida em papel de cromatografia de microfibra de vidro Agilent Technologies impregnado com ácido silícico e analisada usando um scanner Lablogic Flow-count TLC e um detector de tubo fotomultiplicador (PMT) BioScan B-FC-3200 usando o software Laura. A fase móvel ITLC era composta por ácido cítrico 0.175 M e citrato trissódico 0.325 M em água, salvo indicação em contrário. As amostras radioativas foram medidas usando um Capintec CRC-25R (Capintec) ou um LKB Wallac 1282 Compugamma CS (PerkinElmer) para os quais os dados foram coletados usando o software EdenTerm. Experimentos de citometria de fluxo foram realizados em um classificador de células BD FACSMelody usando o software BD FACSChorus. As imagens PET/CT foram adquiridas usando um scanner NanoPET/CT (Mediso), reconstruídas usando o software Nucline v.0.21, e as imagens foram analisadas usando o software VivoQuant (versão 3.5, InviCRO). Os dados do Listmode foram obtidos por uma ferramenta de software específica MATLAB desenvolvida pela Mediso. A autorradiografia foi realizada em um instrumento GE Amersham Typhoon.
Síntese de partículas de sílica de tamanho submicrométrico
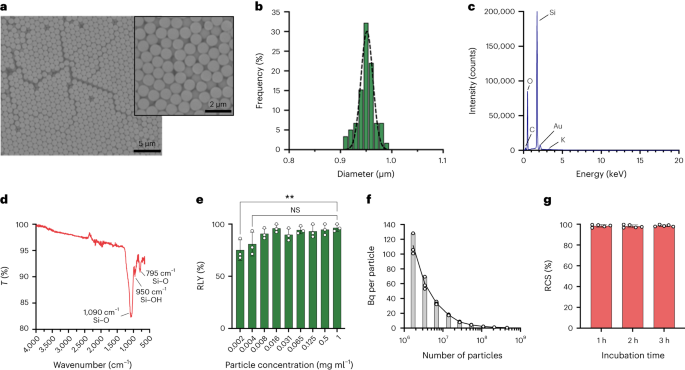
As partículas foram sintetizadas pelo método Stöber. Este método é baseado na hidrólise e condensação consecutiva de alcóxidos de silício para produzir partículas esféricas e monodispersas de sílica.27. Ortossilicato de tetraetila (TEOS) foi utilizado como fonte de silício, amônia como catalisador base e cloreto de potássio como eletrólito. Uma solução de TEOS em etanol foi adicionada continuamente a uma solução contendo o catalisador e o eletrólito. A modificação da quantidade inicial do reagente ou da taxa de adição proporciona diferenças no tamanho das partículas, conforme relatado anteriormente28. Aqui, duas soluções foram preparadas antes da síntese das partículas: Solução 1 contendo 19.0 mmol de TEOS em 33.3 ml de EtOH e Solução 2 contendo 0.23 mmol de KCl em 9 ml de amônia, 65 ml de EtOH e 6.75 ml de H2O. Para a síntese, a Solução 2 foi colocada em um balão de fundo redondo de 250 ml aquecido a 50 °C sob agitação a 300 rpm por 15 min. Em seguida, a Solução 1 foi adicionada gota a gota à Solução 2 (taxa de fornecimento 0.2 ml min-1). Após adição da Solução 1, as partículas obtidas foram purificadas por centrifugação a 18,300g por 3 min e lavado com EtOH cinco vezes. Finalmente, o SiO2 as micropartículas foram secas sob vácuo.
Enxerto de partículas de tamanho submicrométrico com silano – PEG5k
20 mg ml-1 solução de silano – PEG5k (Sigma Aldrich) em EtOH 98% foi adicionado sobre uma solução de smSiP a 5 mg ml-1 em EtOH 98% e 2.8% de amônia. A mistura foi agitada durante a noite à temperatura ambiente e as partículas foram recuperadas por centrifugação a 18,300g por 3 minutos. Finalmente, as partículas foram lavadas três vezes com água destilada e secas sob vácuo durante a noite. As soluções de lavagem foram liofilizadas durante a noite e a quantidade de silano-PEG não ligado5k ponderado para o cálculo do rendimento da reação. 0.05mg ml-1 solução de smSiP –PEG5k em água destilada foi empregado para reações de radiomarcação adicionais.
[68Ga]GaCl3
O gálio-68 foi eluído como [68Ga]GaCl3 de um Eckert e Ziegler 68Ge /68Gerador de Ga em HCl ultrapuro (4 ml, 0.1 M) fabricado de acordo com os requisitos de boas práticas de fabricação (ABX).
Concentração do [68Ga]GaCl3 eluição por troca catiônica
A concentração da eluição foi realizada utilizando a configuração descrita na Figura Suplementar. 1. Primeiro, os 4 ml do [68Ga]GaCl3 a eluição foi carregada em um cartucho Strata-XC 33u (Phenomenex) e o eluato foi descartado. Em seguida, o cartucho foi lavado com 5 ml de solução de acetona/HCl 0.1 M (80:20) e o eluato foi descartado. Finalmente, o concentrado [68Ga]GaCl3 foi coletado adicionando 700 µl de uma solução de acetona/HCl 0.05 M (98:2), seco sob N2 corrente e ressuspenso em 50 μl de tampão HEPES 0.5 M, (pH 4.9). O Radio-TLC foi realizado nas diferentes etapas para controle de qualidade. O protocolo leva aproximadamente 20 minutos, proporcionando um rendimento de recuperação de 86.2 ± 8.5%.
Radiomarcação de partículas de sílica em diferentes concentrações com 68Ga
Partículas de sílica foram ressuspensas em diferentes concentrações (de 1 a 0.002 mg ml-1) em tampão HEPES 0.5 M (pH 4.9). Em seguida, 50 µl da solução foram adicionados a um tubo de reação antes da adição do concentrado [68Ga]GaCl3 eluição em 50 µl de tampão HEPES 0.5 M (pH 4.9). As reações foram conduzidas a 90°C por 30min, e o radio-TLC foi realizado para calcular o rendimento radioquímico.
Medição da concentração de partículas por citometria de fluxo
As concentrações de partículas foram calculadas por citometria de fluxo utilizando esferas de contagem (CountBright Absolute Counting Beads, Invitrogen) seguindo as instruções do fabricante. Partículas de sílica foram ressuspensas a 0.05 mg ml-1, sonicado por 10 min e passado por um filtro de tamanho de corte de 10 μm (filtro de seringa KX, nylon, 25 mm, 10 μm). As Contas de Contagem Absoluta CountBright foram aquecidas à temperatura ambiente e agitadas em vórtex durante 30 segundos. Em seguida, 50 µl de esferas foram adicionados a 300 µl de partículas de sílica e a mistura foi agitada em vórtex por 30 min para obter uma solução homogênea. A amostra foi analisada no citômetro de fluxo e o limite de dispersão direta (FSC) foi definido para incluir as esferas e as partículas no gráfico de dispersão linear-FSC versus linear-lateral. Posteriormente, a voltagem do detector de fluorescência foi ajustada para as esferas de contagem e uma estratégia de gating foi realizada para isolar as partículas de sílica e as populações de esferas de contagem. Finalmente, foram desenhadas portas nas partículas e nas contas de contagem absoluta e 1,000 eventos de contas foram registrados para cada amostra. Usando esta estratégia, o número de partículas em solução foi calculado usando a seguinte equação:
$$begin{array}{l}displaystyle{mathrm{Absolute}},{mathrm{count}},left(frac{mathrm{Partículas}}{{{upmu l}}}right)=displaystylefrac{({mathrm{ Partículas}},{mathrm{contagem}},vezes,{mathrm{contagem}},{mathrm{contas}},{mathrm{volume}})}{({mathrm{contagem}},{mathrm{contas}} ,{mathrm{contagem}},vezes,{mathrm{Partículas}},{mathrm{volume}})} vezes,{mathrm{Contagem}},{mathrm{contas}},{mathrm{concentração}}esquerda(frac {{mathrm{Beads}}}{{{upmu l}}}direita)end{array}$$
Radiomarcação de 500 smSiP
Quinhentos smSiP foram adicionados a 50 µl do concentrado [68Ga]GaCl3 eluição em tampão HEPES 0.5 M pH 4.9. Em seguida, foram adicionados 5.6 µl de polissorbato 80 e a mistura foi aquecida a 90ºC por 30 minutos a 900 rpm em misturador térmico. Posteriormente, um protocolo final de purificação em múltiplas etapas foi projetado para remover 68Ga. Foram adicionados cinquenta microlitros de EDTA 10 mM e a mistura foi incubada 5 min à temperatura ambiente. Em seguida, as partículas foram centrifugadas por 3 min a 18,300g, ressuspenso em 500 µl de PBS contendo EDTA 1 mM + polissorbato 0.1 a 80% e agitado suavemente em vórtice por 10 s. As partículas foram centrifugadas novamente, lavadas com uma solução de EDTA 0.1 mM + polissorbato 0.1 a 80% em PBS e agitadas suavemente em vórtex por 10 s. Finalmente, as partículas foram centrifugadas e lavadas mais cinco vezes com PBS + polissorbato 0.1 a 80% e ressuspensas em 500 µl de PBS. A reação de radiomarcação foi monitorada por radio-TLC durante as sucessivas etapas de reação para avaliar a presença de colóides (que podem ser confundidos com partículas se não forem removidos adequadamente), a radiomarcação das partículas e a pureza do produto final. O RLY foi calculado por comparação entre a quantidade de radioatividade nas partículas e nos sobrenadantes após as etapas de lavagem.
Fracionamento
Para a estratégia de fracionamento, volumes de 0.5 µl a 20 µl do 68Ga-smSiP a uma concentração teórica de 1 partícula µl-1 foram adicionados em diferentes tubos de amostra em etapas de 1 µl (0.5, 1, 2, 3…) e PBS foi adicionado para levar o volume final a 50 µl. Em seguida, 37.5 µl do primeiro tubo foram pipetados para um segundo tubo de amostra, 25 µl do segundo tubo para um terceiro tubo e finalmente 12.5 µl do terceiro tubo para um quarto tubo. Esta estratégia fornece quatro tubos por amostra com um volume final de 12.5 µl por tubo. A radioatividade em cada tubo foi medida em um contador gama e os valores foram calculados em kBq por meio de uma curva de calibração, para posterior comparação e análise. As amostras contendo a maior parte da radioatividade em apenas um tubo foram sonicadas por 30 segundos em temperatura ambiente e submetidas a uma segunda etapa de fracionamento. Em seguida, as amostras nas quais toda a radioatividade foi encontrada em um único tubo (com atividade insignificante nos outros três tubos) foram utilizadas para novos experimentos in vivo/ex vivo.
Imagem fantasma PET/CT
Um experimento de imagem fantasma foi realizado com um 68Ga-smSiP. Uma cânula foi usada para entregar a partícula em um tubo de amostra para avaliar se uma única partícula poderia permanecer presa no tubo da cânula durante a administração. Resumidamente, o tubo fantasma foi colocado no scanner nanoPET/CT com a extremidade da ponta da cânula fixada ao tubo. Após o início da aquisição do PET, a partícula ressuspensa em 100 µl de PBS foi entregue com uma seringa de insulina acoplada ao início da cânula. Em seguida, a cânula foi lavada com 50 μl de PBS para garantir a entrega da partícula no tubo fantasma. A aquisição do PET foi realizada por 2 horas seguida por uma tomografia computadorizada padrão.
Imagens PET/CT in vivo
Os estudos de imagem em animais foram revisados eticamente e realizados de acordo com os regulamentos da Lei de Animais (Procedimentos Científicos) de 1986 (ASPA) do Ministério do Interior do Reino Unido que regem a experimentação animal. A imagem in vivo foi realizada em camundongos BALB/c saudáveis com 8 semanas de idade. Os animais foram anestesiados com isoflurano (2–3% em oxigênio), canulados e colocados na mesa do scanner sob anestesia. A cama foi aquecida a 37°C pelo fluxo de ar interno para manter o animal na temperatura corporal normal, e a frequência respiratória foi monitorada e mantida em 60-80 respirações min.-1 durante toda a varredura. Manter o controle da temperatura do animal é importante, pois uma queda inesperada de temperatura pode levar à redução da velocidade da partícula no sangue. Um 68Ga-smSiP (n = 4) ou 68Ga-smSiP–PEG5k partícula (n = 2) foi administrado através da cânula em 100 µl de PBS, seguido de lavagem com 50 µl de PBS após o início da aquisição PET (modo de coincidência 1:5; janela de tempo de coincidência de 5 ns). O PET foi gravado por 2 horas e, em seguida, foi realizada uma tomografia computadorizada semicircular. A temperatura corporal e a frequência respiratória dos animais foram monitoradas durante todo o processo. Imagens dinâmicas de PET/CT foram reconstruídas usando reconstrução Tera-Tomo 3D (janela de energia de 400–600 keV, modo de coincidência 1:5, 20 iterações e 1 subconjunto) em um tamanho de voxel de 0.4 × 0.4 × 0.4 mm3 e corrigido para atenuação, dispersão e decaimento. Os dados do modo lista para todas as aquisições PET/PEPT podem ser encontrados para 68Ga-smSiP na ref. 29 e para 68Ga-smSiP–PEG5k na ref. 30.
Rastreamento em tempo real
Primeiro, os dados foram exportados do scanner no formato listmode (ou seja, um formato com carimbo de data / hora e índice de cristal para fótons coincidentes detectados). Uma transformação geométrica foi aplicada para converter os índices de cristal para a posição em unidades mm. O método Birmingham calcula iterativamente o MDP a partir de um subconjunto de todos os LoRs. Ele faz isso descartando LoRs que estão a mais de uma distância definida do MDP, pois é provável que surjam de LoRs falsos, por exemplo, LoRs que podem se originar de dispersão. O MDP é refinado a cada iteração; o número de iterações é efetivamente definido pelo f-fator e refere-se ao número total de LoRs que são usados para estimar a posição final da partícula dentro desse subconjunto (por exemplo, um f-fator de 0.5 significa que o loop de iteração terminará quando 50% dos LoRs no subconjunto permanecerem). O número de LoRs usados em um subconjunto pode ser reduzido para melhorar a amostragem temporal (os subconjuntos são consecutivos no tempo sem sobreposição) ao custo de aumentar a incerteza na posição (mais detalhes do algoritmo podem ser encontrados em Parker et al.5) O método de Birmingham foi usado para analisar dados em modo de lista do scanner PET. Um tamanho de amostra adaptativo foi usado para rastrear a partícula nos ratos. O tamanho da amostra foi definido para alcançar um equilíbrio de amostragem temporal suficiente, minimizando erros de posicionamento. Um tamanho de amostra entre 100 e 200 LoRs foi usado nos estágios iniciais das varreduras (<60 segundos do início da varredura), com f = 0.1, produzindo intervalos de aproximadamente 1–5s. Em tempos de varredura> 60 s, os tamanhos das amostras variaram entre 1,000 e 2,000, o que rendeu intervalos de tempo entre 30 s e 60 s, dependendo do experimento in vivo. O número de contagens usadas para calcular o MDP (na iteração final) pode ser encontrado multiplicando o tamanho da amostra pelo f-valor do fator. Esses parâmetros foram baseados em experiências anteriores e informados por publicações anteriores1.
A velocidade foi obtida como (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) onde ({v}_{m}^{2}) é a velocidade no x, y e z direções.
Captação de órgãos ex vivo
A captação em diferentes órgãos foi avaliada por contagem gama. Após a imagem PET/CT in vivo, os animais foram mortos por deslocamento cervical e os órgãos excisados e pesados para contagem de radioatividade em contador gama (LKB Wallac 1282 Compugamma CS). Os dados foram expressos como porcentagem da dose injetada (dose no órgão/dose total injetada) por grama de tecido (%ID g-1).
Autoradiografia
A radioatividade nos pulmões foi rastreada com um detector de radiação (sonda EP15, Morgan), e os pulmões foram cortados em pequenas seções com um bisturi até que uma pequena porção de tecido com o sinal radioativo fosse obtida. O tecido foi congelado em isopropanol a -80 °C. Imediatamente após o congelamento, o tecido foi embebido em meio de temperatura ideal de corte e cortado em criostato em fatias de 20 µm. Cada fatia foi examinada com o detector até que a fatia radioativa fosse encontrada. A fatia anterior (abaixo do fundo), radioativa e seguinte (abaixo do fundo) foram colocadas em uma lâmina de microscópio Superfrost (Epredia). O resto do tecido restante também estava abaixo do fundo. A lâmina do microscópio com as três secções foi coberta com película aderente e colocada em oposição a uma placa de autorradiografia GE durante a noite. A placa foi analisada usando GE Amersham Typhoon com resolução de 25 µm e configuração PMT de 4,000. A imagem da autorradiografia foi sobreposta à imagem do tecido, mostrando um ponto de radioatividade no corte radioativo. Para a quantificação, foram preparados padrões em diferentes atividades conhecidas, e cada um foi identificado como quinteto de 1 µl em papel. As manchas foram incubadas na mesma tela de fósforo de armazenamento, BAS-IP MS (Multipurpose Standard) da GE como as partículas individuais quantificadas. A imagem foi adquirida com o Amersham Typhoon 5 com Control Software versão 2.0 no modo fósforo com tamanho de pixel de 100 µm e sensibilidade de 4,000. As imagens foram quantificadas com o software ImageQantTL v10.0-261 utilizando a caixa de ferramentas de quantificação de gel. As manchas foram corrigidas escolhendo uma região imediatamente antes ou depois da mancha como fundo constante. O volume resultante da mancha foi utilizado para calcular o Bq na partícula com base na curva de calibração.
Estatística e reprodutibilidade
Para análise quantitativa, foram analisadas no mínimo três réplicas biológicas, excluindo os dados in vivo de 68Ga-smSiP–PEG5k (n = 2). Os dados foram analisados por análise de variância unidirecional ordinária (ANOVA) com teste de comparações múltiplas de Dunnett e teste de Student. t-teste. A P valor <0.05 foi considerado estatisticamente significativo.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://www.nature.com/articles/s41565-023-01589-8
- :é
- :não
- :onde
- ][p
- 000
- 1
- 10
- 100
- 12
- 15%
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- absoluto
- conformidade
- Alcançar
- adquirido
- aquisição
- aquisições
- Aja
- atividades
- atividade
- adaptativo
- adicionado
- acrescentando
- Adição
- Ajustado
- administrado
- administração
- avanços
- Depois de
- depois
- novamente
- AR
- AL
- algoritmo
- Todos os Produtos
- tb
- Amônia
- quantidade
- an
- análise
- análise
- Apresentadora
- e
- animal
- animais
- aplicado
- aproximadamente
- SOMOS
- surgir
- AS
- At
- b
- fundo
- Equilíbrio
- base
- baseado
- base
- BD
- BE
- antes
- Começo
- abaixo
- entre
- Birmingham
- sangue
- corpo
- brevemente
- trazer
- amortecer
- by
- calcular
- calculado
- calcula
- Cálculo
- CAN
- transportado
- Catalisador
- célula
- produtos químicos
- escolha
- clique
- coincidência
- comparação
- comparações
- composta
- Concentrado
- concentração
- conduzido
- confuso
- consecutivo
- considerado
- constante
- continuamente
- ao controle
- controlado
- converter
- corrigida
- Custo
- poderia
- Contador
- contando
- coberto
- Cristal
- cs
- curva
- Cortar
- corte
- dados,
- entregar
- entregue
- Entrega
- Dependendo
- descrito
- projetado
- detalhes
- detectou
- determinado
- desenvolvido
- diferenças
- diferente
- instruções
- luxação
- distância
- parece
- dosar
- desenhado
- Cair
- durante
- dinâmico
- e
- E & T
- cada
- Cedo
- efetivamente
- eletrólito
- incorporado
- emissão
- empregada
- final
- energia
- Engenharia
- garantir
- equipamento
- erros
- estimativa
- Éter (ETH)
- avaliar
- avaliadas
- eventos
- exemplo
- Exceto
- excluindo
- vasta experiência
- experimentar
- experimentos
- expressa
- falso
- Figo
- Filme
- filtro
- final
- Finalmente
- Primeiro nome
- cinco
- fluxo
- seguido
- seguinte
- Escolha
- formato
- para a frente
- encontrado
- quatro
- Quarto
- congelamento
- da
- congelado
- FSC
- mais distante
- Portões
- ge
- gerador
- vidro
- Bom estado, com sinais de uso
- governando
- Grama
- Growth
- saudável
- SUA PARTICIPAÇÃO FAZ A DIFERENÇA
- Início
- Home Office
- HTTPS
- if
- imagem
- imagens
- Imagiologia
- imediatamente
- importante
- melhorar
- in
- incluir
- aumentando
- incubado
- de treinadores em Entrevista Motivacional
- índice
- Índices
- informado
- instantâneos
- instruções
- instrumento
- instrumentos
- integrado
- Interface
- interno
- para dentro
- IT
- iteração
- iterações
- Guarda
- conhecido
- Kx
- conduzir
- Provável
- LINK
- Pulmões
- manutenção
- fabricado
- fabrica
- material
- Posso..
- significa
- medido
- medição
- média
- método
- métodos
- camundongos
- mícron
- Microscópio
- minutos
- minimizando
- mínimo
- conjugar
- mistura
- ML
- Móvel Esteira
- Moda
- monitorados
- mais
- Morgan
- a maioria
- MS
- múltiplo
- multiplicando
- nanotecnologia
- Natureza
- Próximo
- não
- normal
- número
- obter
- obtido
- of
- Office
- on
- ONE
- só
- contrário
- ideal
- or
- comum
- Outros
- de outra forma
- Fora
- Acima de
- durante a noite
- Oxygen
- Papel
- parâmetros
- partícula
- passou
- PBS
- para
- percentagem
- realizada
- animal de estimação
- fantasma
- fase
- fóton
- fotografia
- pixels
- colocado
- platão
- Inteligência de Dados Platão
- PlatãoData
- populações
- parte
- posição
- posicionamento
- positron
- prática
- preparado
- presença
- anterior
- anteriormente
- Prime
- Prévio
- sonda
- procedimentos
- processo
- produzir
- Produto
- devidamente
- protocolo
- fornecer
- fornece
- fornecendo
- comprado
- qualidade
- quantificação
- quantitativo
- quantidade
- R
- Radiação
- Rádio
- alcance
- Taxa
- reação
- reações
- em tempo real
- recebido
- recentemente
- gravado
- recuperação
- Reduzido
- redução
- referência
- refinado
- região
- regulamentos
- relaciona
- permanecem
- remanescente
- remover
- Removido
- replica
- Requisitos
- Resolução
- DESCANSO
- resultando
- rever
- Comentários
- Quarto
- Execute
- s
- mesmo
- digitalização
- exploração
- digitaliza
- SCI
- científico
- Peneira
- Segundo
- segundo
- seções
- SEM
- Sensibilidade
- conjunto
- contexto
- instalação
- mostrando
- Sigma
- Signal
- periodo
- Silício
- solteiro
- Tamanho
- tamanhos
- Fatia
- slide
- pequeno
- estalo
- Software
- solução
- Soluções
- fonte
- específico
- Spot
- pontos
- Estágio
- padrão
- padrões
- começo
- Comece
- estabelecido
- estatisticamente
- Passo
- Passos
- armazenamento
- Estratégia
- transmitir canais
- estudado
- caso
- Estudando
- suficiente
- supply
- inquiridas
- síntese
- toma
- técnica
- Tecnologias
- teste
- do que
- que
- A
- então
- teórico
- térmico
- Este
- Terceiro
- isto
- três
- limiar
- Através da
- todo
- tempo
- vezes
- timestamp
- tipo
- tecido
- para
- ferramenta
- Caixa de ferramentas
- Total
- pista
- Rastreamento
- Transformação
- preso
- dois
- Uk
- Incerteza
- para
- Inesperado
- unidades
- até
- usava
- utilização
- Vácuo
- valor
- Valores
- Velocidade
- versão
- Contra
- vivo
- Voltagem
- volume
- volumes
- Voxel
- W
- foi
- lavagem
- Água
- foram
- quando
- se
- qual
- enquanto
- inteiro
- precisarão
- janela
- de
- dentro
- Produção
- rendido
- produzindo
- zefirnet
- Zip