16 de janeiro de 2024
(Notícias do Nanowerk) Uma reação química chave - na qual o movimento de prótons entre a superfície de um eletrodo e um eletrólito aciona uma corrente elétrica - é um passo crítico em muitas tecnologias energéticas, incluindo células de combustível e os eletrolisadores usados para produzir gás hidrogênio. Pela primeira vez, os químicos do MIT mapearam em detalhes como essas transferências de elétrons acoplados a prótons acontecem na superfície de um eletrodo. Seus resultados podem ajudar os pesquisadores a projetar células de combustível, baterias ou outras tecnologias energéticas mais eficientes. “Nosso avanço neste artigo foi estudar e compreender a natureza de como esses elétrons e prótons se acoplam em um local de superfície, o que é relevante para reações catalíticas que são importantes no contexto de dispositivos de conversão de energia ou reações catalíticas”, diz Yogesh Surendranath, pesquisador professor de química e engenharia química no MIT e autor sênior do estudo. Entre suas descobertas, os pesquisadores conseguiram rastrear exatamente como as mudanças no pH da solução eletrolítica ao redor de um eletrodo afetam a taxa de movimento de prótons e o fluxo de elétrons dentro do eletrodo. O estudante de pós-graduação do MIT, Noah Lewis, é o autor principal do artigo, que aparece hoje em Nature Chemistry (“Uma estrutura mecanística de nível molecular para cinética interfacial de transferência de elétrons acoplados a prótons”). Ryan Bisbey, ex-pós-doutorado do MIT; Karl Westendorff, estudante de pós-graduação do MIT; e Alexander Soudackov, cientista pesquisador da Universidade de Yale, também são autores do artigo.
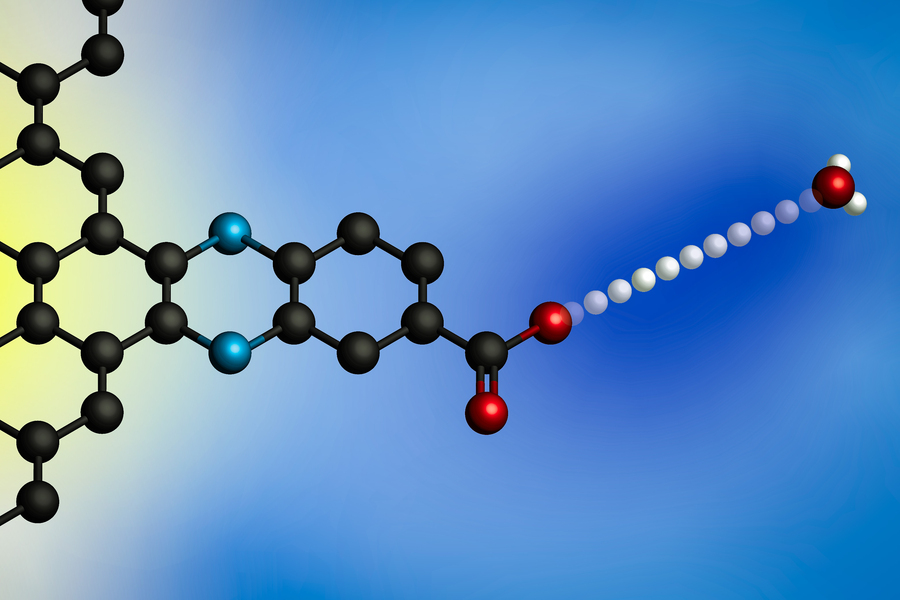 A aplicação de um potencial elétrico faz com que um próton seja transferido de um íon hidrônio (à direita) para a superfície de um eletrodo. Usando eletrodos com locais de ligação de prótons definidos molecularmente, os pesquisadores do MIT desenvolveram um modelo geral para essas reações interfaciais de transferência de elétrons acoplados a prótons. (Imagem: Cortesia dos pesquisadores)
A aplicação de um potencial elétrico faz com que um próton seja transferido de um íon hidrônio (à direita) para a superfície de um eletrodo. Usando eletrodos com locais de ligação de prótons definidos molecularmente, os pesquisadores do MIT desenvolveram um modelo geral para essas reações interfaciais de transferência de elétrons acoplados a prótons. (Imagem: Cortesia dos pesquisadores)
 A aplicação de um potencial elétrico faz com que um próton seja transferido de um íon hidrônio (à direita) para a superfície de um eletrodo. Usando eletrodos com locais de ligação de prótons definidos molecularmente, os pesquisadores do MIT desenvolveram um modelo geral para essas reações interfaciais de transferência de elétrons acoplados a prótons. (Imagem: Cortesia dos pesquisadores)
A aplicação de um potencial elétrico faz com que um próton seja transferido de um íon hidrônio (à direita) para a superfície de um eletrodo. Usando eletrodos com locais de ligação de prótons definidos molecularmente, os pesquisadores do MIT desenvolveram um modelo geral para essas reações interfaciais de transferência de elétrons acoplados a prótons. (Imagem: Cortesia dos pesquisadores)
Passando prótons
A transferência de elétrons acoplada a prótons ocorre quando uma molécula, geralmente água ou ácido, transfere um próton para outra molécula ou para a superfície de um eletrodo, o que estimula o aceitador de prótons a também captar um elétron. Este tipo de reação tem sido aproveitado para muitas aplicações energéticas. “Essas reações de transferência de elétrons acopladas a prótons são onipresentes. Freqüentemente, são etapas importantes nos mecanismos catalíticos e são particularmente importantes para processos de conversão de energia, como geração de hidrogênio ou catálise de células de combustível”, diz Surendranath. Em um eletrolisador gerador de hidrogênio, esta abordagem é usada para remover prótons da água e adicionar elétrons aos prótons para formar gás hidrogênio. Numa célula de combustível, a eletricidade é gerada quando prótons e elétrons são removidos do gás hidrogênio e adicionados ao oxigênio para formar água. A transferência de elétrons acoplada a prótons é comum em muitos outros tipos de reações químicas, por exemplo, na redução do dióxido de carbono (a conversão do dióxido de carbono em combustíveis químicos pela adição de elétrons e prótons). Os cientistas aprenderam muito sobre como estas reações ocorrem quando os aceitadores de prótons são moléculas, porque podem controlar com precisão a estrutura de cada molécula e observar como os elétrons e os prótons passam entre elas. No entanto, quando a transferência de elétrons acoplados a prótons ocorre na superfície de um eletrodo, o processo é muito mais difícil de estudar porque as superfícies dos eletrodos são geralmente muito heterogêneas, com muitos locais diferentes aos quais um próton poderia potencialmente se ligar. Para superar esse obstáculo, a equipe do MIT desenvolveu uma maneira de projetar superfícies de eletrodos que lhes proporciona um controle muito mais preciso sobre a composição da superfície do eletrodo. Seus eletrodos consistem em folhas de grafeno com compostos orgânicos contendo anéis fixados à superfície. No final de cada uma dessas moléculas orgânicas há um íon de oxigênio carregado negativamente que pode aceitar prótons da solução circundante, o que faz com que um elétron flua do circuito para a superfície grafítica. “Podemos criar um eletrodo que não consiste em uma grande diversidade de locais, mas é um conjunto uniforme de um único tipo de locais muito bem definidos, cada um deles capaz de se ligar a um próton com a mesma afinidade”, diz Surendranath. “Como temos esses locais muito bem definidos, o que isso nos permitiu fazer foi realmente desvendar a cinética desses processos.” Usando este sistema, os pesquisadores conseguiram medir o fluxo de corrente elétrica para os eletrodos, o que lhes permitiu calcular a taxa de transferência de prótons para o íon de oxigênio na superfície em equilíbrio – o estado em que as taxas de doação de prótons para a superfície e a transferência de prótons de volta à solução a partir da superfície são iguais. Eles descobriram que o pH da solução circundante tem um efeito significativo nesta taxa: as taxas mais altas ocorreram nos extremos da escala de pH – pH 0, o mais ácido, e pH 14, o mais básico. Para explicar esses resultados, os pesquisadores desenvolveram um modelo baseado em duas possíveis reações que podem ocorrer no eletrodo. 3O+), que estão em alta concentração em soluções fortemente ácidas, entregam prótons aos íons de oxigênio da superfície, gerando água. No segundo, a água entrega prótons aos íons de oxigênio da superfície, gerando íons hidróxido (OH-), que estão em alta concentração em soluções fortemente básicas. No entanto, a taxa em pH 0 é cerca de quatro vezes mais rápida do que a taxa em pH 14, em parte porque o hidrônio cede prótons a uma taxa mais rápida que a água.Uma reação para reconsiderar
Os pesquisadores também descobriram, para sua surpresa, que as duas reações têm taxas iguais não em pH neutro 7, onde as concentrações de hidrônio e hidróxido são iguais, mas em pH 10, onde a concentração de íons hidróxido é 1 milhão de vezes maior que a do hidrônio. O modelo sugere que isso ocorre porque a reação direta envolvendo a doação de prótons do hidrônio ou da água contribui mais para a taxa geral do que a reação inversa envolvendo a remoção de prótons pela água ou hidróxido. Os modelos existentes de como estas reacções ocorrem nas superfícies dos eléctrodos assumem que as reacções directas e inversas contribuem igualmente para a taxa global, pelo que as novas descobertas sugerem que esses modelos podem precisar de ser reconsiderados, dizem os investigadores. “Essa é a suposição padrão, de que as reações direta e reversa contribuem igualmente para a taxa de reação”, diz Surendranath. “Nossa descoberta é realmente reveladora porque significa que a suposição que as pessoas estão usando para analisar tudo, desde a catálise de células de combustível até a evolução do hidrogênio, pode ser algo que precisamos revisitar.” Os pesquisadores estão agora usando sua configuração experimental para estudar como a adição de diferentes tipos de íons à solução eletrolítica ao redor do eletrodo pode acelerar ou desacelerar a taxa de fluxo de elétrons acoplados a prótons. “Com o nosso sistema, sabemos que os nossos locais são constantes e não afetam uns aos outros, por isso podemos ler o que a mudança na solução está a fazer com a reação na superfície”, diz Lewis.- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://www.nanowerk.com/news2/green/newsid=64425.php
- :tem
- :é
- :não
- :onde
- $UP
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Capaz
- Sobre
- ACEITAR
- adicionar
- adicionado
- acrescentando
- avançar
- afetar
- afetando
- Alexander
- permitidas
- tb
- entre
- an
- analisar
- e
- Outro
- aparece
- aplicações
- Aplicando
- abordagem
- SOMOS
- Ordem
- AS
- assumir
- suposição
- At
- autor
- autores
- em caminho duplo
- baseado
- basic
- baterias
- BE
- Porque
- sido
- entre
- vincular
- obrigatório
- mas a
- by
- calcular
- CAN
- carbono
- gás carbônico
- causas
- célula
- Células
- Centralização de
- alterar
- Alterações
- carregada
- químico
- química
- Químicos
- comum
- composição
- concentração
- constante
- contexto
- contribuir
- contribui
- ao controle
- Conversão
- poderia
- Casal
- crio
- crítico
- Atual
- Data
- acordo
- Padrão
- definido
- entregar
- entrega
- Design
- detalhe
- desenvolvido
- Dispositivos/Instrumentos
- diferente
- difícil
- descoberto
- Diversidade
- do
- Não faz
- fazer
- doação
- down
- Acionadores
- cada
- efeito
- eficiente
- Elétrico
- eletricidade
- eletrólito
- elétrons
- final
- termina
- energia
- Engenharia
- igual
- igualmente
- Equilíbrio
- Éter (ETH)
- tudo
- evolução
- exatamente
- exemplo
- existente
- experimental
- Explicação
- extremo
- mais rápido
- descoberta
- descobertas
- Primeiro nome
- primeira vez
- fluxo
- Escolha
- formulário
- Antigo
- para a frente
- encontrado
- quatro
- Quadro
- da
- Combustível
- células de combustível
- combustíveis
- GAS
- Geral
- gerado
- gerando
- geração
- dá
- pós-graduação
- Grafeno
- ótimo
- acontecer
- arreado
- Ter
- Coração
- ajudar
- Alta
- mais
- Como funciona o dobrador de carta de canal
- Contudo
- HTTPS
- hidrogênio
- imagem
- importante
- in
- Incluindo
- para dentro
- envolvendo
- IT
- jpg
- karl
- Chave
- Tipo
- Saber
- conduzir
- aprendido
- Lewis
- muitos
- Posso..
- significa
- a medida
- mecanismos
- Coração
- milhão
- MIT
- graduado do MIT
- modelo
- modelos
- molécula
- mais
- mais eficiente
- a maioria
- movimento
- movimento
- muito
- Natureza
- você merece...
- negativamente
- Neutro
- Novo
- Noah
- agora
- observar
- obstáculo
- ocorrer
- ocorreu
- of
- frequentemente
- on
- or
- orgânico
- Outros
- A Nossa
- Fora
- Acima de
- global
- Superar
- Oxygen
- Papel
- parte
- particularmente
- passar
- Pessoas
- platão
- Inteligência de Dados Platão
- PlatãoData
- possível
- potencial
- potencialmente
- preciso
- justamente
- processo
- processos
- produzir
- Professor
- prótons
- Taxa
- Preços
- reação
- reações
- Leia
- clientes
- redução
- relevante
- remoção
- remover
- Removido
- Renováveis
- energia renovável
- pesquisa
- pesquisadores
- Resultados
- revela
- reverso
- certo
- Ryan
- s
- mesmo
- dizer
- diz
- Escala
- Cientista
- cientistas
- Segundo
- senior
- instalação
- periodo
- solteiro
- local
- Locais
- lento
- So
- solução
- Soluções
- algo
- velocidade
- Estado
- Passo
- Passos
- estimula
- discordaram
- estrutura
- estudante
- Estudo
- Estudando
- tal
- sugerir
- Sugere
- superfície
- surpresa
- Em torno da
- .
- Tire
- Profissionais
- Tecnologias
- do que
- que
- A
- O Estado
- deles
- Eles
- Este
- deles
- isto
- aqueles
- tempo
- vezes
- para
- hoje
- traçar
- transferência
- fáceis
- dois
- tipo
- tipos
- onipresente
- compreensão
- universidade
- desemaranhar
- us
- usava
- utilização
- geralmente
- muito
- foi
- Água
- Caminho..
- we
- bem definido
- foram
- O Quê
- quando
- qual
- Largo
- de
- dentro
- zefirnet