O Instituto Nacional de Padrões e Tecnologia dos EUA (NIST) divulgou em 8 de dezembro diretrizes convidando comentários sobre o uso de março nos direitos. O estagiário da SpicyIP, Jyotpreet Kaur, escreve sobre esses direitos, as mudanças propostas nas diretrizes e a posição da Índia sobre acordos semelhantes. Esta postagem foi escrita com contribuições de Swaraj. Jyotpreet é um estudante de direito do terceiro ano da National Law University, Delhi, que está interessado em Direitos de Propriedade Intelectual e Direito da Concorrência e procura estudar sua interação entre si. Suas postagens anteriores podem ser acessadas SUA PARTICIPAÇÃO FAZ A DIFERENÇA.

Revisão dos EUA sobre os direitos da marcha e algumas perguntas sobre uma contraparte indiana
Por Jyotpreet Kaur
Como muitos leitores saberão, o governo dos EUA, especialmente através do gabinete do seu Representante Comercial dos EUA, vinha perseguindo a Índia durante anos depois de ter sido concedida uma única licença compulsória, sujeita a muito escrutínio judicial. Foi apenas durante a COVID-19 que essa pressão parou de ser aplicada tão descaradamente (com uma mudança para “segredos comerciais”). Numa reviravolta muito interessante, parece que os EUA estão agora a avançar em direcção a directrizes que expandam a forma como os EUA podem aplicar a sua própria versão de licenças compulsórias, também conhecidas como Direitos de “March-in”, a nível interno! Parece que a pressão interna resultante dos custos cada vez maiores dos cuidados de saúde atingiu um ponto em que há finalmente uma reavaliação da forma como o seu sistema de patentes está a afectar os custos. Em 8 de dezembro, o Instituto Nacional de Padrões e Tecnologia (NIST) divulgou o rascunho orientações solicitando comentários sobre o uso dos direitos “March-In” em prol do objetivo da administração Biden de reduzir os preços dos medicamentos. De acordo com o NIST, o governo dos EUA investe aproximadamente 115 mil milhões de dólares em I&D através de várias universidades, organizações sem fins lucrativos e empresas. Os direitos de entrada são disposições que permitem ao governo exigir licença para invenções decorrentes deste investimento, mediante o cumprimento de determinadas condições. Notavelmente, embora a “ameaça” dos direitos do March-In tenha sido mencionada antes, eles não foram efectivamente exercidos nos 44 anos desde que a lei governante entrou em vigor. O objetivo deste projeto de diretrizes parece ser a expansão dos critérios sob os quais os direitos de Marcha podem ser exercidos. O Secretário de Saúde e Serviços Humanos dos EUA saudado isso como uma “ferramenta poderosa para garantir que o contribuinte americano obtenha um retorno justo sobre seu investimento”,
Equilibrando inovação e interesse público: os objetivos da Lei Bayh-Dole em relação aos direitos da marcha
A Lei Bayh-Dole, promulgada em 1980, trouxe à tona, entre outras coisas, os direitos de “entrada” do governo federal. Tal como mencionado acima, os direitos de entrada são semelhantes às medidas inerentes à disposição do governo, caso aqueles que desenvolvem DPI a partir de investigação financiada pelo governo não tenham comercializado adequadamente a propriedade intelectual. Ao exercer este poder, os governos estão autorizados a intervir e direcionar a utilização dos DPI ou licenciá-los a terceiros. A propriedade da patente permanece com o instituto – é apenas um direito de licença a terceiros que é acumulado em favor do governo se este decidir exercer esse direito. O objetivo deste direito é permitir que o governo realize plenamente o potencial dos DPI financiados pelo setor público em questão, caso esteja sendo subutilizado pelo instituto do inventor.
O exercício dos direitos de entrada ao abrigo da Lei Bayh-Dole está previsto no 35 U.S.C. § 203, que exige o cumprimento de 4 critérios legais. Estas são (i) não conseguir concretizar eficazmente o tema inovação; (ii) a necessidade de aliviar necessidades de saúde ou segurança não atendidas; (iii) descumprimento dos requisitos de uso público da invenção; e (iv) incumprimento das obrigações contratuais, especialmente ao abrigo do s. 204., que exige que os produtos patenteados sejam significativamente fabricados nos EUA até que seja comercialmente inviável.
Até à data, os direitos de marcha não foram exercidos pelo Governo dos EUA, apesar das petições que solicitam o mesmo. A primeira vez que uma petição foi apresentada para o exercício dos direitos do March-in foi em sobre CellPro onde o Governo se recusou a exercer este direito. Esta tendência tem-se mantido até à data, como se pode verificar pela oito petições que foram arquivados perante o NIH e foram descartados.
Renovando os direitos da marcha: uma receita para o desastre ou uma fórmula de sucesso?
Uma das mudanças introduzidas através das diretrizes foi esclarecer o processo informal de consulta da agência com o contratante antes do exercício dos direitos de entrada e aumentar o prazo permitido que uma agência tem para responder ao contratante após a consulta informal de 60 dias a 120 dias.
Além disso, as novas diretrizes introduzem um método de três etapas que parece esclarecer o processo de invocar os direitos de marcha (ver imagem). Em primeiro lugar, verifica-se se a Lei Bayh-Dole se aplica às invenções em questão – aqui, verifica-se se as referidas invenções são “invenções sujeitas” e se são financiadas pelo governo. Em segundo lugar, se algum dos quatro critérios legais acima mencionados é aplicável ao caso em apreço e, por último, se o exercício dos direitos de entrada está em conformidade com o espírito geral da legislação Bayh-Dole e com os seus objetivos.
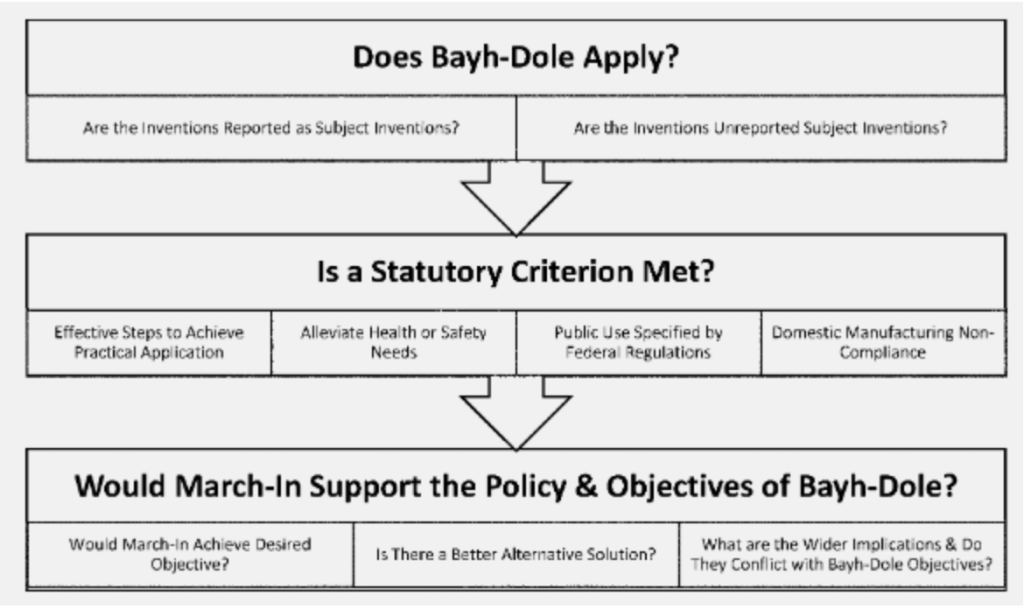
Talvez a mudança mais importante seja vista na segunda etapa, ao invocar o 1º critério legal, ou seja, quando o titular da patente não conseguiu ou deixará de tomar medidas efetivas para a realização da “inovação em questão” em seu campo de uso. As diretrizes acrescentaram uma consideração de fatores que podem “limitar injustificadamente a disponibilidade da invenção ao público”. Aqui, as directrizes introduziram um requisito de preços razoáveis que anteriormente não era reconhecido como um critério para o exercício dos direitos de “entrada”. As diretrizes implicam questionar se “o contratante ou licenciado disponibilizou o produto apenas para um conjunto restrito de consumidores ou clientes devido aos preços elevados”.
Isto contrasta com a posição anterior do governo, que pode ser evidenciada pelas suas anteriores interações com preços elevados como base para exercer a marcha. Em 2004, o peticionário instou o NIH a invocar esta medida devido ao elevado preço de um medicamento para o tratamento do VIH denominado Norvir e um medicamento para tratamento de glaucoma intitulado Xalatan. Em 2012, a preocupação com o elevado preço do Norvir foi levantado novamente perante o NIH. Mais uma vez, em 2016, os peticionários manifestaram preocupações em torno do elevado preço do Xtandi medicamento que custa cerca de 98 dólares por comprimido, em comparação com outros países de rendimento elevado. No entanto, em todos estes casos, o NIH recusou-se a exercer os seus direitos de entrada simplesmente com base nos preços, citando outras razões para recusar fazê-lo.
Quando as directrizes falam sobre preços razoáveis, não abordam o que pode ser um preço “razoável”, deixando isto ao critério do governo federal.
Os proponentes saudam estas directrizes como medidas progressivas para tornar os medicamentos exorbitantes mais acessíveis ao público americano em geral e para devolver ao público o que é “legitimamente” deles, uma vez que a investigação financiada pelo governo federal é essencialmente coberta com o dinheiro dos contribuintes.
Por outro lado, aqueles que se opõem às directrizes argumentam que estas são contrárias aos objectivos da Lei Bayh-Dole, uma vez que a fixação de preços nunca foi considerada como base para o exercício dos direitos de “March-in”. A Câmara de Comércio dos EUA chamou estas directrizes de uma forma de “confisco governamental”. Outros argumentam que tal cláusula inibiria a inovação e a concorrência – que são os objectivos principais da Lei. Alguns argumentaram que o objectivo da Lei era encorajar a colaboração entre os sectores público e privado com o objectivo de introduzir ideias novas no mercado, ao contrário do que as actuais directrizes procuram alcançar – o alívio dos problemas de acesso aos medicamentos e das ineficiências do mercado. Joseph Allen também argumentou que estas directrizes são uma “pílula venenosa”, pois embora se destinem a atingir as “grandes empresas farmacêuticas”, acabarão por prejudicar os pequenos inventores que estão efectivamente abrangidos pela Lei Bayh-Dole porque a maior parte das “grandes empresas farmacêuticas” 'a pesquisa não é financiada pelo governo. Ao mesmo tempo, argumenta que estas directrizes foram formuladas tendo em conta (apenas) os elevados preços dos medicamentos e ignorando que o Bayh-Dole também abrange outras indústrias, como a energia, a agricultura e a protecção do ambiente, que serão agora afectadas pela adversidades dessas diretrizes.
O que está acontecendo na frente indiana?
Agora que este debate está a ser levado mais a sério nos EUA, terá isto algum efeito de repercussão na Índia? Embora as flexibilidades de patentes no papel da Índia sejam bastante robustas, e algumas, como a Secção 3(d), tenham feito sentir a sua presença, ainda não vimos a tradução ou prática de muitas outras disposições em efeitos no mundo real. Por exemplo, embora tenha havido discussões sobre licenças compulsórias para algumas outras drogas, nada resultou dessas discussões. Não está claro até que ponto isto se deve a pressões externas, por exemplo, vários ALC e, claro, o USTR; e quanto disso se deve possivelmente a outros motivos. Por exemplo, embora a Índia estivesse entre os que estavam na linha da frente ao pedir isenções de PI durante a pandemia de Covid-19, ironicamente, a nível interno, embora o Governo tivesse uma número de opções que poderia ter tomado, não foram tomadas muitas medidas. Por exemplo, o Governo não forneceu clareza sobre a propriedade dos DPI (Covaxin) e o seu ato de “conceder aprovação” ao Instituto Haffkine foi algo que deveria ter sido prejudicado pelo interesse público no “direito à saúde”, como tem sido argumentado SUA PARTICIPAÇÃO FAZ A DIFERENÇA e SUA PARTICIPAÇÃO FAZ A DIFERENÇA. Da mesma forma, o governo indiano recusou-se a divulgar os dados dos ensaios clínicos através do RTI, citando a Secção 8(1)(d) e (e) que prevê os DPI como fundamento para isentar a divulgação. O Estado invocou a protecção dos DPI ao rejeitar a publicação de dados sem se envolver no acto de equilíbrio de pesar esta protecção contra o interesse público em jogo (que também foi previsto no S. 39(3) do TRIPS). Assim, o Estado não conseguiu exercer a sua própria PI de forma aberta, em contraste com a sua posição internacional.
Independentemente disso, a discussão interna dos EUA sobre algo contra o qual assumiram fortes posições internacionais até à data, é um desenvolvimento interessante a seguir. Internamente, o Departamento de Biotecnologia lançou recentemente o seu próprio conjunto de diretrizes de PI para invenções decorrentes do financiamento do DBT. Como isso funciona e marca o início de outra tentativa de ressuscitar a fracassada “Lei de Proteção e Utilização de Propriedade Intelectual com Financiamento Público”? Ao mesmo tempo, o Governo apresentou a Política Nacional de Pesquisa e Desenvolvimento e Inovação no Setor Pharma-MedTech (veja o projeto de política SUA PARTICIPAÇÃO FAZ A DIFERENÇA) em Setembro de 2023 para “transformar” o sector farmacêutico da Índia e “catalisar” a I&D nestes sectores de uma forma dupla – fortalecendo a infra-estrutura de investigação e promovendo a investigação no sector farmacêutico. Notavelmente, esta política não aborda de forma alguma questões relacionadas à PI. Talvez essas sejam algumas questões sobre as quais vale a pena refletir e sobre as quais tentaremos montar uma postagem separada!
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://spicyip.com/2024/01/the-us-review-of-march-in-rights-and-some-questions-on-an-indian-counterpart.html
- :tem
- :é
- :não
- :onde
- $UP
- 1
- 120
- 1st
- 20
- 2012
- 2016
- 2023
- 203
- 35%
- 41
- 60
- 8
- sec 8
- a
- Sobre
- acima
- Acesso
- acessadas
- acessível
- Segundo
- Alcançar
- Aja
- Açao Social
- adicionado
- endereço
- adequadamente
- afetando
- Depois de
- novamente
- contra
- agência
- agricultura
- Destinado
- aparentado
- Todos os Produtos
- aliviar
- permitir
- tb
- Apesar
- americano
- entre
- entre
- an
- e
- Outro
- qualquer
- aparece
- relevante
- aplicado
- aplica
- Aplicar
- aproximadamente
- SOMOS
- argumentar
- argumentou
- Argumenta
- por aí
- arranjos
- AS
- pergunta
- At
- tentativa
- Autoria
- disponibilidade
- disponível
- em caminho duplo
- equilíbrio
- BE
- Porque
- sido
- antes
- Começo
- ser
- entre
- Biden
- bilhão
- Trazido
- negócios
- by
- chamado
- veio
- CAN
- casas
- casos
- certo
- Câmara
- alterar
- Alterações
- verificado
- circunstâncias
- citando
- Clínico
- colaboração
- como
- comentários
- Commerce
- comercialmente
- comparado
- competição
- Interesse
- Preocupações
- condições
- consideração
- consulta
- Consumidores
- continuar
- Contratante
- contratual
- contraste
- Custo
- custos
- Contrapartida
- países
- Casal
- curso
- coberto
- cobre
- Covid-19
- Pandemia de COVID-19
- critérios
- Clientes
- dados,
- Data
- dias
- debate
- Dezembro
- Délhi
- Departamento
- Apesar de
- em desenvolvimento
- Desenvolvimento
- diretamente
- desastre
- Divulgar
- divulgação
- critério
- discussão
- discussões
- do
- parece
- Doméstico
- rascunho
- rascunho de diretrizes
- droga
- Drogas
- dois
- durante
- durante o COVID-19
- e
- cada
- Mais cedo
- Eficaz
- efetivamente
- efeitos
- permitir
- encorajar
- final
- energia
- noivando
- garantir
- Meio Ambiente
- especialmente
- essencialmente
- Éter (ETH)
- eventos
- sempre crescente
- evidenciado
- exemplo
- Exercício
- Expandir
- expansão
- externo
- fatores
- FALHA
- fracassado
- falta
- Falha
- feira
- Federal
- Governo federal
- federal
- erro
- campo
- arquivada
- Finalmente
- Primeiro nome
- primeira vez
- seguir
- seguinte
- Escolha
- antes
- Frente
- formulário
- Fórmula
- para a frente
- quatro
- QUADRO
- da
- frente
- totalmente
- financiado
- financiamento
- Geral
- obtendo
- OFERTE
- meta
- governando
- Governo
- Governos
- Govt
- concedido
- Solo
- orientações
- tinha
- mão
- Acontecimento
- prejudicando
- Ter
- he
- Saúde
- saúde
- sua experiência
- SUA PARTICIPAÇÃO FAZ A DIFERENÇA
- aqui em
- Alta
- HIV
- Início
- Como funciona o dobrador de carta de canal
- Contudo
- HTML
- HTTPS
- humano
- i
- idéias
- if
- ii
- iii
- imagem
- impactada
- importante
- in
- Crescimento
- Índia
- indiano
- governo indiano
- indústrias
- ineficiências
- informal
- Infraestrutura
- inerente
- Inovação
- inputs
- instância
- em vez disso
- Instituto
- intelectual
- propriedade intelectual
- interação
- interações
- interesse
- interessado
- interessante
- interno
- Internacionais
- intervir
- para dentro
- introduzir
- introduzido
- introduzindo
- Invenção
- invenções
- Inventores
- investimento
- Investe
- convidativo
- invocado
- IP
- Ironicamente
- emitem
- questões
- IT
- ESTÁ
- judicial
- manutenção
- Saber
- Escritórios de
- partida
- Legislação
- Nível
- Licença
- licenças
- Licença
- como
- LIMITE
- OLHARES
- baixa
- moldadas
- fazer
- maneira
- fabricado
- muitos
- Março
- marca
- mercado
- max-width
- Posso..
- a medida
- medidas
- Conheça
- mencionado
- método
- mente
- dinheiro
- mais
- a maioria
- movido
- muito
- Nacional
- você merece...
- Cria
- nunca
- Novo
- NIH
- nist
- Organizações sem fins lucrativos
- notavelmente
- nada
- romance
- agora
- objetivo
- objetivos
- títulos
- of
- Office
- on
- queridos
- só
- aberto
- opor
- Opções
- or
- Outros
- Outros
- Fora
- Acima de
- global
- próprio
- propriedade
- pandemia
- partes
- festa
- patente
- patenteado
- para
- possivelmente
- farmacêutico
- Farmacêutica
- platão
- Inteligência de Dados Platão
- PlatãoData
- ponto
- Privacidade
- posição
- abertas
- possivelmente
- Publique
- POSTAGENS
- potencial
- poder
- prática
- presença
- presente
- pressão
- anterior
- preço
- Valores
- preços
- primário
- Prévio
- privado
- processo
- Produto
- Produtos
- progressivo
- Promoção
- propriedade
- Direitos de propriedade
- proposto
- proteção
- fornecer
- fornecido
- público
- Publicação
- propósito
- Empurrando
- colocar
- questão
- Frequentes
- bastante
- R & D
- angariado
- alcançado
- leitores
- mundo real
- razoável
- razões
- recentemente
- receita
- receita para o desastre
- reconhecido
- recusando
- liberado
- permanece
- requerer
- requerimento
- Requisitos
- exige
- pesquisa
- pesquisa e desenvolvimento
- Responder
- resultando
- retorno
- rever
- certo
- direitos
- uma conta de despesas robusta
- RTI
- s
- Segurança
- Dito
- mesmo
- escrutínio
- Segundo
- secretária
- Seção
- setor
- Setores
- Vejo
- Buscar
- busca
- parece
- visto
- separado
- Setembro
- a sério
- Serviços
- conjunto
- mudança
- rede de apoio social
- de forma considerável
- semelhante
- Similarmente
- simplesmente
- desde
- solteiro
- pequeno
- So
- alguns
- algo
- falar
- espírito
- estaca
- posição
- padrões
- Estado
- Passo
- Passos
- parou
- fortalecimento
- mais forte,
- estudante
- Estudo
- sujeito
- sucesso
- tal
- ajuda
- Em torno da
- .
- Tire
- tomado
- alvejando
- Contribuinte
- Tecnologia
- que
- A
- O Estado
- deles
- Lá.
- Este
- deles
- coisas
- Terceiro
- terceiro
- isto
- aqueles
- Apesar?
- três etapas
- Através da
- Assim
- tempo
- para
- juntos
- ferramenta
- para
- comércio
- Tradução
- tratamento
- Trend
- julgamento
- tentar
- VIRAR
- duplo
- nos
- não está claro
- para
- Universidades
- universidade
- ao contrário
- até
- sobre
- us
- governo dos Estados Unidos
- Uso
- usar
- utilização
- utilização
- vário
- versão
- muito
- foi
- we
- pesagem
- O Quê
- O que é a
- quando
- se
- qual
- enquanto
- QUEM
- precisarão
- de
- sem
- Equivalente há
- seria
- anos
- ainda
- zefirnet