Preparação e caracterização de materiais
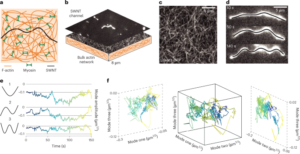
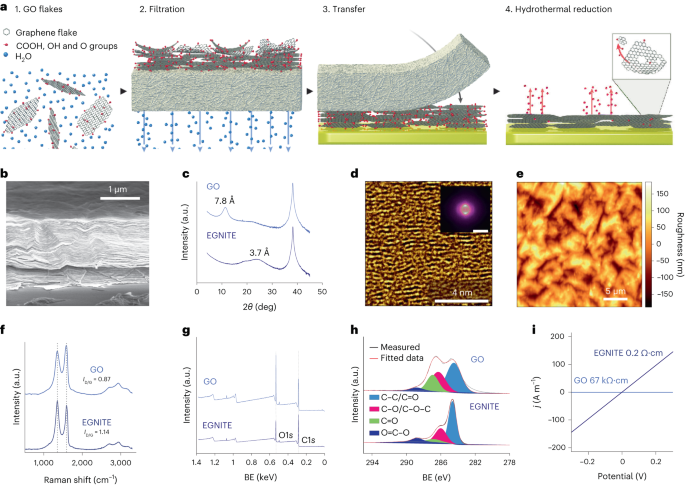
A solução aquosa GO foi diluída em água deionizada para obter 0.15 mg ml-1 solução e filtrada a vácuo através de membrana de nitrocelulose com poros de 0.025 µm, formando uma fina película de GO. O filme fino foi então transferido para o substrato alvo usando transferência úmida em água deionizada e posterior recozimento térmico a 100°C por 2min. A pilha de filme-substrato GO foi reduzida hidrotermicamente a 134 ° C em uma autoclave padrão por 3 horas para formar EGNITE. O substrato base para todos os estudos de caracterização do EGNITE foi um quadrado (1 × 1 cm2) de Si/SiO2 (400 μm/1 μm).
XPS
As medições XPS foram realizadas com um analisador Phoibos 150 (SPECS) em condições de ultra-alto vácuo (pressão base, 5 × 10-10 mbar) com fonte monocromática de raios X Al Kα (1,486.74 eV). Os espectros gerais foram adquiridos com uma energia de passagem de 50 eV e tamanho de passo de 1 eV e os espectros de alta resolução foram adquiridos com energia de passagem de 20 eV e tamanho de passo de 0.05 eV. A resolução geral nessas últimas condições é de 0.58 eV, conforme determinado pela medição de toda a largura na metade do máximo do Ag 3d5/2 pico de prata pulverizada. A análise XPS mostra uma forte diminuição após o tratamento hidrotérmico do pico C – O (associado a grupos epóxido), mas uma pequena contribuição de C – OH, C = O e C (O) OH devido a hidroxilas, carbonilas e carboxilas que permanecem após a redução. A desconvolução do O1s pico confirma tal comportamento. A principal contribuição para o C1s sinal após a redução hidrotérmica, no entanto, vem de sp2 orbitais C – C hibridizados34,57.
Difração de raios X
Medições de difração de raios X (θ-2θ varredura) foram realizados em um difratômetro de pesquisa de materiais (Malvern PANalytical). Este difratômetro tem uma posição horizontal ω-2θ goniômetro (320 mm de raio) em geometria de quatro círculos e trabalhado com tubo de raios X cerâmico com ânodo Cu Kα (λ = 1.540598 Å). O detector utilizado é um Pixcel que é um detector rápido de raios X baseado na tecnologia Medipix2.
Espectroscopia Raman
As medições de espectroscopia Raman foram realizadas utilizando um espectrógrafo Witec equipado com uma linha de excitação a laser de 488 nm. Para as medições, os espectros Raman foram adquiridos usando uma objetiva de 50× e uma grade de 600 sulcos por nm; a potência do laser foi mantida abaixo de 1.5 mW para evitar o aquecimento da amostra.
TEM
Uma lamela de feixe de íons focada foi preparada com um Helios NanoLab DualBeam (LMA-INA) para o estudo da seção transversal da amostra EGNITE. As análises estruturais foram realizadas por meio de TEM usando um microscópio Tecnai F20 operado a 200 kV, incluindo técnicas HRTEM e STEM anular de campo escuro de alto ângulo. O experimento STEM-EELS foi realizado em um microscópio Tecnai F20 trabalhando a 200 KeV, com abertura de 5mm, comprimento de câmera de 30mm, ângulo de convergência de 12.7 mrad e ângulo de coleta de 87.6 mrad. Como usamos 0.5 eV por pixel e 250 eV como energia inicial na aquisição de perda de núcleo, não adquirimos a borda Si K esperada em 1,839 eV, a borda Pt M em 2,122 eV e a borda Au M em 2,206 eV. A composição atômica relativa C – O foi obtida focando nossa atenção na camada GO reduzida e assumindo que as arestas analisadas (C e O no nosso caso) somam 100%. Esta suposição é válida no nosso caso, como evidenciado no Informação Suplementar mapas. A seção transversal diferencial de energia foi calculada usando o modelo Hartree-Slater e o fundo usando um modelo de baixa potência.
Condutividade elétrica
As medições de condutividade elétrica foram realizadas usando um medidor Keithley 2400 em configuração de dois pontos. As amostras medidas consistiram em filmes EGNITE de 1 × 1 cm2 em cima de um SiO2 substrato.
A análise dos dados
Dados de difração de raios X, Raman e XPS foram analisados usando pacotes Python 3.7 (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). A distância entre os planos foi calculada a partir das medidas de difração de raios X de acordo com a lei de Snell. Uma vez que os dados foram movidos para o domínio espacial, o máximo dos picos foi ajustado. A distância correspondente deu um valor médio da distância entre os planos. Os desvios desses valores médios foram calculados a partir da largura total na metade do máximo dos ajustes Lorentzianos dos picos no domínio espacial. As medições de espectroscopia XPS e Raman foram analisadas ajustando uma convolução de picos em locais esperados para as características correspondentes. Os valores de condutividade do GO e EGNITE foram obtidos ajustando o I-V curvas medidas nas medições de condutividade elétrica de acordo com a lei de Ohm. Os dados são n = 1 para cada medição.
Fabricação de array flexível
A fabricação dos dispositivos é mostrada na Fig. Suplementar. 4. Os dispositivos foram fabricados em Si / SiO de 4 polegadas2 (400 μm/1 μm). Primeiro, uma camada de PI com 10 µm de espessura (PI-2611, HD MicroSystems) foi revestida por rotação no wafer e cozida em uma atmosfera rica em nitrogênio a 350 °C por 30 min. Traços metálicos foram padronizados usando litografia óptica do fotorresistente de reversão de imagem (AZ5214, Microchemicals). A evaporação por feixe de elétrons foi usada para depositar 20 nm de titânio e 200 nm de ouro e a remoção foi realizada. Usamos um filme EGNITE com cerca de 1 μm de espessura como uma compensação entre desempenho eletroquímico e flexibilidade do array. Após a transferência do filme GO, o alumínio foi evaporado por feixe eletrônico e as áreas no topo dos futuros microeletrodos foram definidas usando um fotorresistente negativo (nLOF 2070, Microchemicals) e removidas. Em seguida, o filme GO foi gravado em todos os lugares, exceto nos futuros microeletrodos, usando uma gravação com íons reativos de oxigênio (RIE) por 5 min a 500 W e as colunas protetoras de alumínio foram gravadas com uma solução diluída de ácidos fosfórico e nítrico. Em seguida, uma camada de PI-3 com 2611 µm de espessura foi depositada no wafer e cozida conforme descrito anteriormente. As aberturas PI-2611 no microeletrodo foram então definidas usando um fotorresistente espesso positivo (AZ9260, Microchemicals) que atuou como uma máscara para um RIE de oxigênio subsequente. Posteriormente, os dispositivos foram padronizados na camada PI, novamente usando fotorresistente AZ9260 e RIE. A camada fotorresistente foi então removida em acetona e o wafer limpo em álcool isopropílico e seco. Por fim, os dispositivos foram retirados do wafer e estavam prontos para serem colocados em bolsas de esterilização para serem tratados hidrotermicamente a 134 °C em autoclave padrão por 3 h.
Caracterização eletroquímica de microeletrodos
A caracterização eletroquímica dos microeletrodos foi realizada com um potenciostato Metrohm Autolab PGSTAT128N em 1 × PBS (Sigma-Aldrich, P4417) contendo tampão fosfato 10 mM, NaCl 137 mM e KCl 2.7 mM em pH 7.4 e usando uma configuração de três eletrodos. Um eletrodo Ag/AgCl (FlexRef, WPI) foi utilizado como referência e um fio de platina (Alfa Aesar, 45093) foi utilizado como contra-eletrodo.
Antes da avaliação de desempenho, os eletrodos foram pulsados com 10,000 pulsos com carga balanceada (1 ms, 15 µA). Exposição dos eletrodos a protocolos de pulsação contínua seguidos de 100 ciclos de voltametria cíclica (-0.9 a +0.8 V) a 50 mV s-1, 20 repetições de 5,000 pulsos (1 ms) e redeterminação do potencial de circuito aberto.
A análise dos dados
Os dados de caracterização eletroquímica foram analisados utilizando pacotes Python 3.7 (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Os dados de espectroscopia de impedância foram ajustados a um modelo elétrico equivalente que consiste em uma resistência (R) em série com um elemento de fase constante (CPE). A partir daí, o valor do CPE foi aproximado de uma capacitância e dividido pela área geométrica do microeletrodo para obter um valor equivalente para a capacitância interfacial do EGNITE. A capacitância de armazenamento de carga de microeletrodos (CSC) foi calculada a partir de medições de voltametria cíclica, integrando os regimes catódico e anódico da corrente medida e normalizando pela taxa de varredura. A capacitância de armazenamento de carga catódica e anódica (cCSC e aCSC) a uma taxa de varredura de 100 mV do EGNITE é 45.9 ± 2.4 e 34.6 ± 2.8 mC cm-2, respectivamente (n = 3). Conforme relatado para outros materiais58, os CSCs obtidos dependem da taxa de varredura (Fig. Complementar 5). Para avaliar a presença de reações de redução de oxigênio, medimos a forma de onda CV sob eletrólito purgado com nitrogênio59 e não observaram diferenças substanciais na forma de onda (Fig. Complementar 6). No entanto, nossos resultados não abordam completamente o impacto das reações de redução de oxigênio na capacidade de injeção de carga do EGNITE e trabalho adicional precisa ser feito para investigar isso adequadamente. A capacidade de injeção de carga do microeletrodo (CIC) foi estabelecida determinando a amplitude do pulso de corrente que provocou uma diferença de tensão (após a remoção da queda ôhmica) que correspondia à janela eletroquímica de água do eletrodo (-0.9 V para catódico e +0.8 V para anódico versus Ag/AgCl ) (Fig. Complementar. 17)60.
Análise estatística
Os dados são média ± dp, n = 18 para EIS e n = 3 para cronopotentiometrias. Os dados do mapa de excursão de tensão capacitiva catódica são a média das excursões de tensão capacitiva catódica para um evento para cada formato de pulso de n = 3 eletrodos.
Avaliação da estabilidade mecânica
Sonicação de ultrassom
Os conjuntos de eletrodos EGNITE foram colocados dentro de um béquer cheio de água em banho-maria de ultrassom (Elmasonic P 180H). A sonicação foi aplicada a 37 kHz por 15 min a 200 W, e seguida por mais 15 min de sonicação a 37 kHz com a potência elevada para 300 W. Imagens dos eletrodos foram adquiridas antes e depois das etapas de sonicação.
Teste de flexão
A configuração de flexão (Fig. 2k) consistia em três hastes cilíndricas; o do meio (diâmetro, 700 µm) foi abaixado, produzindo ângulos de curvatura de 131°. Três arranjos de microeletrodos flexíveis foram utilizados para o teste de flexão. Cada matriz continha 18 microeletrodos de 50 µm de diâmetro. Duas matrizes foram medidas após 10 e 20 ciclos, enquanto um dispositivo foi medido apenas por 10 ciclos, pois foi danificado durante o manuseio após a medição. O ciclo de teste de flexão consistiu em uma aplicação de carga de 10 s mais 10 s sem carga. Os dispositivos foram caracterizados eletroquimicamente (EIS e CV) antes e após 10 e 20 ciclos de flexão.
Gravação neural epicórtica
Implantação epicórtica
Todos os procedimentos experimentais foram realizados de acordo com as recomendações do Conselho da Comunidade Europeia e da legislação francesa para cuidado e uso de animais de laboratório. Os protocolos foram aprovados pelo comitê de ética de Grenoble (ComEth) e autorizados pelo ministério francês (número 04815.02). Ratos Sprague-Dawley (machos, 4 meses de idade, pesando ~600 g) foram anestesiados por via intramuscular com cetamina (50 mg por kg (peso corporal)) e xilazina (10 mg por kg (peso corporal)) e depois fixados em um suporte estereotáxico. A remoção do crânio temporal expôs o córtex auditivo. A dura-máter foi preservada para evitar danos ao tecido cortical. Um furo foi feito no vértice para inserir o eletrodo de referência, e um segundo furo, 7mm em direção à frente do primeiro, foi feito para inserir o eletrodo terra. Os eletrodos eram pinos de 0.5 mm de espessura usados para soquetes de circuitos integrados. Eles foram colocados para fazer contato elétrico com a dura-máter e fixados ao crânio com cimento dentário. Em seguida, montamos a fita de microeletrodos de superfície no córtex auditivo, como mostrado na Fig. 3b. Os padrões das veias identificam o córtex auditivo, na área 41 do mapa cerebral do rato de Krieg. Os sinais corticais foram amplificados simultaneamente com ganho de 1,000 e digitalizados a uma taxa de amostragem de 33 kHz. Um alto-falante 20 cm à frente da orelha de um rato, contralateral ao córtex exposto, emitia estímulos acústicos. Os estímulos emitidos foram monitorados por um microfone de 0.25 polegadas (Brüel & Kjaer, 4939) colocado próximo à orelha e apresentados em nível de pressão sonora (dB NPS re 20 μPa). Examinamos as respostas de vértice positivo (negativo para cima) de latência média evocadas por cliques alternados a 80 dB SPL e estímulos de tone burst a 70 dB SPL com frequências variando de 5 a 40 kHz um tempo de subida e descida de 5 ms e uma duração de 200 ms.
A análise dos dados
Os dados eletrofisiológicos foram analisados usando pacotes Python 3.7 (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) e a biblioteca customizada PhyREC (https://github.com/aguimera/PhyREC). r.m.s. os valores foram calculados com janela deslizante de 20 ms em frequências acima de 200 Hz. Os espectrogramas foram calculados para uma faixa entre 70 Hz e 1.1 kHz. PSD foi calculado ao longo de 60 segundos de gravações contínuas. Para um determinado conjunto de eletrodos, foram calculados dois PSDs: in vivo (IV) e post-mortem (PM). A SNR é expressa em dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) e interpolada para 20 pontos espaçados logaritmicamente entre 10 Hz e 1 kHz.
Análise estatística
Dados neurais epicorticais apresentados na Fig. 3 são obtidos a partir de medições individuais em um único animal. Na Fig. 3c, são apresentados dados de 64 eletrodos. Na Fig. 3d, são apresentados dados de dois eletrodos selecionados. Na Fig. 3f, o PSD e o SNR são calculados a partir de 64 eletrodos EGNITE e são mostrados como média ± dp. Na Figura Suplementar. 12c,d dados medianos são apresentados para 192 eletrodos EGNITE de n = 3 experimentos e 60 eletrodos de platina de n = 1 experimento.
Gravação neural intracortical
Implantação intracortical
Os animais foram anestesiados com uma mistura de cetamina/xilazina (75:1, 0.35 ml/28 g ip) e este estado foi mantido com uma máscara de inalação fornecendo 1.5% de isoflurano. Vários microparafusos foram colocados no crânio para estabilizar o implante, e aquele no topo do cerebelo foi usado como base geral. A sonda foi implantada no córtex pré-frontal (coordenadas: AP, 1.5 mm; ML, ±0.5 mm; DV, −1.7 mm do bregma). A implantação foi realizada revestindo a sonda com maltose (ver protocolo abaixo) para proporcionar rigidez temporária da sonda e facilitar a inserção da sonda. A sonda foi selada com cimento dentário. Conectores TDT-ZifClip foram utilizados para conectar a sonda ao sistema eletrofisiológico através de um cabo miniaturizado. Após a cirurgia, o camundongo passou por um período de recuperação de 1 semana recebendo tratamentos analgésicos (buprenorfina) e antiinflamatórios (meloxicam). A atividade neural foi registrada com o sistema multicanal Open Ephys a uma taxa de amostragem de 30 kHz com um amplificador Intan RHD2132. Os experimentos de tarefas auditivas foram realizados em uma caixa à prova de som, com dois alto-falantes em seu interior, utilizando protocolos baseados em trabalhos descritos anteriormente.61. O estímulo sonoro consistiu em um clique de ruído branco com duração de 15 ms, repetido 100 vezes (ciclos), cada um separado por 5 segundos (intervalo interestímulo). Durante a tarefa o animal conseguiu se movimentar livremente.
Protocolo de reforço Maltose
Uma solução aquosa de maltose é aquecida até o ponto de transição vítrea (Tg), entre 130 e 160 °C, utilizando placa quente ou micro-ondas. Uma vez que a maltose esteja viscosa, a parte traseira da sonda entra em contato apenas com a maltose. À medida que a maltose esfria, ela enrijece e endurece a sonda.
A análise dos dados
Os sinais neurais de cada eletrodo foram filtrados off-line para extrair SUA e LFPs. SUA foi estimado filtrando o sinal entre 450 e 6,000 Hz e os picos de neurônios individuais foram classificados usando análise de componentes principais com Offline Sorter v.4 (Plexon). Para obter LFPs, os sinais foram reduzidos para 1 kHz, eliminados e filtrados por entalhe para remover artefatos de linha de ruído (50 Hz e seus harmônicos) com scripts personalizados em Python. AEP SNR foi calculada como a razão entre a amplitude do pico N1 e o dp. de um período de 20 ms antes do estímulo.
Análise estatística
Dados mostrados na Fig. 3h, eu são média ± dp, n = 30 como o número médio de tentativas. Os dados registrados do mesmo eletrodo são mostrados nos dias 30, 60 e 90. São apresentados dados de um único animal.
Biocompatibilidade epicórtica crônica
Implantação cirúrgica de dispositivos
Um total de 27 ratos Sprague-Dawley adultos, machos, foram utilizados para este estudo (Charles River). Os animais foram alojados a uma temperatura ambiente de 21 ± 2 °C e uma umidade de 40–50%, em um ciclo de 12 h claro/12 h escuro. Os ratos foram alojados em grupos e tiveram livre acesso a dieta e água durante todo o período experimental. Os procedimentos experimentais foram realizados de acordo com a Lei do Bem-Estar Animal (1998), sob a aprovação do Ministério do Interior do Reino Unido e do órgão local de revisão ética do bem-estar animal (AWERB). Os animais foram anestesiados com isoflurano (2–3%) durante a cirurgia, e a profundidade da anestesia foi monitorada pelo teste do reflexo de pinça do dedo do pé. Os animais foram colocados em uma estrutura estereotáxica (Kopf, 900LS), localizada acima de uma manta térmica para manter a temperatura corporal. Um orifício de craniotomia (~5 mm ×4 mm) foi feito a 1 mm de distância da linha média usando uma broca dentária com broca de 0.9 mm, a dura-máter foi removida e o dispositivo epicortical colocado na superfície cortical do cérebro. O orifício da craniotomia foi selado com Kwik-sil, seguido de cimento dentário para fixação e a pele suturada fechada. Injeções subcutâneas de solução salina (1 ml por kg (peso corporal)) e buprenorfina (0.03 mg por kg (peso corporal)) foram administradas para repor os líquidos perdidos e reduzir a dor pós-operatória, e a anestesia foi retirada.
Coleta e processamento de tecidos
Os animais foram terminados às 2, 6 ou 12 semanas pós-implantação por um método apropriado para o tipo de análise a ser realizada.
Histologia e imunohistoquímica
Às 2, 6 ou 12 semanas pós-implantação, os ratos foram exterminados por meio de perfusão cardíaca com solução heparinizada (10 U ml-1, Sigma-Aldrich) PBS, seguido de paraformaldeído a 4% (PFA, Sigma-Aldrich) em PBS. Os cérebros foram pós-fixados em PFA a 4% por 24 horas, depois transferidos para sacarose a 30% em PBS por pelo menos 48 horas antes de serem congelados em isopentano. Os cérebros foram então armazenados a -80 °C até serem criosseccionados a 25 µm. O tecido foi então corado para a molécula adaptadora de ligação ao cálcio ionizado 1 (Iba-1) para determinar o nível de ativação microglial. Resumidamente, as secções de tecido foram bloqueadas com soro de cabra a 5% em PBS com Triton-X a 0.1% durante 1 h antes da incubação durante a noite a 4 °C com o anticorpo primário anti-Iba-1 (1:1,000, 019-19741; Wako). As seções foram então coradas com anticorpo secundário, anti-coelho Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) por 1 hora em temperatura ambiente. As lâminas foram montadas com lamínulas usando meio de montagem anti-desbotamento Prolong Gold com 4,6-diamidino-2-fenilindole (Thermo Fisher). A sonda cobriu uma área de 3 × 3.7 mm2 na superfície cortical do cérebro; secções de tecido selecionadas para coloração cobriram 3.2 mm de comprimento desta região. As lâminas foram fotografadas usando um scanner de lâminas de microscópio 3DHistech Pannoramic-250 a 20× e as imagens foram analisadas usando CaseViewer v.2.4 (3DHistech). Para avaliar a ativação da microglia, uma área de 3.2 mm foi coberta, com uma imagem analisada a cada 100 μm. As imagens foram tiradas com ampliação de 8.5x, detalhando uma seção do local da sonda epicortical, a 3 mm da linha média do cérebro, abrangendo a área diretamente sob o local da sonda.
Processamento de imagem
Os dados de microscopia foram processados por imagem usando um algoritmo para caracterização do fenótipo da microglia (Fig. Complementar 13). A ativação microglial foi analisada usando um CellProfiler* personalizado (Broad Institute, v.3.1.9 de https://cellprofiler.org/) pipeline. Primeiro, o módulo EnhanceOrSuppressFeatures foi usado para aprimorar estruturas filamentosas como neurites, aplicando o método de aprimoramento de tubeness. A partir das imagens aprimoradas, as células foram segmentadas usando o módulo IdentificarPrimaryObjects. Medições preliminares das células sugeriram que a faixa apropriada de diâmetro do objeto era de 3 a 40 pixels. Objetos fora dessa faixa de diâmetro ou que tocassem a borda da imagem foram descartados. As células foram segmentadas usando uma estratégia de limiar adaptativo Otsu de duas classes com um tamanho de janela adaptativa de 50 pixels. Os objetos identificados pelo módulo IdentificarPrimaryObjects foram inseridos no módulo MeasureObjectSizeShape para calcular as propriedades necessárias para classificação das células. No módulo ClassifyObjects, a categoria na qual basear as classificações foi especificada como AreaShape e Extent foi selecionada como a medida correspondente. As células foram classificadas como 'ativado' ou 'não ativado' com base em sua propriedade Extent, que é a proporção entre a área ocupada pela célula e a área ocupada por sua caixa delimitadora. Esta abordagem de classificação foi racionalizada pelo facto de a microglia activada ter corpos celulares grandes e nenhum processo, ocupando assim uma proporção muito maior das suas caixas delimitadoras do que as suas contrapartes não activadas. Por fim, os módulos CalculaMath e ExportToSpreadsheet foram utilizados para calcular e gerar as estatísticas desejadas.
Análise estatística
Conjuntos de dados são n = 3 para cada tipo de dispositivo (implante somente PI (PI); PI com ouro microfabricado exposto (ouro); e PI com ouro microfabricado e EGNITE (EGNITE) em todos os momentos), com exceção do ouro de 6 semanas, que é n = 2 para dados ELISA. Os hemisférios contralaterais foram combinados em cada momento para dar n = 9 às 2 e 12 semanas pós-implantação e n = 8 às 6 semanas após a implantação. A análise dos dados foi feita utilizando o software GraphPad Prism v.8. A análise estatística foi concluída usando uma análise de variância bidirecional (ANOVA) com teste de comparações múltiplas de Tukey, quando apropriado; P < 0.05 foi considerado significativo.
ELISA
Após o período de implantação, os animais foram eliminados por deslocamento cervical. O tecido cerebral foi extraído do hemisfério direito e esquerdo do cérebro, congelado em nitrogênio líquido e armazenado a -80°C até uso posterior. O tecido foi lisado usando tampão de lise NP-40 (NaCl 150 mM, Tris-Cl 50 mM, substituto Nonidet P1 a 40%, Fluka, pH ajustado para 7.4) contendo inibidor de protease e fosfatase (Halt Protease and Phosphatase Inhibitor Cocktail, Thermo Fisher), seguido por ruptura mecânica do tecido (TissueLyser LT, Qiagen). As amostras foram então centrifugadas por 10 minutos a 5,000 rpm e o sobrenadante armazenado a 4°C até uso posterior. O LEGENDplex Rat Inflammation Panel (número de catálogo 740401, BioLegend), um kit ELISA multiplex baseado em esferas, foi executado para quantificar as seguintes citocinas; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), estimulador de colônias de granulócitos-macrófagos fator, interferon-γ e fator de necrose tumoral. O kit foi executado de acordo com as instruções do fabricante, com proteína carregada em um volume fixo de 15 µl. Após a incubação com o sobrenadante, as esferas foram analisadas num citómetro de fluxo BD FACSVerse e os dados analisados utilizando o software de análise de dados LEGENDplex.
Estimulação neural
Implantação intrafascicular
Todos os experimentos com animais foram aprovados pelo Comitê de Ética da Universitat Autònoma de Barcelona, de acordo com a Diretiva 2010/63/UE do Conselho das Comunidades Europeias. Os animais foram alojados a 22 ± 2 °C sob um ciclo de 12 h claro/12 h escuro com comida e água disponíveis gratuitamente. O nervo ciático de ratas Sprague-Dawley anestesiadas (250–300 g, ~18 semanas) foi exposto cirurgicamente e os eletrodos TIME foram implantados transversalmente ao nervo ciático com a ajuda de uma agulha reta presa a um fio de laço 10-046. O processo foi monitorado sob um microscópio de dissecção para garantir a posição correta dos sítios ativos dentro dos fascículos nervosos (Fig. 4b). Durante os experimentos, a temperatura corporal do animal foi mantida com uma almofada térmica.
A estimulação nervosa foi realizada aplicando trens de pulsos de corrente bifásicos com duração fixa de 100 µs por fase e aumentando a amplitude de 0 a 150 µA em passos de 1 ou 3 µA a 3 Hz por 33 s (Estimulador DS4, Digitimer) através dos diferentes EGNITE microeletrodos. Simultaneamente, os CMAPs foram registrados nos músculos GM, TA e PL usando pequenos eletrodos de agulha (13 mm de comprimento, 0.4 mm de diâmetro, eletrodos de agulha de aço inoxidável A-03-14BEP, Bionic) colocados em cada músculo.62. O eletrodo ativo foi colocado no ventre muscular e a referência no nível do tendão. Os registros eletromiográficos foram amplificados (× 100 para GM e TA, × 1,000 para PL; amplificadores P511AC, Grass), filtrados passa-faixa (3 Hz a 3 kHz) e digitalizados com um sistema de gravação PowerLab (PowerLab16SP, ADInstruments) a 20 kHz.
A análise dos dados
A amplitude de cada CMAP foi medida desde a linha de base até o pico negativo máximo. As medidas do pico de tensão foram normalizadas para a amplitude máxima do CMAP obtida para cada músculo no experimento. Um índice de seletividade (SI) foi calculado para cada sítio ativo como a razão entre a amplitude normalizada do CMAP para um músculo, CMAPi, e a soma das amplitudes normalizadas do CMAP nos três músculos, seguindo a fórmula SIi = nWCPAi/∑nWCPAj, na amplitude mínima da corrente de estimulação que provocou uma resposta muscular funcionalmente relevante mínima (definida como pelo menos 5% da amplitude do CMAP para um dos músculos em relação à amplitude máxima do CMAP desse músculo que havia sido previamente determinada). Em seguida, os locais ativos com maior IS para cada um dos três músculos foram selecionados como os SIs para cada músculo em um determinado experimento.
Biocompatibilidade intraneural crônica
Seguindo um procedimento relatado anteriormente50,63, o nervo ciático de ratas Sprague-Dawley anestesiadas (250-300 g, ~18 semanas) foi exposto e os dispositivos para biocompatibilidade in vivo com e sem EGNITE foram implantados longitudinalmente no ramo tibial do nervo ciático (n = 6–8 por grupo). Resumidamente, o nervo é perfurado na trifurcação com uma agulha reta presa a um fio de laço 10-0 (STC-6, Ethicon); a linha puxa a ponta em forma de seta da tira de eletrodo dobrada. A ponta é cortada para retirar o fio, e as pontas de cada braço são levemente dobradas para evitar a retirada do aparelho. O implante longitudinal foi escolhido porque permite um melhor estudo da resposta do corpo estranho no interior do nervo50.
Avaliação funcional de nervos e animais
Os animais foram avaliados durante o acompanhamento pós-implante por meio de testes de condução nervosa, algesimetria e locomoção em pista de caminhada.62. Para testes de condução, o nervo ciático das patas implantadas e contralaterais foi estimulado por eletrodos de agulha na incisura ciática e o CMAP do músculo PL foi registrado como acima. A latência e a amplitude do CMAP foram medidas. Para o teste de algesimetria, os ratos foram colocados sobre uma plataforma de rede de arame e um estímulo mecânico não nocivo foi aplicado com ponta metálica conectada a um algesímetro eletrônico Von Frey (Bioseb). O limiar nociceptivo (força em gramas na qual os animais retiraram a pata) das patas implantadas versus patas contralaterais foi medido. Para o teste da pista de caminhada, a superfície plantar das patas traseiras foi pintada com tinta preta e cada rato foi deixado andando por um corredor. As pegadas foram coletadas e o índice funcional do ciático calculado62.
Histologia
Após 2 ou 8 semanas, os animais foram perfundidos com PFA (4%) e os nervos ciáticos foram colhidos, pós-fixados, criopreservados e processados para análise histológica. Para avaliação do FBR, os nervos ciáticos foram cortados em cortes transversais de 15 μm de espessura com criostato (Leica CM190). As amostras foram coradas com anticorpos primários para axônios mielinizados (anti-RT97 para rotular Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) e macrófagos (anti-Iba-1, 1:500; Wako). Em seguida, as secções foram incubadas durante 1 h à temperatura ambiente com anticorpos secundários Alexa Fluor 488 anti-rato de burro e Alexa Fluor 555 anti-coelho de burro (1: 200, Invitrogen). Foram selecionados cortes representativos da parte central do implante no nervo tibial, imagens obtidas com microscópio de epifluorescência (Eclipse Ni, Nikon) acoplado a uma câmera digital (DS-Ri2, Nikon) e análise de imagens realizada com software ImageJ (National Institutes da Saúde). A quantidade de células positivas para Iba-1 em toda a área do nervo tibial foi quantificada e a espessura da cápsula tecidual foi medida como a distância média de cada lado do implante até os axônios mais próximos.
Análise estatística
Para análise estatística dos dados, utilizou-se ANOVA uni ou bidirecional seguida do teste post hoc de Bonferroni para diferenças entre grupos ou tempos. O software GraphPad Prism foi utilizado para representação gráfica e análise. A significância estatística foi considerada quando P <0.05.
Resumo de relatórios
Mais informações sobre projeto de pesquisa estão disponíveis no site Resumo do Relatório do Portfólio da Natureza vinculado a este artigo.
- Conteúdo com tecnologia de SEO e distribuição de relações públicas. Seja amplificado hoje.
- PlatoData.Network Gerativa Vertical Ai. Capacite-se. Acesse aqui.
- PlatoAiStream. Inteligência Web3. Conhecimento Amplificado. Acesse aqui.
- PlatãoESG. Carbono Tecnologia Limpa, Energia, Ambiente, Solar, Gestão de resíduos. Acesse aqui.
- PlatoHealth. Inteligência em Biotecnologia e Ensaios Clínicos. Acesse aqui.
- Fonte: https://www.nature.com/articles/s41565-023-01570-5
- :tem
- :é
- :não
- :onde
- ][p
- $UP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- Capaz
- acima
- Acesso
- conformidade
- Segundo
- acústico
- adquirir
- adquirido
- aquisição
- em
- Aja
- ativado
- ativação
- ativo
- atividade
- adaptativo
- Adicional
- endereço
- Ajustado
- Adulto
- Depois de
- AG
- novamente
- AL
- Álcool
- Alexa
- algoritmo
- Todos os Produtos
- permite
- juntamente
- am
- Ambiente
- quantidade
- Amplificado
- an
- analisa
- análise
- Apresentadora
- e
- animal
- animais
- Anticorpos
- anticorpo
- à parte
- Aplicação
- aplicado
- Aplicando
- abordagem
- apropriado
- aprovação
- aprovou
- SOMOS
- ÁREA
- áreas
- ARM
- por aí
- Ordem
- artigo
- AS
- avaliar
- avaliação
- associado
- suposição
- At
- Atmosfera
- atômico
- por WhatsApp.
- autorizado
- disponível
- evitar
- longe
- fundo
- Bank
- Barcelona
- base
- baseado
- Linha de Base
- BD
- BE
- viga
- Porque
- sido
- antes
- comportamento
- abaixo
- Melhor
- entre
- obrigatório
- biomédica
- Pouco
- Preto
- bloqueado
- corpos
- corpo
- ambos
- Caixa
- caixas
- Cérebro
- miolos
- Ramo
- brevemente
- amplo
- Trazido
- amortecer
- mas a
- by
- cabo
- calcular
- calculado
- Câmera
- Capacitivo
- Capacidade
- Cuidado
- transportado
- casas
- Categoria
- cl2
- célula
- Células
- cimento
- central
- desafios
- caracterizado
- carregar
- Charles
- químico
- escolhido
- classificação
- classificado
- clique
- fechado
- coquetel
- coleção
- colunas
- combinado
- vem
- comitê
- Comunidades
- comunidade
- Efetuado
- composição
- condições
- conduzido
- condutividade
- Configuração
- Contato
- conectado
- considerado
- Consistindo
- constante
- Contacto
- contida
- contínuo
- contribuição
- Convergência
- correta
- Correspondente
- corredor
- córtex
- Conselho
- homólogos
- curso
- coberto
- crítico
- Atravessar
- criopreservado
- Atual
- personalizadas
- Cortar
- ciclo
- ciclos
- citocinas
- danificar
- Escuro
- dados,
- análise de dados
- dias
- de
- diminuir
- considerado
- definido
- De
- entregue
- depender
- depositar
- depositado
- profundidade
- descrito
- Design
- desejado
- detalhado
- Determinar
- determinado
- determinando
- desenvolvimento
- dispositivo
- Dispositivos/Instrumentos
- DID
- Dieta
- diferença
- diferenças
- diferente
- digital
- digitalizados
- diluído
- diretamente
- diretamente
- luxação
- Rompimento
- distância
- dividido
- do
- domínio
- feito
- down
- Cair
- dois
- duração
- durante
- E & T
- cada
- borda
- Elétrico
- Eletrônico
- elemento
- elefante
- elevado
- abrangente
- energia
- aumentar
- aprimorada
- aprimoramento
- garantir
- equipado
- Equivalente
- estabelecido
- estimado
- Éter (ETH)
- considerações éticas
- EUR
- Europa
- EV
- avaliadas
- avaliação
- Evento
- Cada
- em toda parte
- evidenciado
- examinar
- exceção
- esperado
- experimentar
- experimental
- experimentos
- exposto
- Exposição
- expressa
- extensão
- extrato
- facilitar
- fato
- fator
- Cair
- longe
- RÁPIDO
- Funcionalidades
- feminina
- Figo
- Figura
- preenchida
- Filme
- filmes
- filtragem
- Finalmente
- Primeiro nome
- apropriado
- fixado
- Flexibilidade
- flexível
- fluxo
- focado
- focando
- seguido
- seguinte
- comida
- Escolha
- força
- estrangeiro
- formulário
- Fórmula
- QUADRO
- Gratuito
- livremente
- congelamento
- Francês
- da
- frente
- congelado
- cheio
- totalmente
- funcional
- funcionalmente
- mais distante
- futuro
- Ganho
- deu
- Geral
- geometria
- OFERTE
- dado
- vidro
- GM
- Go
- Dourado
- Grafeno
- grama
- Solo
- Grupo
- Do grupo
- orientações
- tinha
- Metade
- Manipulação
- Ter
- Saúde
- ajudar
- hemisférios
- de alta resolução
- mais
- titular
- Buraco
- Início
- Home Office
- Horizontal
- HOT
- Contudo
- HTTPS
- Huang
- i
- identificado
- identificar
- IEEE
- imagem
- análise de imagem
- imagens
- Impacto
- in
- Incluindo
- aumentando
- incubado
- incubação
- índice
- Individual
- inflamação
- INFORMAÇÕES
- entrada
- dentro
- Instituto
- instruções
- integrado
- Integração
- Pretendido
- Interface
- interfaces de
- para dentro
- investigar
- IT
- ESTÁ
- manteve
- de emergência
- Koch
- O rótulo
- laboratório
- grande
- Maior
- laser
- Sobrenome
- Latência
- mais tarde
- Escritórios de
- camada
- mínimo
- esquerda
- Legislação
- Comprimento
- Nível
- Biblioteca
- como
- limitações
- Line
- LINK
- ligado
- Líquido
- carregar
- local
- localizado
- locais
- longo
- longo prazo
- perdido
- baixo
- macrófagos
- moldadas
- a Principal
- a manter
- fazer
- mapa,
- mapas
- máscara
- correspondido
- material
- materiais
- matplotlib
- máximo
- mc
- significar
- significa
- medido
- medição
- medições
- medição
- mecânico
- Mídia
- metal
- método
- microglia
- microfone
- Microscópio
- Microscopia
- Coração
- minutos
- mínimo
- mínimo
- ministério
- mistura
- ML
- modelo
- modelos
- módulo
- Módulos
- molécula
- monitorados
- mês
- mouse
- mover
- movido
- MS
- Multicanal
- músculo
- nanotecnologia
- Nacional
- National Institutes of Health
- Natureza
- Perto
- necessário
- necrose
- Cria
- negativo
- NEO
- líquido
- rede
- Neural
- neurofilamento
- Neurônios
- Próximo
- não
- Ruído
- número
- numpy
- objeto
- objetivo
- objetos
- observar
- obter
- obtido
- of
- WOW!
- Office
- modo offline
- Velho
- on
- uma vez
- ONE
- só
- aberto
- aberturas
- operado
- or
- Outros
- A Nossa
- Fora
- saída
- lado de fora
- Acima de
- global
- durante a noite
- Visão geral
- Oxygen
- pacotes
- caminho
- Dor
- pandas
- painel
- parte
- passar
- padrões
- PAWS
- PBS
- Pico
- para
- atuação
- realizada
- significativo
- periférico
- fase
- fenótipo
- pins
- oleoduto
- pixels
- colocado
- Planos
- plataforma
- platina
- platão
- Inteligência de Dados Platão
- PlatãoData
- mais
- pm
- ponto
- pontos
- pasta
- posição
- positivo
- Publique
- potencial
- poder
- preliminares
- preparação
- preparado
- presença
- apresentado
- conservado
- pressão
- anteriormente
- primário
- Prévio
- sonda
- procedimentos
- processo
- processado
- processos
- produtor
- Produtos
- devidamente
- Propriedades
- propriedade
- proporção
- proteger
- Proteína
- protocolo
- protocolos
- fornecer
- fornecendo
- Pullover
- pulso
- Python
- R
- alcance
- variando
- RAT
- Taxa
- relação
- RE
- reação
- reações
- pronto
- receber
- recomendações
- gravado
- gravação
- recuperação
- reduzir
- Reduzido
- redução
- referência
- regeneração
- dietas
- região
- relativo
- relevante
- permanecem
- remover
- Removido
- removendo
- repetido
- substituir
- Informou
- Relatórios
- representação
- representante
- pesquisa
- Resistência
- Resolução
- respeito
- respectivamente
- resposta
- respostas
- Resultados
- Reversão
- rever
- fita
- Rico
- certo
- Subir
- Rio
- Quarto
- Execute
- s
- mesmo
- digitalização
- Scripts
- Segundo
- secundário
- Seção
- seções
- seguro
- Vejo
- selecionado
- Série
- Sérum
- Conjuntos
- vários
- Shape
- mostrando
- Shows
- lado
- Signal
- sinais
- significado
- periodo
- Prata
- simultaneamente
- solteiro
- local
- Locais
- Tamanho
- Pele
- slide
- Slides
- deslizamento
- pequeno
- estalo
- Software
- solução
- Parecer
- fonte
- Espacial
- Palestrantes
- caixas de som
- especificada
- óculos
- Espectroscopia
- picos
- Spin
- quadrado
- Estabilidade
- estabilizar
- pilha
- Aço inoxidável
- padrão
- padronizado
- Comece
- Estado
- estatístico
- estatística
- Steam
- aço
- haste
- Passo
- Passos
- estímulo
- armazenamento
- armazenadas
- direto
- Estratégia
- Tira
- mais forte,
- estrutural
- estruturas
- caso
- Estudo
- subcutâneo
- subseqüente
- substancial
- tal
- soma
- superfície
- Cirurgia
- .
- T
- Tire
- tomado
- Target
- Tarefa
- técnicas
- Tecnologia
- temporário
- teste
- testes
- do que
- que
- A
- A área
- O Futuro
- do Reino Unido
- deles
- então
- Lá.
- térmico
- deles
- isto
- aqueles
- três
- limiar
- Através da
- todo
- Assim
- tempo
- vezes
- tipo
- dicas
- tecido
- Titânio
- para
- TOM
- topo
- Total
- tocando
- para
- pista
- trens
- trans
- transferência
- transferido
- Transferir
- transição
- tratado
- tratamento
- tratamentos
- ensaios
- tutorial
- dois
- tipo
- Uk
- ultra-som
- para
- compreensão
- sofreu
- até
- usar
- usava
- utilização
- Vácuo
- válido
- valor
- Valores
- Contra
- via
- vivo
- Voltagem
- volume
- de
- W
- andar
- caminhada
- foi
- Água
- we
- semana
- semanas
- pesagem
- peso
- Bem-estar
- foram
- quando
- qual
- enquanto
- branco
- inteiro
- janela
- Fio
- de
- retraimento
- sem
- Atividades:
- trabalhou
- trabalhar
- X
- x-ray
- zefirnet