16 stycznia 2024 r
(Wiadomości Nanowerk) Kluczowa reakcja chemiczna – podczas której ruch protonów między powierzchnią elektrody a elektrolitem napędza prąd elektryczny – jest krytycznym etapem w wielu technologiach energetycznych, w tym w ogniwach paliwowych i elektrolizerach stosowanych do produkcji gazowego wodoru. Po raz pierwszy chemicy z MIT szczegółowo opracowali mapę, w jaki sposób zachodzą transfery elektronów sprzężonych z protonami na powierzchni elektrody. Ich wyniki mogą pomóc naukowcom w projektowaniu bardziej wydajnych ogniw paliwowych, akumulatorów lub innych technologii energetycznych. „Nasz postęp w tym artykule polegał na zbadaniu i zrozumieniu natury sposobu, w jaki te elektrony i protony łączą się na powierzchni, co jest istotne dla reakcji katalitycznych ważnych w kontekście urządzeń do konwersji energii lub reakcji katalitycznych” – mówi Yogesh Surendranath, specjalista ds. profesor chemii i inżynierii chemicznej w MIT oraz główny autor badania. Wśród swoich odkryć badacze byli w stanie dokładnie prześledzić, w jaki sposób zmiany pH roztworu elektrolitu otaczającego elektrodę wpływają na szybkość ruchu protonów i przepływ elektronów w elektrodzie. Absolwent MIT Noah Lewis jest głównym autorem artykułu, który ukazuje się dzisiaj w: Chemia przyrody („Mechanistyczne ramy na poziomie molekularnym dla międzyfazowej kinetyki przenoszenia elektronów sprzężonych z protonami”). Ryan Bisbey, były doktorant z MIT; Karl Westendorff, absolwent MIT; autorami artykułu są także Alexander Soudackov, pracownik naukowy na Uniwersytecie Yale.
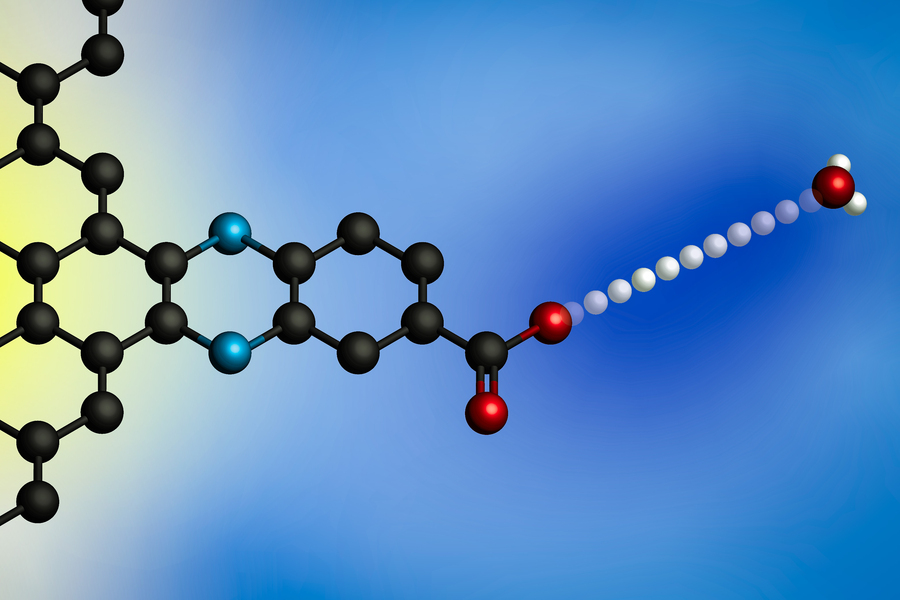 Przyłożenie potencjału elektrycznego powoduje przeniesienie protonu z jonu hydroniowego (po prawej) na powierzchnię elektrody. Wykorzystując elektrody z molekularnie określonymi miejscami wiązania protonów, badacze z MIT opracowali ogólny model międzyfazowych reakcji przeniesienia elektronów sprzężonych z protonami. (Zdjęcie: dzięki uprzejmości badaczy)
Przyłożenie potencjału elektrycznego powoduje przeniesienie protonu z jonu hydroniowego (po prawej) na powierzchnię elektrody. Wykorzystując elektrody z molekularnie określonymi miejscami wiązania protonów, badacze z MIT opracowali ogólny model międzyfazowych reakcji przeniesienia elektronów sprzężonych z protonami. (Zdjęcie: dzięki uprzejmości badaczy)
 Przyłożenie potencjału elektrycznego powoduje przeniesienie protonu z jonu hydroniowego (po prawej) na powierzchnię elektrody. Wykorzystując elektrody z molekularnie określonymi miejscami wiązania protonów, badacze z MIT opracowali ogólny model międzyfazowych reakcji przeniesienia elektronów sprzężonych z protonami. (Zdjęcie: dzięki uprzejmości badaczy)
Przyłożenie potencjału elektrycznego powoduje przeniesienie protonu z jonu hydroniowego (po prawej) na powierzchnię elektrody. Wykorzystując elektrody z molekularnie określonymi miejscami wiązania protonów, badacze z MIT opracowali ogólny model międzyfazowych reakcji przeniesienia elektronów sprzężonych z protonami. (Zdjęcie: dzięki uprzejmości badaczy)
Przechodzące protony
Przeniesienie elektronu sprzężonego z protonem ma miejsce, gdy cząsteczka, często woda lub kwas, przenosi proton na inną cząsteczkę lub na powierzchnię elektrody, co stymuluje akceptor protonów do przyjęcia elektronu. Ten rodzaj reakcji został wykorzystany w wielu zastosowaniach energetycznych. „Te reakcje przeniesienia elektronu sprzężonego z protonami są wszechobecne. Często stanowią kluczowe etapy mechanizmów katalitycznych i są szczególnie ważne w procesach konwersji energii, takich jak wytwarzanie wodoru lub kataliza w ogniwach paliwowych” – mówi Surendranath. W elektrolizerze wytwarzającym wodór podejście to stosuje się do usuwania protonów z wody i dodawania elektronów do protonów w celu wytworzenia gazowego wodoru. W ogniwie paliwowym energia elektryczna jest wytwarzana, gdy protony i elektrony są usuwane z gazowego wodoru i dodawane do tlenu, tworząc wodę. Przeniesienie elektronów sprzężonych z protonami jest powszechne w wielu innych typach reakcji chemicznych, na przykład w redukcji dwutlenku węgla (przemiana dwutlenku węgla w paliwa chemiczne poprzez dodanie elektronów i protonów). Naukowcy dowiedzieli się wiele o tym, jak zachodzą te reakcje, gdy akceptorami protonów są cząsteczki, ponieważ mogą precyzyjnie kontrolować strukturę każdej cząsteczki i obserwować, w jaki sposób elektrony i protony przechodzą między nimi. Jednakże, gdy na powierzchni elektrody następuje transfer elektronów sprzężonych z protonami, proces ten jest znacznie trudniejszy do zbadania, ponieważ powierzchnie elektrod są zwykle bardzo niejednorodne i zawierają wiele różnych miejsc, z którymi proton mógłby potencjalnie się związać. Aby pokonać tę przeszkodę, zespół MIT opracował sposób projektowania powierzchni elektrod, który zapewnia znacznie bardziej precyzyjną kontrolę nad składem powierzchni elektrody. Ich elektrody składają się z arkuszy grafenu z organicznymi związkami zawierającymi pierścienie przymocowanymi do powierzchni. Na końcu każdej z tych cząsteczek organicznych znajduje się ujemnie naładowany jon tlenu, który może przyjmować protony z otaczającego roztworu, co powoduje przepływ elektronu z obwodu na powierzchnię grafitową. „Możemy stworzyć elektrodę, która nie składa się z dużej różnorodności miejsc, ale stanowi jednolity układ jednego rodzaju bardzo dobrze zdefiniowanych miejsc, z których każde może wiązać proton z tym samym powinowactwem” – mówi Surendranath. „Ponieważ mamy te bardzo dobrze zdefiniowane lokalizacje, pozwoliło nam to naprawdę odkryć kinetykę tych procesów”. Korzystając z tego systemu, badacze byli w stanie zmierzyć przepływ prądu elektrycznego do elektrod, co pozwoliło im obliczyć szybkość przenoszenia protonu do jonu tlenu na powierzchni w stanie równowagi — stan, w którym tempo oddawania protonu do powierzchni i transfer protonów z powrotem do roztworu z powierzchni są równe. Odkryli, że pH otaczającego roztworu ma znaczący wpływ na tę szybkość: najwyższe wartości wystąpiły na skrajnych krańcach skali pH – pH 0, najbardziej kwaśne i pH 14, najbardziej zasadowe. Aby wyjaśnić te wyniki, badacze opracowali model oparty na dwóch możliwych reakcjach, które mogą wystąpić na elektrodzie. 3O+), które występują w dużym stężeniu w roztworach silnie kwaśnych, dostarczają protony na powierzchnię jonów tlenu, wytwarzając wodę. W drugim woda dostarcza protony na powierzchnię jonów tlenu, wytwarzając jony wodorotlenkowe (OH-), które występują w dużym stężeniu w roztworach silnie zasadowych. Jednakże szybkość przy pH 0 jest około cztery razy większa niż szybkość przy pH 14, po części dlatego, że hydronium oddaje protony szybciej niż woda.Reakcja do ponownego rozważenia
Ku swemu zaskoczeniu naukowcy odkryli również, że obie reakcje przebiegają z jednakową szybkością nie przy obojętnym pH 7, gdzie stężenia hydronium i wodorotlenku są równe, ale przy pH 10, gdzie stężenie jonów wodorotlenkowych jest 1 milion razy większe niż hydroni. Model sugeruje, że dzieje się tak dlatego, że reakcja postępowa obejmująca oddawanie protonów z hydronu lub wody ma większy udział w ogólnej szybkości niż reakcja wsteczna polegająca na usuwaniu protonów przez wodę lub wodorotlenek. Istniejące modele zachodzących tych reakcji na powierzchniach elektrod zakładają, że reakcje do przodu i do tyłu w równym stopniu przyczyniają się do ogólnej szybkości, więc nowe odkrycia sugerują, że konieczne może być ponowne rozważenie tych modeli – twierdzą naukowcy. „To domyślne założenie, że reakcje do przodu i do tyłu w równym stopniu przyczyniają się do szybkości reakcji” – mówi Surendranath. „Nasze odkrycie naprawdę otwiera oczy, ponieważ oznacza, że założenie, którego ludzie używają do analizowania wszystkiego, od katalizy ogniw paliwowych po wydzielanie wodoru, może być czymś, co powinniśmy ponownie rozważyć”. Naukowcy wykorzystują obecnie swój układ doświadczalny do badania, w jaki sposób dodanie różnych typów jonów do roztworu elektrolitu otaczającego elektrodę może przyspieszyć lub spowolnić przepływ elektronów sprzężonych z protonami. „Dzięki naszemu systemowi wiemy, że nasze miejsca są stałe i nie wpływają na siebie, więc możemy odczytać, jak zmiana roztworu wpływa na reakcję na powierzchni” – mówi Lewis.- Dystrybucja treści i PR oparta na SEO. Uzyskaj wzmocnienie już dziś.
- PlatoData.Network Pionowe generatywne AI. Wzmocnij się. Dostęp tutaj.
- PlatoAiStream. Inteligencja Web3. Wiedza wzmocniona. Dostęp tutaj.
- PlatonESG. Węgiel Czysta technologia, Energia, Środowisko, Słoneczny, Gospodarowanie odpadami. Dostęp tutaj.
- Platon Zdrowie. Inteligencja w zakresie biotechnologii i badań klinicznych. Dostęp tutaj.
- Źródło: https://www.nanowerk.com/news2/green/newsid=64425.php
- :ma
- :Jest
- :nie
- :Gdzie
- $W GÓRĘ
- 1
- 10
- 11
- 13
- 14
- 16
- 7
- 8
- a
- Zdolny
- O nas
- Akceptuj
- Dodaj
- w dodatku
- dodanie
- awansować
- oddziaływać
- wpływający
- Alexander
- dozwolony
- również
- wśród
- an
- w czasie rzeczywistym sprawiają,
- i
- Inne
- pojawia się
- aplikacje
- Stosowanie
- podejście
- SĄ
- Szyk
- AS
- założyć
- założenie
- At
- autor
- Autorzy
- z powrotem
- na podstawie
- podstawowy
- baterie
- BE
- bo
- być
- pomiędzy
- związania
- wiążący
- ale
- by
- obliczać
- CAN
- węgiel
- dwutlenek węgla
- Przyczyny
- komórka
- Komórki
- Centrum
- zmiana
- Zmiany
- naładowany
- chemiczny
- chemia
- Apteka
- wspólny
- skład
- stężenie
- stały
- kontekst
- przyczynić się
- przyczynia się
- kontrola
- Konwersja
- mógłby
- Para
- Stwórz
- krytyczny
- Aktualny
- Data
- sprawa
- Domyślnie
- zdefiniowane
- dostarczyć
- dostarcza
- Wnętrze
- detal
- rozwinięty
- urządzenia
- różne
- trudny
- odkryty
- Różnorodność
- do
- Nie
- robi
- darowizna
- na dół
- dyski
- każdy
- efekt
- wydajny
- elektryczny
- elektryczność
- elektrolit
- elektrony
- zakończenia
- kończy się
- energia
- Inżynieria
- równy
- Równie
- Równowaga
- Eter (ETH)
- wszystko
- ewolucja
- dokładnie
- przykład
- Przede wszystkim system został opracowany
- eksperymentalny
- Wyjaśniać
- skrajny
- szybciej
- znalezieniu
- Ustalenia
- i terminów, a
- pierwszy raz
- pływ
- W razie zamówieenia projektu
- Nasz formularz
- Dawny
- Naprzód
- znaleziono
- cztery
- Framework
- od
- Paliwo
- ogniwa paliwowe
- paliwa
- GAS
- Ogólne
- wygenerowane
- generujący
- generacja
- daje
- absolwent
- Grafen
- wspaniały
- zdarzyć
- uzbrojony
- Have
- Serce
- pomoc
- Wysoki
- Najwyższa
- W jaki sposób
- Jednak
- HTTPS
- Uwodornienia
- obraz
- ważny
- in
- Włącznie z
- najnowszych
- z udziałem
- IT
- jpg
- Karl
- Klawisz
- Uprzejmy
- Wiedzieć
- prowadzić
- dowiedziałem
- Chwytak
- wiele
- Może..
- znaczy
- zmierzyć
- Mechanizmy
- Środkowy
- milion
- MIT
- Absolwent MIT
- model
- modele
- cząsteczka
- jeszcze
- bardziej wydajny
- większość
- ruch
- ruch
- dużo
- Natura
- Potrzebować
- ujemnie
- Neutralny
- Nowości
- Noe
- już dziś
- obserwować
- przeszkoda
- występować
- miejsce
- of
- często
- on
- or
- organiczny
- Inne
- ludzkiej,
- na zewnątrz
- koniec
- ogólny
- Przezwyciężać
- Tlen
- Papier
- część
- szczególnie
- przechodzić
- Ludzie
- plato
- Analiza danych Platona
- PlatoDane
- możliwy
- potencjał
- potencjalnie
- precyzyjny
- precyzyjnie
- wygląda tak
- procesów
- produkować
- Profesor
- protony
- Kurs
- ceny
- reakcja
- Reakcje
- Czytaj
- naprawdę
- redukcja
- usuwanie
- usunąć
- Usunięto
- Odnawialne
- odnawialne źródła energii
- Badania naukowe
- Badacze
- Efekt
- ujawnia
- rewers
- prawo
- Ryan
- s
- taki sam
- powiedzieć
- mówią
- Skala
- Naukowiec
- Naukowcy
- druga
- senior
- ustawienie
- znaczący
- pojedynczy
- witryna internetowa
- Witryny
- powolny
- So
- rozwiązanie
- Rozwiązania
- coś
- prędkość
- Stan
- Ewolucja krok po kroku
- Cel
- stymuluje
- strongly
- Struktura
- student
- Badanie
- Studiowanie
- taki
- sugerować
- Wskazuje
- Powierzchnia
- niespodzianka
- otaczający
- system
- Brać
- zespół
- Technologies
- niż
- że
- Połączenia
- Państwo
- ich
- Im
- Te
- one
- to
- tych
- czas
- czasy
- do
- już dziś
- wyśledzić
- przenieść
- transfery
- drugiej
- rodzaj
- typy
- wszechobecny
- zrozumienie
- uniwersytet
- rozwikłać
- us
- używany
- za pomocą
- zazwyczaj
- początku.
- była
- Uzdatnianie wody
- Droga..
- we
- dobrze zdefiniowane
- były
- Co
- jeśli chodzi o komunikację i motywację
- który
- szeroki
- w
- w ciągu
- zefirnet