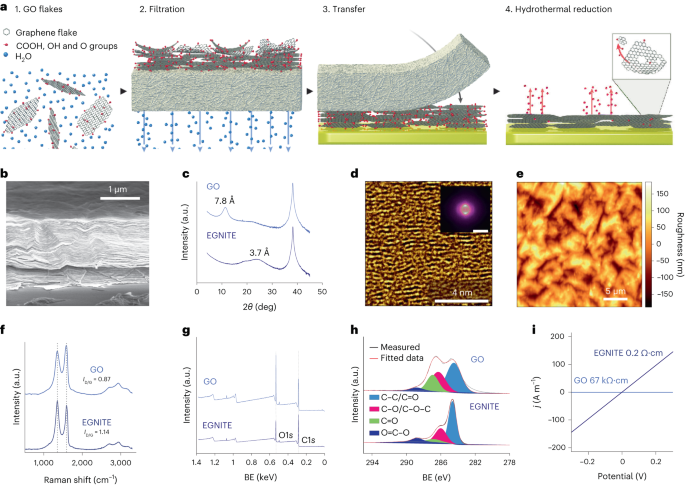
Materialforberedelse og karakterisering
Vandig GO-løsning ble fortynnet i avionisert vann for å oppnå en 0.15 mg ml-1 løsning og vakuumfiltrert gjennom en nitrocellulosemembran med porer på 0.025 µm, og danner en tynn film av GO. Den tynne filmen ble deretter overført til målsubstratet ved bruk av våt overføring i avionisert vann og ytterligere termisk gløding ved 100 °C i 2 min. GO film-substratstabelen ble hydrotermisk redusert ved 134 °C i en standard autoklav i 3 t for å danne EGNITE. Basissubstratet for alle karakteriseringsstudier av EGNITE var en kvadrat (1 × 1 cm2) av Si/SiO2 (400 μm/1 μm).
XPS
XPS-målinger ble utført med en Phoibos 150 analysator (SPECS) under ultrahøyvakuumforhold (grunntrykk, 5 × 10-10 mbar) med en monokromatisk Al Kα røntgenkilde (1,486.74 eV). Oversiktsspektre ble innhentet med en passenergi på 50 eV og trinnstørrelse på 1 eV og høyoppløselige spektre ble innhentet med passenergi på 20 eV og trinnstørrelse på 0.05 eV. Den totale oppløsningen i de siste forholdene er 0.58 eV, bestemt ved å måle hele bredden ved halvparten av Ag 3d5/2 topp av sputtered sølv. XPS-analysen viser en sterk reduksjon etter hydrotermisk behandling av C–O-toppen (assosiert med epoksidgrupper), men et lite bidrag av C–OH, C=O og C(O)OH på grunn av hydroksyler, karbonyler og karboksyler som forbli etter reduksjon. Dekonvolusjonen av O1s peak bekrefter slik oppførsel. Hovedbidraget til C1s signal etter den hydrotermiske reduksjonen kommer imidlertid fra sp2 hybridiserte C–C orbitaler34,57.
Røntgendiffraksjon
Røntgendiffraksjonsmålinger (θ-2θ skanning) ble utført i et Materials Research Diffractometer (Malvern PANalytical). Dette diffraktometeret har en horisontal ω-2θ goniometer (320 mm radius) i en fire-sirkel geometri og arbeidet med et keramisk røntgenrør med Cu Kα anode (λ = 1.540598 Å). Detektoren som brukes er en Pixcel som er en rask røntgendetektor basert på Medipix2 teknologi.
Raman-spektroskopi
Raman-spektroskopimålinger ble utført ved bruk av en Witec-spektrograf utstyrt med en 488 nm lasereksitasjonslinje. For målingene ble Raman-spektra innhentet ved bruk av et 50× objektiv og et 600 spor per nm gitter; lasereffekten ble holdt under 1.5 mW for å unngå prøveoppvarming.
TEM
En fokusert ionestrålelamell ble forberedt med en Helios NanoLab DualBeam (LMA-INA) for tverrsnittsstudien av EGNITE-prøven. Strukturelle analyser ble utført ved hjelp av TEM ved bruk av et Tecnai F20-mikroskop operert ved 200 kV, inkludert HRTEM og høyvinklet ringformet mørkfelt STEM-teknikker. STEM-EELS-eksperimentet ble utført i et Tecnai F20-mikroskop som arbeidet ved 200 KeV, med 5 mm blenderåpning, 30 mm kameralengde, en konvergensvinkel på 12.7 mrad og en samlingsvinkel på 87.6 mrad. Siden vi brukte 0.5 eV per piksel og 250 eV som startenergi i kjernetapsinnsamlingen, fikk vi ikke Si K-kanten forventet på 1,839 eV, Pt M-edge på 2,122 eV og Au M-edge ved 2,206 eV. Den relative C–O-atomsammensetningen er oppnådd ved å fokusere vår oppmerksomhet i det reduserte GO-laget og anta at de analyserte kantene (C og O i vårt tilfelle) summerer seg til 100 %. Denne antagelsen er gyldig i vårt tilfelle, som det fremgår av Tilleggsinformasjon kart. Energidifferensialtverrsnittet ble beregnet ved å bruke Hartree – Slater-modellen og bakgrunnen ved å bruke en modell med lav effekt.
Elektrisk Strømføringsevne
Elektrisk konduktivitetsmålinger ble utført ved bruk av et Keithley 2400 kildemåler i topunktskonfigurasjon. Prøvene som ble målt besto av EGNITE-filmer på 1 × 1 cm2 på toppen av en SiO2 underlag.
Dataanalyse
Røntgendiffraksjon, Raman og XPS-data ble analysert ved bruk av Python 3.7-pakker (Numpy, Pandas, Scipy, Xrdtools, Lmfit, Rampy, Peakutils, Matplotlib). Avstanden mellom planene ble beregnet fra røntgendiffraksjonsmålingene i henhold til Snells lov. Når dataene ble flyttet inn i det romlige domenet, ble maksimum av toppene tilpasset. Den tilsvarende avstanden ga en middelverdi av avstanden mellom planene. Avvik fra disse gjennomsnittsverdiene ble beregnet fra den fulle bredden ved halvparten av maksimumsdelen av de Lorentzianske tilpasningene til toppene på det romlige domenet. XPS- og Raman-spektroskopimålinger ble analysert ved å tilpasse en konvolusjon av topper på forventede steder for de tilsvarende funksjonene. Konduktivitetsverdiene til GO og EGNITE ble oppnådd ved å montere I-V kurver målt i elektrisk ledningsevnemålinger i henhold til Ohms lov. Data er n = 1 for hver måling.
Fleksibel array-fabrikasjon
Produksjonen av enhetene er vist i tilleggsfigur. 4. Enheter ble produsert på 4" Si/SiO2 (400 μm/1 μm) wafere. Først ble et 10 µm tykt lag med PI (PI-2611, HD MicroSystems) spinnbelagt på waferen og bakt i en atmosfære rik på nitrogen ved 350 °C i 30 min. Metalliske spor ble mønstret ved bruk av optisk litografi av bildereverseringsfotoresisten (AZ5214, Microchemicals). Elektronstrålefordampning ble brukt til å avsette 20 nm titan og 200 nm gull, og løftet ble utført. Vi brukte en EGNITE-film på rundt 1 μm tykkelse som en avveining mellom elektrokjemisk ytelse og array-fleksibilitet. Etter overføring av GO-filmen ble aluminium e-beam fordampet og områder på toppen av fremtidige mikroelektroder ble definert ved å bruke en negativ fotoresist (nLOF 2070, Microchemicals) og løfte av. Deretter ble GO-filmen etset overalt bortsett fra de fremtidige mikroelektrodene ved å bruke en oksygenreaktiv ionetsing (RIE) i 5 minutter ved 500 W, og de beskyttende aluminiumskolonnene ble etset med en fortynnet løsning av fosforsyre og salpetersyre. Deretter ble et 3 µm tykt lag av PI-2611 avsatt på waferen og bakt som tidligere beskrevet. PI-2611-åpninger på mikroelektroden ble deretter definert ved bruk av en positiv tykk fotoresist (AZ9260, Microchemicals) som fungerte som en maske for en påfølgende oksygen-RIE. Senere ble enhetene mønstret på PI-laget, igjen ved bruk av AZ9260 fotoresist og RIE. Fotoresistlaget ble deretter fjernet i aceton og waferen renset i isopropylalkohol og tørket ut. Til slutt ble enhetene skrellet av waferen og var klare til å plasseres i steriliseringsposer for å bli hydrotermisk behandlet ved 134 °C i en standard autoklav i 3 timer.
Elektrokjemisk karakterisering av mikroelektroder
Elektrokjemisk karakterisering av mikroelektrodene ble utført med en Metrohm Autolab PGSTAT128N potensiostat i 1× PBS (Sigma-Aldrich, P4417) inneholdende 10 mM fosfatbuffer, 137 mM NaCl og 2.7 mM K-konfigurasjon ved pH 7.4-45093 Cl og pH-konfigurasjon XNUMX En Ag/AgCl-elektrode (FlexRef, WPI) ble brukt som referanse og en platinatråd (Alfa Aesar, XNUMX) ble brukt som motelektrode.
Før ytelsesevaluering ble elektrodene pulsert med 10,000 1 ladningsbalanserte pulser (15 ms, 100 µA). Eksponering av elektroder for kontinuerlige pulserende protokoller fortsatte med 0.9 sykliske voltammetri-sykluser (-0.8 til +50 V) ved XNUMX mV s-1, 20 repetisjoner på 5,000 pulser (1 ms) og redebestemmelse av åpen kretspotensial.
Dataanalyse
Elektrokjemiske karakteriseringsdata ble analysert ved bruk av Python 3.7-pakker (Numpy, Pandas, Scipy, Pyeis, Lmfit, Matplotlib). Impedansspektroskopidata ble tilpasset en ekvivalent elektrisk modell bestående av en motstand (R) i serie med et konstantfaseelement (CPE). Derfra ble CPE-verdien tilnærmet til en kapasitans og delt med mikroelektrodens geometriske areal for å oppnå en ekvivalent verdi for grensesnittskapasitansen til EGNITE. Microelectrode charge storage capacitance (CSC) ble beregnet fra sykliske voltammetrimålinger ved å integrere de katodiske og anodiske regimene til den målte strømmen og normalisere med skannehastigheten. Den katodiske og anodiske ladningslagringskapasitansen (cCSC og aCSC) ved 100 mV skannehastighet for EGNITE er 45.9 ± 2.4 og 34.6 ± 2.8 mC cm-2, henholdsvis (n = 3). Som rapportert for andre materialer58, de oppnådde CSC-ene avhenger av skannehastigheten (tillegg Fig. 5). For å vurdere tilstedeværelsen av oksygenreduksjonsreaksjoner, målte vi CV-bølgeformen under nitrogenspylet elektrolytt59 og observerte ikke vesentlige forskjeller i bølgeform (tillegg Fig. 6). Resultatene våre adresserer imidlertid ikke helt virkningen av oksygenreduksjonsreaksjoner i ladningsinjeksjonskapasiteten til EGNITE, og ytterligere arbeid må gjøres for å undersøke dette ordentlig. Mikroelektrodeladningsinjeksjonskapasitet (CIC) ble etablert ved å bestemme strømpulsamplituden som fremkalte en spenningsforskjell (etter fjerning av det ohmske fallet) som samsvarte med det elektrokjemiske vannvinduet for elektrode (−0.9 V for katodisk og +0.8 V for anodisk versus Ag/AgCl ) (Supplerende Fig. 17)60.
Statistisk analyse
Data er gjennomsnitt± s.d., n = 18 for EIS og n = 3 for kronopotensiometrier. Data for kartet over katodisk kapasitiv spenningsutslag er gjennomsnittet av katodisk kapasitive spenningsutslag for en hendelse for hver pulsform av n = 3 elektroder.
Mekanisk stabilitetsvurdering
Ultralyd sonikering
EGNITE-elektroder ble plassert inne i et beger fylt med vann i et ultralydvannbad (Elmasonic P 180H). Sonikering ble påført ved 37 kHz i 15 min ved 200 W, og etterfulgt av ytterligere 15 min med sonikering ved 37 kHz med effekten hevet til 300 W. Bilder av elektroder ble tatt før og etter sonikeringstrinnene.
Bøyetest
Bøyeoppsettet (fig. 2k) besto av tre sylindriske stenger; den midterste (diameter, 700 µm) ble senket ned, noe som ga bøyningsvinkler på 131°. Tre fleksible mikroelektrodematriser ble brukt for bøyetesten. Hver gruppe inneholdt 18 mikroelektroder med en diameter på 50 µm. To arrays ble målt etter 10 og 20 sykluser mens en enhet ble målt kun i 10 sykluser da den ble skadet under håndtering etter måling. Bøyetestsyklusen besto av en 10 s lang lastpåføring pluss 10 s uten belastning. Enheter ble elektrokjemisk karakterisert (EIS og CV) før og etter 10 og 20 bøyesykluser.
Epikortisk nevrale opptak
Epikortisk implantasjon
Alle eksperimentelle prosedyrer ble utført i samsvar med anbefalingene fra European Community Council og fransk lovgivning for stell og bruk av forsøksdyr. Protokollene ble godkjent av Grenobles etiske komité (ComEth) og autorisert av det franske departementet (nummer 04815.02). Sprague-Dawley-rotter (hann, 4 måneder gammel, veiende -600 g) ble bedøvet intramuskulært med ketamin (50 mg per kg (kroppsvekt)) og xylazin (10 mg per kg (kroppsvekt)), og deretter festet til en stereotaksisk holder. Fjerning av den temporale hodeskallen eksponerte den auditive cortex. Dura mater ble bevart for å unngå å skade det kortikale vevet. Et hull ble boret i toppunktet for å sette inn referanseelektroden, og et andre hull, 7 mm mot fronten fra det første, ble boret for å sette inn jordelektroden. Elektrodene var 0.5 mm tykke pinner brukt for integrerte kretskontakter. De ble plassert for å få elektrisk kontakt med dura mater og festet til skallen med dental sement. Vi monterte deretter overflatemikroelektrodebåndet på den auditive cortex som vist i fig. 3b. Venemønstrene identifiserer den auditive cortex, i område 41 av Kriegs rottehjernekart. Kortikale signaler ble samtidig forsterket med en forsterkning på 1,000 og digitalisert med en samplingshastighet på 33 kHz. En høyttaler 20 cm foran øret til en rotte, kontralateralt til den eksponerte cortex, ga akustiske stimuli. Stimuliene som ble levert ble overvåket av en 0.25-tommers mikrofon (Brüel & Kjaer, 4939) plassert nær øret og presentert i lydtrykknivå (dB SPL re 20 μPa). Vi undersøker de toppunktspositive (negative opp) responsene med middels latens fremkalt av alternerende klikk ved 80 dB SPL, og toneburststimuli ved 70 dB SPL med frekvenser fra 5 til 40 kHz, en stige- og falltid på 5 ms og en varighet på 200 ms.
Dataanalyse
Elektrofysiologiske data ble analysert ved bruk av Python 3.7-pakker (Numpy, Pandas, Scipy, Neo, Elephant, Sklearn Matplotlib) og det tilpassede biblioteket PhyREC (https://github.com/aguimera/PhyREC). r.m.s. verdiene ble beregnet med et skyvevindu på 20 ms ved frekvenser over 200 Hz. Spektrogrammer ble beregnet for et område mellom 70 Hz og 1.1 kHz. PSD ble beregnet over 60 s med kontinuerlige opptak. For en gitt elektrodegruppe ble to PSD-er beregnet: in vivo (IV) og post-mortem (PM). SNR er uttrykt i dB (20 × ln(r.m.s.(IV)/r.m.s.(PM))) og interpolert for 20 punkter logaritmisk fordelt mellom 10 Hz og 1 kHz.
Statistisk analyse
Epikortiske nevrale data presentert i fig. 3 er tatt fra individuelle målinger på et enkelt dyr. I fig. 3c, er data fra 64 elektroder presentert. I fig. 3d, presenteres data fra to utvalgte elektroder. I fig. 3f, beregnes PSD og SNR fra 64 EGNITE-elektroder og vises som gjennomsnitt ± s.d. I tilleggsfig. 12c,d median data er presentert for 192 EGNITE elektroder fra n = 3 eksperimenter og 60 platinaelektroder fra n = 1 eksperiment.
Intrakortikal nevrale opptak
Intrakortikal implantasjon
Dyrene ble bedøvet med en blanding av ketamin/xylazin (75:1, 0.35 ml/28 g i.p.), og denne tilstanden ble opprettholdt med en inhalasjonsmaske som ga 1.5 % isofluran. Flere mikroskruer ble plassert inn i skallen for å stabilisere implantatet, og den på toppen av lillehjernen ble brukt som en generell grunn. Sonden ble implantert i den prefrontale cortex (koordinater: AP, 1.5 mm; ML, ±0.5 mm; DV, -1.7 mm fra bregma). Implantasjonen ble utført ved å belegge proben med maltose (se protokoll nedenfor) for å gi midlertidig probestivhet og lette innsetting av probe. Sonden ble forseglet med dental sement. TDT-ZifClip-kontakter ble brukt til å koble sonden til det elektrofysiologiske systemet via en miniatyrisert kabel. Etter operasjonen gjennomgikk musen en restitusjonsperiode på 1 uke med analgesi (buprenorfin) og anti-inflammatorisk (meloksikam) behandling. Nevral aktivitet ble registrert med flerkanals Open Ephys-systemet ved en samplingshastighet på 30 kHz med en Intan RHD2132-forsterker. De auditive oppgaveeksperimentene ble utført i en lydisolert boks, med to høyttalere inne ved bruk av protokoller basert på tidligere beskrevet arbeid61. Lydstimulusen besto av et 15 ms langt hvitt støyklikk, gjentatt 100 ganger (sykluser), hver atskilt med 5 s (interstimulusintervall). Under oppgaven kunne dyret bevege seg fritt.
Maltose-avstivningsprotokoll
En vandig løsning av maltose varmes opp til glassovergangspunktet (Tg), mellom 130 og 160 °C, ved bruk av en kokeplate eller mikrobølgeovn. Når maltosen er tyktflytende, bringes baksiden av sonden kun i kontakt med maltosen. Når maltosen avkjøles, stivner den og stivner sonden.
Dataanalyse
Nevrale signaler fra hver elektrode ble filtrert offline for å trekke ut SUA og LFPer. SUA ble estimert ved å filtrere signalet mellom 450 og 6,000 Hz, og toppene fra individuelle nevroner ble sortert ved hjelp av hovedkomponentanalyse med Offline Sorter v.4 (Plexon). For å oppnå LFP-er ble signalene nedsamplet til 1 kHz, detrendet og hakkfiltrert for å fjerne støylinjeartefakter (50 Hz og dens harmoniske) med spesialskrevne skript i Python. AEP SNR ble beregnet som forholdet mellom topp N1-amplituden og s.d. av en 20 ms periode før stimulansen.
Statistisk analyse
Data vist i fig. 3 t, jeg er gjennomsnitt± s.d., n = 30 som antall gjennomsnittlige forsøk. Data registrert fra samme elektrode vises på dag 30, 60 og 90. Data fra et enkelt dyr presenteres.
Kronisk epikortisk biokompatibilitet
Kirurgisk implantasjon av enheter
Totalt 27 voksne hannrotter Sprague-Dawley ble brukt til denne studien (Charles River). Dyrene ble holdt ved en omgivelsestemperatur på 21 ± 2 °C og en fuktighet på 40–50 %, i en 12 t lys/12 t mørke syklus. Rotter ble holdt i grupper og gitt fri tilgang til diett og vann gjennom hele forsøksperioden. Eksperimentelle prosedyrer ble utført i samsvar med Animal Welfare Act (1998), under godkjenning av UK Home Office og det lokale dyrevelferds etiske vurderingsorganet (AWERB). Dyrene ble bedøvet med isofluran (2–3 %) under operasjonens varighet, og dybden av anestesi ble overvåket med tåklemmereflekstesten. Dyrene ble plassert i en stereotaksisk ramme (Kopf, 900LS), plassert over et termisk teppe for å opprettholde kroppstemperaturen. Et kraniotomihull (-5 mm ×4 mm) ble laget 1 mm fra midtlinjen ved å bruke et tannbor med en 0.9 mm borekrone, duraen ble fjernet og den epikortikale enheten plassert på den kortikale overflaten av hjernen. Kraniotomihullet ble forseglet med Kwik-sil, etterfulgt av dental sement for å sikre, og huden suturert lukket. Subkutane injeksjoner av saltvann (1 ml per kg (kroppsvekt)) og buprenorfin (0.03 mg per kg (kroppsvekt)) ble gitt for å erstatte tapt væske og redusere postoperativ smerte, og anestesi ble trukket tilbake.
Vevinnsamling og behandling
Dyrene ble avsluttet 2, 6 eller 12 uker etter implantasjon ved hjelp av en passende metode for den type analyse som skulle utføres.
Histologi og immunhistokjemi
2, 6 eller 12 uker etter implantasjon ble rotter avsluttet via hjerteperfusjon med heparinisert (10 U ml-1, Sigma-Aldrich) PBS, etterfulgt av 4% paraformaldehyd (PFA, Sigma-Aldrich) i PBS. Hjerner ble postfiksert i 4 % PFA i 24 timer, deretter overført til 30 % sukrose i PBS i minst 48 timer før frysing i isopentan. Hjernene ble deretter lagret ved -80 °C inntil kryosnitt ved 25 µm. Vevet ble deretter farget for ionisert kalsiumbindende adaptermolekyl 1 (Iba-1) for å bestemme nivået av mikroglial aktivering. Kort fortalt ble vevsseksjoner blokkert med 5 % geiteserum i PBS med 0.1 % Triton-X i 1 time før inkubering over natten ved 4 °C med det primære antistoffet anti-Iba-1 (1:1,000, 019-19741; Wako). Snitt ble deretter farget med sekundært antistoff, anti-kanin Alexa Fluor 594 (1:400, A-11012; Thermo Fisher) i 1 time ved romtemperatur. Objektglassene ble montert med dekkglass ved bruk av Prolong Gold anti-fade monteringsmedier med 4,6-diamidino-2-phenylindole (Thermo Fisher). Sonden dekket et område på 3 × 3.7 mm2 på den kortikale overflaten av hjernen; vevssnitt valgt for farging dekket 3.2 mm i lengde av denne regionen. Objektglass ble avbildet ved hjelp av en 3DHistech Pannoramic-250 mikroskop lysbildeskanner ved 20× og bilder ble analysert ved bruk av CaseViewer v.2.4 (3DHistech). For å vurdere mikroglia-aktivering ble et 3.2 mm område dekket, med ett bilde analysert hver 100 µm. Bilder ble tatt med 8.5 × forstørrelse som detaljerte en del av det epikortikale probestedet, 3 mm fra hjernens midtlinje, og omfattet området direkte under sondestedet.
Bildebehandling
Mikroskopidataene ble bildebehandlet ved bruk av en algoritme for mikroglia-fenotypekarakterisering (tillegg Fig. 13). Mikroglial aktivering ble analysert ved hjelp av en tilpasset CellProfiler* (Broad Institute, v.3.1.9 fra https://cellprofiler.org/) rørledning. Først ble EnhanceOrSuppressFeatures-modulen brukt til å forbedre filamentøse strukturer som neuritter ved å bruke tubeness-forbedringsmetoden. Fra de forbedrede bildene ble celler segmentert ved hjelp av IdentifyPrimaryObjects-modulen. Foreløpige målinger av cellene antydet at det passende objektdiameterområdet var 3–40 piksler. Objekter utenfor dette diameterområdet eller som berører kanten av bildet ble forkastet. Cellene ble segmentert ved å bruke en to-klasses Otsu adaptiv terskelstrategi med en adaptiv vindusstørrelse på 50 piksler. Objektene identifisert av IdentifyPrimaryObjects-modulen ble lagt inn i MeasureObjectSizeShape-modulen for å beregne de nødvendige egenskapene for celleklassifisering. I ClassifyObjects-modulen ble kategorien for å basere klassifikasjoner spesifisert til å være AreaShape, og Extent ble valgt som tilsvarende måling. Cellene ble klassifisert som 'aktivert' eller 'ikke-aktivert' basert på deres Extent-egenskap, som er forholdet mellom arealet okkupert av cellen og området okkupert av dens avgrensningsramme. Denne klassifiseringstilnærmingen ble rasjonalisert av det faktum at aktiverte mikroglia har store cellelegemer og ingen prosesser, og dermed okkuperer en langt større andel av deres avgrensende bokser enn deres ikke-aktiverte motstykker. Til slutt ble CalculateMath og ExportToSpreadsheet-modulene brukt til å beregne og skrive ut ønsket statistikk.
Statistisk analyse
Datasett er n = 3 for hver enhetstype (PI-kun implantat (PI); PI med eksponert mikrofabrikert gull (gull); og PI med mikrofabrikert gull og EGNITE (EGNITE) til enhver tid) med unntak av 6 ukers gull som er n = 2 for ELISA-data. Kontralaterale halvkuler ble kombinert på hvert tidspunkt for å gi n = 9 ved 2 og 12 uker etter implantasjon og n = 8 ved 6 uker etter implantasjon. Analyse av dataene ble gjort ved å bruke GraphPad Prism v.8 programvare. Statistisk analyse ble fullført ved å bruke en toveis variansanalyse (ANOVA) med Tukeys multiple-sammenligningstest der det var hensiktsmessig; P < 0.05 ble ansett å være signifikant.
ELISA
Etter implantasjonsperioden ble dyrene avsluttet ved cervikal dislokasjon. Hjernevev ble ekstrahert fra både høyre og venstre hjernehalvdel, hurtigfrosset i flytende nitrogen og lagret ved -80 °C inntil videre bruk. Vev ble lysert ved bruk av NP-40 lyseringsbuffer (150 mM NaCl, 50 mM Tris-Cl, 1 % Nonidet P40-erstatning, Fluka, pH justert til 7.4) inneholdende protease og fosfatasehemmer (Halt Protease og Phosphatase Inhibitor Fishtail, Thermoocker Cocktail), etterfulgt av mekanisk forstyrrelse av vevet (TissueLyser LT, Qiagen). Prøver ble deretter sentrifugert i 10 min ved 5,000 rpm, og supernatanten lagret ved 4°C inntil videre bruk. LEGENDplex Rat Inflammation Panel (katalognummer 740401, BioLegend), et perlebasert multipleks ELISA-sett, ble kjørt for å kvantifisere følgende cytokiner; IL-1α, IL-1β, IL-6, IL-10, IL-12p70, IL-17A, IL-18, IL-33, CXCL1 (KC), CCL2 (MCP-1), granulocytt-makrofagkolonistimulerende faktor, interferon-y og tumornekrosefaktor. Settet ble kjørt i henhold til produsentens instruksjoner, med protein lastet med et fast volum på 15 µl. Etter inkubering med supernatant ble kulene kjørt på et BD FACSVerse flowcytometer, og dataene analysert ved bruk av LEGENDplex dataanalyseprogramvare.
Nevral stimulering
Intrafasikulær implantasjon
Alle dyreforsøk ble godkjent av den etiske komiteen ved Universitat Autònoma de Barcelona i samsvar med EUs rådsdirektiv 2010/63/EU. Dyrene ble holdt ved 22 ± 2 °C under en 12 t lys/12 t mørke syklus med mat og vann fritt tilgjengelig. Isjiasnerven til bedøvede Sprague-Dawley hunnrotter (250–300 g, -18 uker gammel) ble kirurgisk eksponert og TIME-elektrodene ble implantert på tvers av isjiasnerven ved hjelp av en rett nål festet til en 10-0 løkketråd46. Prosessen ble overvåket under et disseksjonsmikroskop for å sikre riktig posisjon av de aktive stedene inne i nervefasciklene (fig. 4b). Under forsøkene ble dyrets kroppstemperatur opprettholdt med en varmepute.
Nervestimulering ble utført ved å påføre tog av bifasiske strømpulser med en fast varighet på 100 µs per fase og øke amplitude fra 0 til 150 µA i trinn på 1 eller 3 µA ved 3 Hz i 33 s (stimulator DS4, Stimulator DS13) mikroelektroder. Samtidig ble CMAP-ene registrert fra GM-, TA- og PL-muskler ved bruk av små nåleelektroder (0.4 mm lange, 03 mm diameter, nåleelektroder i rustfritt stål A-14-XNUMXBEP, Bionic) plassert i hver muskel62. Den aktive elektroden ble plassert på muskelmagen og referansen i nivå med senen. Elektromyografiopptak ble forsterket (×100 for GM og TA, ×1,000 for PL; P511AC forsterkere, Grass), båndpassfiltrert (3 Hz til 3 kHz) og digitalisert med et PowerLab-opptakssystem (PowerLab16SP, ADHz20 ved kHXNUMX .
Dataanalyse
Amplituden til hver CMAP ble målt fra baseline til den maksimale negative toppen. Spenningstoppmålingene ble normalisert til maksimal CMAP-amplitude oppnådd for hver muskel i eksperimentet. En selektivitetsindeks (SI) ble beregnet for hvert aktivt sted som forholdet mellom den normaliserte CMAP-amplituden for én muskel, CMAPi, og summen av de normaliserte CMAP-amplitudene i de tre musklene, etter formelen SIi = nWCPAi/∑nWCPAj, ved minimum stimuleringsstrømamplitude som fremkalte en minimal funksjonelt relevant muskelrespons (definert som minst 5 % CMAP-amplitude for en av musklene med hensyn til maksimal CMAP-amplitude til den muskelen som tidligere var bestemt). Deretter ble de aktive stedene med høyest SI for hver av de tre musklene valgt som SI-er for hver muskel i et gitt eksperiment.
Kronisk intraneural biokompatibilitet
Etter en tidligere rapportert prosedyre50,63, isjiasnerven til bedøvede Sprague-Dawley hunnrotter (250-300 g, -18 uker gammel) ble eksponert og enhetene for in vivo biokompatibilitet med og uten EGNITE ble implantert på langs i tibialgrenen av isjiasnerven (n = 6–8 per gruppe). Kort fortalt, er nerven gjennomboret ved trifurkasjonen med en rett nål festet til en 10-0 løkketråd (STC-6, Ethicon); tråden trekker den pilformede spissen av den bøyde elektrodestrimmelen. Spissen kuttes for å ta bort tråden, og tuppene på hver arm er lett bøyd for å unngå at enheten trekkes ut. Et langsgående implantat ble valgt fordi det muliggjør en bedre studie av fremmedlegemeresponsen inne i nerven50.
Nerve- og dyrefunksjonsvurdering
Dyr ble evaluert under oppfølging etter implantasjon ved hjelp av nerveledning, algesimetri og gangsti-bevegelsestester62. For ledningstester ble isjiasnerven til de implanterte og kontralaterale potene stimulert av nåleelektroder ved isjias-hakket og CMAP til PL-muskelen ble registrert som ovenfor. Latensen og amplituden til CMAP ble målt. For algesimetritesten ble rotter plassert på en trådnettplattform og en mekanisk ikke-skadelig stimulus ble påført med en metallspiss koblet til et elektronisk Von Frey algesimeter (Bioseb). Den nociseptive terskelen (kraft i gram som dyrene trakk labben ved) for implanterte versus kontralaterale poter ble målt. For gangstitesten ble plantaroverflaten på bakpotene malt med svart blekk og hver rotte fikk gå langs en korridor. Fotavtrykkene ble samlet, og isjiasfunksjonsindeksen beregnet62.
histologi
Etter 2 eller 8 uker ble dyrene perfusert med PFA (4%), og isjiasnervene ble høstet, postfiksert, kryokonservert og behandlet for histologisk analyse. For evaluering av FBR ble isjiasnerver kuttet i 15 μm tykke tverrsnitt med en kryostat (Leica CM190). Prøver ble farget med primære antistoffer for myeliniserte aksoner (anti-RT97 for å merke Neurofilament 200K, 1:200; Developmental Studies Hybridoma Bank) og makrofager (anti-Iba-1, 1:500; Wako). Deretter ble seksjoner inkubert i 1 time ved romtemperatur med sekundære antistoffer esel-anti-mus Alexa Fluor 488 og esel-anti-kanin Alexa Fluor 555 (1:200, Invitrogen). Representative seksjoner fra den sentrale delen av implantatet i tibialnerven ble valgt, bilder tatt med et epifluorescensmikroskop (Eclipse Ni, Nikon) festet til et digitalkamera (DS-Ri2, Nikon) og bildeanalyse utført med ImageJ-programvare (National Institutes av helse). Mengden av Iba-1-positive celler i hele området av tibialisnerven ble kvantifisert og tykkelsen på vevskapselen ble målt som gjennomsnittlig avstand fra hver side av implantatet til de nærmeste aksonene.
Statistisk analyse
For statistisk analyse av data brukte vi en- eller toveis ANOVA etterfulgt av Bonferroni post hoc-test for forskjeller mellom grupper eller tider. GraphPad Prism programvare ble brukt til grafisk representasjon og analyse. Statistisk signifikans ble vurdert når P <0.05.
Rapporteringssammendrag
Mer informasjon om forskningsdesign er tilgjengelig i Sammendrag av naturporteføljerapportering knyttet til denne artikkelen.
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://www.nature.com/articles/s41565-023-01570-5
- : har
- :er
- :ikke
- :hvor
- ][s
- $OPP
- 000
- 1
- 10
- 100
- 12
- 13
- 130
- 15%
- 150
- 160
- 19
- 1998
- 20
- 200
- 2010
- 2011
- 2014
- 2016
- 2018
- 2020
- 2022
- 22
- 24
- 25
- 250
- 26
- 27
- 28
- 30
- 300
- 320
- 33
- 35%
- 350
- 40
- 400
- 41
- 43
- 46
- 50
- 500
- 54
- 58
- 60
- 600
- 7
- 70
- 700
- 75
- 8
- 80
- 87
- 9
- 90
- a
- I stand
- ovenfor
- adgang
- samsvar
- Ifølge
- akustisk
- erverve
- ervervet
- oppkjøp
- tvers
- Handling
- aktivert
- Aktivering
- aktiv
- aktivitet
- adaptive
- Ytterligere
- adresse
- justert
- Voksen
- Etter
- AG
- en gang til
- AL
- Alkohol
- Alexa
- algoritme
- Alle
- tillater
- langs
- am
- Omgivende
- beløp
- Amplified
- an
- analyser
- analyse
- Anchor
- og
- dyr
- dyr
- antistoffer
- antistoff
- hverandre
- Søknad
- anvendt
- påføring
- tilnærming
- hensiktsmessig
- godkjenning
- godkjent
- ER
- AREA
- områder
- ARM
- rundt
- Array
- Artikkel
- AS
- vurdere
- evaluering
- assosiert
- forutsetningen
- At
- Atmosfære
- atomic
- oppmerksomhet
- autorisert
- tilgjengelig
- unngå
- borte
- bakgrunn
- Bank
- barcelona
- basen
- basert
- Baseline
- BD
- BE
- Beam
- fordi
- vært
- før du
- atferd
- under
- Bedre
- mellom
- bindende
- biomedisinsk
- Bit
- Svart
- blokkert
- organer
- kroppen
- både
- Eske
- bokser
- Brain
- hjerner
- Branch
- kort
- bred
- brakte
- buffer
- men
- by
- kabel
- beregne
- beregnet
- rom
- kapasitiv
- Kapasitet
- hvilken
- gjennomført
- saken
- Kategori
- ccl2
- celle
- Celler
- sement
- sentral
- utfordringer
- karakterisert
- kostnad
- Charles
- kjemisk
- valgt ut
- klassifisering
- klassifisert
- klikk
- stengt
- cocktail
- samling
- kolonner
- kombinert
- kommer
- Utvalget
- Communities
- samfunnet
- Terminado
- sammensetning
- forhold
- gjennomført
- ledningsevne
- Konfigurasjon
- Koble
- tilkoblet
- ansett
- Består
- konstant
- kontakt
- inneholdt
- kontinuerlig
- bidrag
- Konvergens
- korrigere
- Tilsvarende
- korridor
- cortex
- Råd
- kolleger
- kurs
- dekket
- kritisk
- Kryss
- kryokonservert
- Gjeldende
- skikk
- Kutt
- syklus
- sykluser
- cytokiner
- skade
- mørk
- dato
- dataanalyse
- Dager
- de
- redusere
- anses
- definert
- den
- levert
- avhenge
- innskudd
- deponert
- dybde
- beskrevet
- utforming
- ønsket
- detaljert
- Bestem
- bestemmes
- bestemme
- utviklingsmessige
- enhet
- Enheter
- gJORDE
- Kosthold
- forskjell
- forskjeller
- forskjellig
- digitalt
- digitalisert
- fortynnet
- direkte
- direkte
- forvridning
- Avbrudd
- avstand
- Divided
- do
- domene
- gjort
- ned
- Drop
- to
- varighet
- under
- E&T
- hver enkelt
- Edge
- Elektrisk
- elektronisk
- element
- elefant
- forhøyet
- altomfattende
- energi
- forbedre
- forbedret
- ekstrautstyr
- sikre
- utstyrt
- Tilsvarende
- etablert
- anslått
- Eter (ETH)
- etisk
- EUR
- europeisk
- EV
- evaluert
- evaluering
- Event
- Hver
- overalt
- dokumentert
- undersøke
- unntak
- forventet
- eksperiment
- eksperimentell
- eksperimenter
- utsatt
- Eksponering
- uttrykte
- grad
- trekke ut
- legge til rette
- Faktisk
- faktor
- Fall
- langt
- FAST
- Egenskaper
- hunn
- Fiken
- Figur
- fylt
- Film
- filmer
- filtrering
- Endelig
- Først
- fitting
- fikset
- fleksibilitet
- fleksibel
- flyten
- fokuserte
- fokusering
- fulgt
- etter
- mat
- Til
- Tving
- utenlandske
- skjema
- formel
- RAMME
- Gratis
- fritt
- frysing
- Fransk
- fra
- foran
- frossen
- fullt
- fullt
- funksjonelle
- funksjonelt
- videre
- framtid
- Gevinst
- ga
- general
- geometri
- Gi
- gitt
- glass
- GM
- Go
- Gull
- graphene
- gress
- Ground
- Gruppe
- Gruppens
- retningslinjer
- HAD
- Halvparten
- Håndtering
- Ha
- Helse
- hjelpe
- halvkuler
- høy oppløsning
- høyest
- holder
- Hole
- Hjemprodukt
- Hjemmekontor
- Horisontal
- HOT
- Men
- HTTPS
- Huang
- i
- identifisert
- identifisere
- IEEE
- bilde
- bildeanalyse
- bilder
- Påvirkning
- in
- Inkludert
- økende
- inkubert
- INKUBASJON
- indeks
- individuelt
- betennelse
- informasjon
- inngang
- innsiden
- Institute
- instruksjoner
- integrert
- Integrering
- tiltenkt
- Interface
- grensesnitt
- inn
- undersøke
- IT
- DET ER
- holdt
- kit
- Koch
- Etiketten
- laboratorium
- stor
- større
- laser
- Siste
- Ventetid
- seinere
- Law
- lag
- minst
- venstre
- Lovgivning
- Lengde
- Nivå
- Bibliotek
- i likhet med
- begrensninger
- linje
- LINK
- knyttet
- Flytende
- laste
- lokal
- ligger
- steder
- Lang
- langsiktig
- tapte
- senket
- makrofager
- laget
- Hoved
- vedlikeholde
- gjøre
- kart
- Kart
- maske
- matchet
- materiale
- materialer
- matplotlib
- maksimal
- mc
- bety
- midler
- målte
- måling
- målinger
- måling
- mekanisk
- Media
- metall
- metode
- microglia
- mikrofon
- Mikroskop
- mikros~~POS=TRUNC
- Middle
- minutter
- minimal
- minimum
- departement
- blanding
- ML
- modell
- modeller
- moduler
- Moduler
- molekyl
- overvåket
- måneder
- mus
- flytte
- flyttet
- MS
- flerkanals
- muskel
- nanoteknologi
- nasjonal
- National Institutes of Health
- Natur
- Nær
- nødvendig
- nekrose
- behov
- negativ
- NEO
- nett
- nettverk
- neural
- neurofilament
- Nerveceller
- neste
- Nei.
- Bråk
- Antall
- følelsesløs
- objekt
- Målet
- gjenstander
- observere
- få
- innhentet
- of
- off
- Office
- offline
- Gammel
- on
- gang
- ONE
- bare
- åpen
- åpninger
- operert
- or
- Annen
- vår
- ut
- produksjon
- utenfor
- enn
- samlet
- over natten
- oversikt
- Oksygen
- pakker
- pad
- Smerte
- pandaer
- panel
- del
- passere
- mønstre
- PAWS
- PBS
- Topp
- for
- ytelse
- utført
- perioden
- perifer
- fase
- fenotype
- pins
- rørledning
- pixel
- plasseres
- Planes
- plattform
- platina
- plato
- Platon Data Intelligence
- PlatonData
- i tillegg til
- pm
- Point
- poeng
- portefølje
- posisjon
- positiv
- Post
- potensiell
- makt
- innledende
- forberedelse
- forberedt
- tilstedeværelse
- presentert
- bevart
- press
- tidligere
- primære
- Før
- probe
- prosedyrer
- prosess
- behandlet
- Prosesser
- produserende
- Produkter
- riktig
- egenskaper
- eiendom
- Andelen
- beskytte
- Protein
- protokollen
- protokoller
- gi
- gi
- Trekker
- puls
- Python
- R
- område
- spenner
- ROTTE
- Sats
- ratio
- RE
- reaksjon
- reaksjoner
- klar
- mottak
- anbefalinger
- registrert
- innspilling
- utvinning
- redusere
- Redusert
- reduksjon
- referanse
- regenerering
- dietter
- region
- slektning
- relevant
- forbli
- fjerne
- fjernet
- fjerne
- gjentatt
- erstatte
- rapportert
- Rapportering
- representasjon
- representant
- forskning
- Motstand
- oppløsning
- respekt
- henholdsvis
- svar
- svar
- Resultater
- tilbakeføring
- anmeldelse
- Bånd
- Rich
- ikke sant
- Rise
- River
- rom
- Kjør
- s
- samme
- skanne
- skript
- Sekund
- sekundær
- Seksjon
- seksjoner
- sikre
- se
- valgt
- Serien
- Serum
- sett
- flere
- Form
- vist
- Viser
- side
- Signal
- signaler
- betydning
- signifikant
- Sølv
- samtidig
- enkelt
- nettstedet
- Nettsteder
- Størrelse
- Skin
- Skyv
- Lysbilder
- glidende
- liten
- Snap
- Software
- løsning
- Lyd
- kilde
- romlig
- Høyttaler
- høyttalere
- spesifisert
- specs
- Spektroskopi
- pigger
- Snurre rundt
- kvadrat
- Stabilitet
- stabilisere
- stable
- Rustfritt stål
- Standard
- standardisert
- Start
- Tilstand
- statistisk
- statistikk
- Damp
- stål
- stem
- Trinn
- Steps
- stimulus
- lagring
- lagret
- rett
- Strategi
- Strippe
- sterk
- strukturell
- strukturer
- studier
- Studer
- subkutan
- senere
- betydelig
- slik
- sum
- overflaten
- Kirurgi
- system
- T
- Ta
- tatt
- Target
- Oppgave
- teknikker
- Teknologi
- midlertidig
- test
- tester
- enn
- Det
- De
- Området
- Fremtiden
- Storbritannia
- deres
- deretter
- Der.
- termisk
- de
- denne
- De
- tre
- terskel
- Gjennom
- hele
- Dermed
- tid
- ganger
- typen
- tips
- vev
- Titanium
- til
- TONE
- topp
- Totalt
- berøre
- mot
- spor
- Togene
- trans
- overføre
- overføres
- Overføre
- overgang
- behandlet
- behandling
- behandlinger
- forsøk
- tutorial
- to
- typen
- Uk
- ultralyd
- etter
- forståelse
- gikk
- til
- bruke
- brukt
- ved hjelp av
- Vakuum
- gyldig
- verdi
- Verdier
- Versus
- av
- vivo
- Spenning
- volum
- av
- W
- gå
- walking
- var
- Vann
- we
- uke
- uker
- veiing
- vekt
- Velferd
- var
- når
- hvilken
- mens
- hvit
- hele
- vindu
- Metalltråd
- med
- uttak
- uten
- Arbeid
- arbeidet
- arbeid
- X
- røntgen
- zephyrnet