Behandling av kreft med stråling kan stimulere kroppens immunrespons og hemme tumorvekst, men det kan også redusere nivået av lymfocytter, de hvite blodcellene forbundet med immunrespons, noe som resulterer i svekket svulstkontroll og dårlig prognose. Alvorlighetsgraden av denne strålingsinduserte lymfopenien korrelerer med dosen som leveres til sirkulerende blodceller og lymfocytter. Som sådan kan minimering av dosen til hjertet, perifert blod og lymfoide organer bidra til å redusere denne skadelige effekten.
For å undersøke denne teorien videre, har Antje Galts og Abdelkhalek Hammi fra TU Dortmund University undersøkte om FLASH-strålebehandling – stråling levert med ultrahøye doser – kan redusere nivået av immuncelleutarming under protonterapi hos pasienter med hjernekreft.
"Den biologiske mekanismen bak den observerte FLASH-sparende effekten ved høye doserater er ennå ikke fullt ut forstått. En av de foreslåtte teoriene er imidlertid immunhypotesen, som antyder at den øyeblikkelige doseleveringen av FLASH-bestråling reduserer uttømmingen av sirkulerende lymfocytter betydelig ved å minimere eksponeringstiden, forklarer Hammi. "I vår studie viste vi at en hypofraksjonert behandling og rask doselevering sparte immunceller med opptil 27 ganger sammenlignet med en konvensjonell fraksjonert proton blyantstråle skanningsplan."
Galts og Hammi brukte en dosimetrisk blodstrømsmodell å simulere dosen til sirkulerende lymfocytter under konvensjonell og FLASH-basert intensitetsmodulert protonterapi (IMPT) av en hjernesvulst. Den dynamiske stråleleveringsmodellen simulerer en IMPT fraksjonert behandlingsplan mens den tar i betraktning den spatiotemporale variasjonen av dosehastigheten til hver enkelt protonblyantstråle. Hammi bemerker at modellen inneholder realistiske leveringsparametere fra kommersielt tilgjengelige syklotroner.
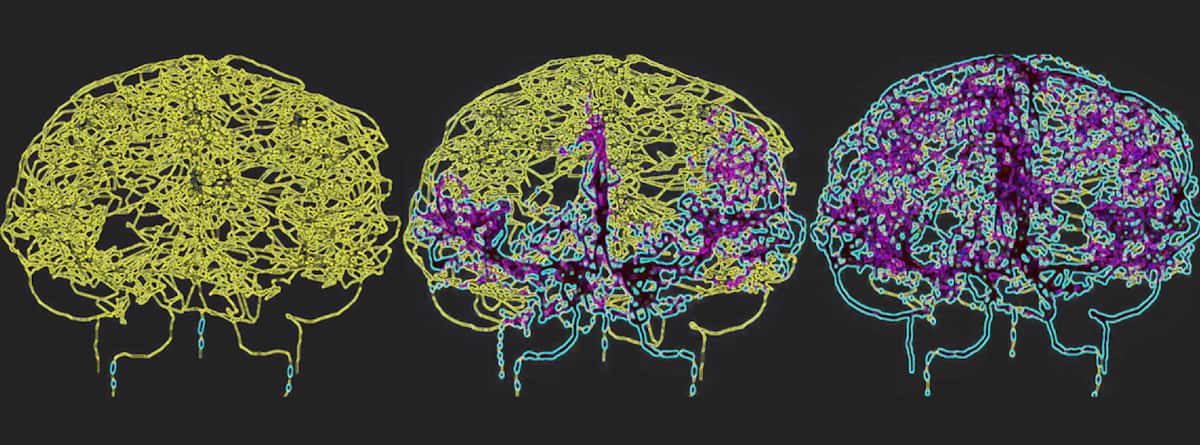
For nøyaktig å reflektere blodsirkulasjonen i den menneskelige hjernen, kartla Galts og Hammi blodårer direkte fra hjerne-MR-angiografibilder. De brukte den resulterende cerebrovaskulære modellen, som inkluderte 465 blodkar og 8841 individuelle kargrener, for å simulere sirkulasjonen av immunceller i blodstrømmen.
Forskerne laget realistiske IMPT-behandlingsplaner for en glioblastomsvulst, ved å bruke fire innfallende protonstråler og klinisk relevante leveringsparametere. De beregnet deretter de tidsvarierende strålefeltene som det sirkulerende blodet blir utsatt for under levering av protonterapiplanene og den akkumulerte dosen etter behandling, og rapporterte funnene deres i Fysikk i medisin og biologi.
Glioblastom er den mest dødelige formen for hjernekreft, og behandling med strålebehandling kan forårsake langvarig stråleindusert lymfopeni. "Ved å modellere et cerebrovaskulært system under strålingslevering håper vi å få dypere innsikt i hvordan strålebehandling påvirker immunresponsen hos disse pasientgruppene, noe som potensielt kan føre til forbedrede terapeutiske strategier," sier Hammi.
Plan sammenligninger
Galts og Hammi undersøkte fire behandlingsscenarier: IMPT FLASH med en enkelt 22.3 Gy fraksjon; hypofraksjonert FLASH ved bruk av to 14.6 Gy og fem 8 Gy fraksjoner; og konvensjonell IMPT ved bruk av trettito 2 Gy fraksjoner. For hver behandlingsplan vurderte de den dosimetriske påvirkningen på de sirkulerende lymfocyttene og estimerte den resulterende radiotoksisiteten.
Dose-volum histogrammer avslørte at FLASH-strålebehandling betydelig reduserte andelen bestrålte celler sammenlignet med konvensjonell doserate IMPT. Under den første behandlingsfraksjonen bestrålte alle tre FLASH-skjemaene rundt 1.52 % av det sirkulerende blodvolumet, mens konvensjonell IMPT bestrålte 2.18 %. Hypofraksjonerte FLASH-planer, levert over to eller fem fraksjoner, økte dette bestrålte volumet til henholdsvis 3.01 % og 7.35 %, mens konvensjonell IMPT eksponerte 42.41 % av perifert blod for stråling.
Deretter undersøkte forskerne nivået av sirkulerende lymfocytter som fikk en dose på minst 7 cGy – en terskel som forårsaker 2 % uttømming i lymfocyttpopulasjonen – under hele behandlingen. Etter å ha fullført konvensjonell IMPT, fikk 25.65 % av de sirkulerende lymfocyttene en dose på minst 7 cGy. For enkelt-, to- og femfraksjons FLASH-behandlinger var volumene som mottok mer enn denne doseterskelen henholdsvis 1.21 %, 2.30 % og 5.14 %.
Volumene av sirkulerende lymfocytter som mottok doser på mer enn 100 cGy, som forårsaker 30 % uttømming, var 0.77 %, 1.28 % og 2.09 % for henholdsvis enkelt-, to- og femfraksjoner FLASH og 0.10 % under konvensjonell IMPT.
Galts og Hammi studerte også responsen til CD4+ og CD8+ lymfocytter, som har forskjellige fordelinger i perifert blod, på de forskjellige bestrålingsscenariene. For begge lymfocytttypene var celledrap etter den første fraksjonen henholdsvis 0.66 %, 0.62 %, 0.32 % og 0.08 % for enkelt-, to- og femfraksjoner FLASH og konvensjonell IMPT.
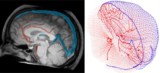
Beregningsmodell bestemmer dose til blod under strålebehandling
Etter full behandling var deplesjonen i lymfocytter 1.02 % og 1.56 % for henholdsvis to- og fem-behandlingsfraksjoner og 2.14 % for konvensjonell IMPT. Disse funnene viser at FLASH protonterapi skåner sirkulerende immunceller under intrakraniell behandling, med en enkeltfraksjon av FLASH som reduserer uttømmingsraten med nesten 70 % sammenlignet med konvensjonell IMPT.
Hammi forteller Fysikkens verden at de nå utvider modellen til å omfatte hode- og nakkekreft. "Vi utforsker dessuten ulike FLASH-leveringsmetoder og deres innvirkning på uttømming av immunsystemet, med et spesielt fokus på konform FLASH-behandling som er basert på passiv, pasientspesifikk energimodulering," forklarer han. "Denne leveringsmodellen har potensial til å spare flere sirkulerende lymfocytter sammenlignet med skyte-gjennom FLASH-levering."
- SEO-drevet innhold og PR-distribusjon. Bli forsterket i dag.
- PlatoData.Network Vertical Generative Ai. Styrk deg selv. Tilgang her.
- PlatoAiStream. Web3 Intelligence. Kunnskap forsterket. Tilgang her.
- PlatoESG. Karbon, CleanTech, Energi, Miljø, Solenergi, Avfallshåndtering. Tilgang her.
- PlatoHelse. Bioteknologisk og klinisk etterretning. Tilgang her.
- kilde: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- : har
- :er
- :ikke
- $OPP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- akkumulert
- nøyaktig
- Etter
- Alle
- nesten
- også
- an
- og
- ER
- rundt
- AS
- vurderes
- assosiert
- At
- tilgjengelig
- basert
- Beam
- bak
- blod
- blodårer
- både
- Brain
- hjernekreft
- grener
- men
- by
- beregnet
- CAN
- Kreft
- kreftpasienter
- kreft
- Årsak
- årsaker
- celle
- Celler
- sirkulerende
- Sirkulasjon
- klikk
- klinisk
- kommersielt
- sammenlignet
- fullført
- vurderer
- kontroll
- konvensjonell
- kunne
- opprettet
- dypere
- levert
- levering
- leveringsmetoder
- demonstrere
- bestemmes
- skadelig
- forskjellig
- direkte
- distribusjon
- Distribusjoner
- dose
- doser
- under
- dynamisk
- hver enkelt
- effekt
- energi
- Hele
- lik
- Equilibrium
- anslått
- Eter (ETH)
- ekspanderende
- forklarer
- utforsket
- Utforske
- utsatt
- Eksponering
- FAST
- Felt
- funn
- Først
- fem
- Blitz
- flyten
- Fokus
- etter
- Til
- skjema
- fire
- brøkdel
- fra
- fullt
- fullt
- videre
- Gevinst
- Gruppens
- Vekst
- Ha
- he
- Hjerte
- hjelpe
- Høy
- håp
- Hvordan
- Men
- HTTPS
- menneskelig
- bilde
- bilder
- immun
- Immunsystem
- Påvirkning
- forbedret
- AVGIFT
- in
- hendelse
- inkludere
- inkludert
- inkorporerer
- økt
- individuelt
- informasjon
- innsikt
- inn
- undersøke
- utstedelse
- IT
- jpg
- drepe
- ledende
- minst
- venstre
- Nivå
- lenger
- max bredde
- mekanisme
- medisin
- metoder
- minimere
- modell
- modellering
- modellering
- mer
- mest
- mr
- Merknader
- nå
- observerte
- of
- on
- ONE
- åpen
- or
- vår
- ut
- enn
- parametere
- Spesielt
- passiv
- pasienter
- perifer
- Fysikk
- Fysikkens verden
- fly
- planer
- plato
- Platon Data Intelligence
- PlatonData
- dårlig
- befolkningen
- potensiell
- potensielt
- forplantning
- Andelen
- foreslått
- Stråling
- strålebehandling
- Sats
- priser
- realistisk
- mottatt
- mottak
- redusere
- Redusert
- reduserer
- redusere
- reflektere
- relevant
- Rapportering
- forskere
- henholdsvis
- svar
- resulterende
- Avslørt
- ikke sant
- s
- sier
- skanning
- scenarier
- ordninger
- alvorlighetsgrad
- viste
- betydelig
- enkelt
- Begynn
- stimulere
- strategier
- stream
- studert
- Studer
- slik
- foreslår
- system
- forteller
- enn
- Det
- De
- deres
- deretter
- teori
- Terapeutisk
- terapi
- Disse
- de
- denne
- tre
- terskel
- Gjennom
- thumbnail
- tid
- ganger
- til
- behandling
- behandling
- behandlinger
- sant
- svulst
- to
- typer
- forstås
- universitet
- brukt
- ved hjelp av
- ulike
- Vessel
- fartøy
- volum
- volumer
- var
- we
- var
- når
- om
- hvilken
- mens
- hvit
- med
- innenfor
- verden
- gul
- ennå
- zephyrnet