Het behandelen van kanker met bestraling kan de immuunrespons van het lichaam stimuleren en de tumorgroei remmen, maar het kan ook het aantal lymfocyten, de witte bloedcellen die geassocieerd zijn met de immuunrespons, verlagen, wat resulteert in een verminderde tumorcontrole en een slechte prognose. De ernst van deze door straling geïnduceerde lymfopenie correleert met de dosis die wordt afgegeven aan circulerende bloedcellen en lymfocyten. Als zodanig zou het minimaliseren van de dosis voor het hart, het perifere bloed en de lymfoïde organen dit schadelijke effect kunnen helpen verminderen.
Om deze theorie verder te onderzoeken, hebben Antje Galts en Abdelkhalek Hammi van de TU Dortmund Universiteit onderzocht of FLASH-radiotherapie – straling afgegeven met ultrahoge dosissnelheden – het niveau van de uitputting van immuuncellen tijdens protonentherapie bij hersenkankerpatiënten zou kunnen verminderen.
“Het biologische mechanisme achter het waargenomen FLASH-sparende effect bij hoge doseringen is nog niet volledig begrepen. Eén van de voorgestelde theorieën is echter de immuunhypothese, die suggereert dat de onmiddellijke dosisafgifte van FLASH-bestraling de uitputting van circulerende lymfocyten aanzienlijk vermindert door de blootstellingstijd te minimaliseren”, legt Hammi uit. “In onze studie hebben we aangetoond dat een behandeling met hypofractionering en een snelle dosisafgifte de immuuncellen tot 27 keer spaarde vergeleken met een conventioneel behandelplan met gefractioneerde protonen met een potloodstraalscan.”
Galts en Hammi gebruikten a dosimetrisch bloedstroommodel om de dosis aan circulerende lymfocyten te simuleren tijdens conventionele en FLASH-gebaseerde intensiteitsgemoduleerde protontherapie (IMPT) van een hersentumor. Het dynamische bundelafgiftemodel simuleert een IMPT-gefractioneerd behandelplan, waarbij rekening wordt gehouden met de spatiotemporele variatie van het dosistempo van elke afzonderlijke protonenpotloodbundel. Hammi merkt op dat het model realistische leveringsparameters van in de handel verkrijgbare cyclotrons bevat.
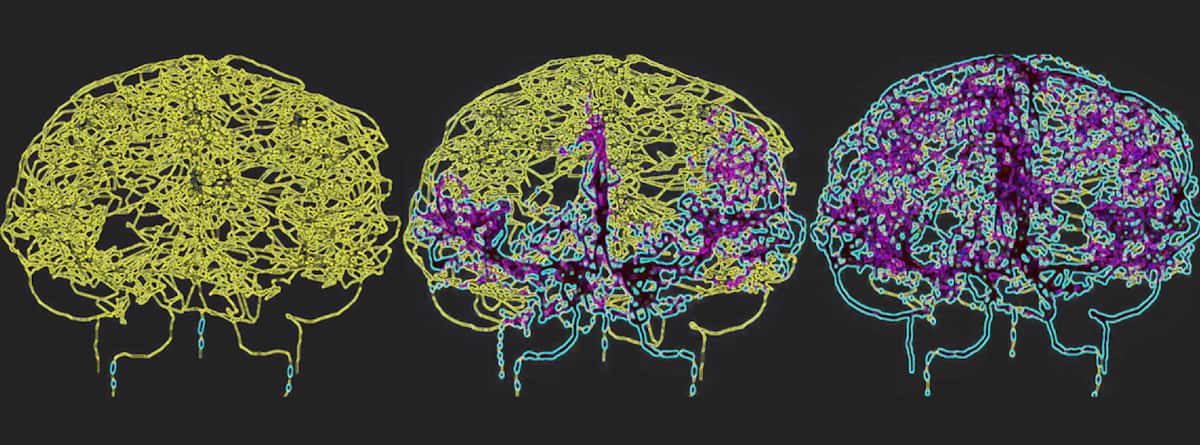
Om de bloedcirculatie in het menselijk brein nauwkeurig weer te geven, hebben Galts en Hammi de bloedvaten rechtstreeks in kaart gebracht op basis van MR-angiografiebeelden in de hersenen. Ze gebruikten het resulterende cerebrovasculaire model, dat 465 bloedvaten en 8841 individuele vaatvertakkingen omvatte, om de circulatie van immuuncellen in de bloedstroom te simuleren.
De onderzoekers creëerden realistische IMPT-behandelplannen voor een glioblastoomtumor, met behulp van vier invallende protonenbundels en klinisch relevante afleveringsparameters. Vervolgens berekenden ze de tijdsvariërende stralingsvelden waaraan het circulerende bloed wordt blootgesteld tijdens de levering van de protontherapieplannen en de geaccumuleerde dosis na de behandeling, en rapporteerden hun bevindingen in Physics in Medicine & Biology.
Glioblastoom is de meest dodelijke vorm van hersenkanker en de behandeling ervan met radiotherapie kan langdurige door straling geïnduceerde lymfopenie veroorzaken. “Door het modelleren van een cerebrovasculair systeem tijdens de bestraling hopen we dieper inzicht te krijgen in de manier waarop radiotherapie de immuunrespons bij deze groepen patiënten beïnvloedt, wat mogelijk kan leiden tot verbeterde therapeutische strategieën”, zegt Hammi.
Plan vergelijkingen
Galts en Hammi onderzochten vier behandelingsscenario's: IMPT FLASH met een enkele fractie van 22.3 Gy; gehypofractioneerde FLASH met behulp van twee fracties van 14.6 Gy en vijf fracties van 8 Gy; en conventionele IMPT met behulp van tweeëndertig fracties van 2 Gy. Voor elk behandelplan beoordeelden ze de dosimetrische impact op de circulerende lymfocyten en schatten ze de resulterende radiotoxiciteit in.
Dosis-volumehistogrammen onthulden dat FLASH-radiotherapie het aandeel bestraalde cellen aanzienlijk verminderde in vergelijking met conventionele IMPT-doses. Tijdens de eerste behandelingsfractie bestraalden alle drie de FLASH-schema's ongeveer 1.52% van het circulerende bloedvolume, terwijl conventionele IMPT 2.18% bestraalde. Hypogefractioneerde FLASH-plannen, afgeleverd over twee of vijf fracties, verhoogden dit bestraalde volume tot respectievelijk 3.01% en 7.35%, terwijl conventionele IMPT 42.41% van het perifere bloed aan straling blootstelde.
Vervolgens onderzochten de onderzoekers het aantal circulerende lymfocyten die tijdens de gehele behandeling een dosis van minimaal 7 cGy kregen – een drempel die een uitputting van de lymfocytenpopulatie met 2% veroorzaakt. Na voltooiing van conventionele IMPT ontving 25.65% van de circulerende lymfocyten een dosis van ten minste 7 cGy. Voor FLASH-behandelingen met één, twee en vijf fracties waren de volumes die meer dan deze dosisdrempel ontvingen respectievelijk 1.21%, 2.30% en 5.14%.
De volumes van circulerende lymfocyten die doses van meer dan 100 cGy ontvingen, wat een uitputting van 30% veroorzaakt, waren respectievelijk 0.77%, 1.28% en 2.09% voor FLASH met enkele, twee en vijf fracties, en 0.10% tijdens conventionele IMPT.
Galts en Hammi bestudeerden ook de reactie van CD4+- en CD8+-lymfocyten, die verschillende distributies hebben in het perifere bloed, op de verschillende bestralingsscenario's. Voor beide typen lymfocyten bedroeg de celdoding na de eerste fractie 0.66%, 0.62%, 0.32% en 0.08% voor respectievelijk FLASH met één, twee en vijf fracties en conventionele IMPT.
Een computermodel bepaalt de dosis in het bloed tijdens radiotherapie
Na de volledige behandeling bedroeg de depletie in lymfocyten respectievelijk 1.02% en 1.56% voor de fracties van twee en vijf behandelingen, en 2.14% voor conventionele IMPT. Deze bevindingen tonen aan dat FLASH-protonentherapie circulerende immuuncellen spaart tijdens intracraniale behandeling, waarbij FLASH met een enkele fractie de depletiesnelheid met bijna 70% vermindert in vergelijking met conventionele IMPT.
Hammi vertelt Natuurkunde wereld dat ze het model nu uitbreiden met hoofd-halskanker. "Verder onderzoeken we verschillende FLASH-toedieningsmethoden en hun impact op de uitputting van het immuunsysteem, met een bijzondere focus op conforme FLASH-behandeling die gebaseerd is op passieve, patiëntspecifieke energiemodulatie", legt hij uit. “Dit toedieningsmodel heeft het potentieel om meer circulerende lymfocyten te sparen in vergelijking met shoot-through FLASH-toediening.”
- Door SEO aangedreven content en PR-distributie. Word vandaag nog versterkt.
- PlatoData.Network Verticale generatieve AI. Versterk jezelf. Toegang hier.
- PlatoAiStream. Web3-intelligentie. Kennis versterkt. Toegang hier.
- PlatoESG. carbon, CleanTech, Energie, Milieu, Zonne, Afvalbeheer. Toegang hier.
- Plato Gezondheid. Intelligentie op het gebied van biotech en klinische proeven. Toegang hier.
- Bron: https://physicsworld.com/a/flash-irradiation-spares-immune-cells-during-proton-therapy/
- : heeft
- :is
- :niet
- $UP
- 1
- 10
- 100
- 14
- 160
- 2%
- 22
- 25
- 27
- 35%
- 7
- 73
- 8
- a
- Geaccumuleerd
- nauwkeurig
- Na
- Alles
- bijna
- ook
- an
- en
- ZIJN
- rond
- AS
- geëvalueerd
- geassocieerd
- At
- Beschikbaar
- gebaseerde
- Balk
- achter
- bloed
- aderen
- zowel
- Hersenen
- hersenkanker
- takken
- maar
- by
- berekend
- CAN
- Kanker
- kankerpatiënten
- kankers
- Veroorzaken
- oorzaken
- cel
- Cellen
- circulerende
- Circulatie
- Klik
- klinisch
- commercieel
- vergeleken
- het invullen van
- aangezien
- onder controle te houden
- conventioneel
- kon
- aangemaakt
- diepere
- geleverd
- levering
- leveringsmethoden
- tonen
- bepaalt
- nadelig
- anders
- direct
- distributie
- Uitkeringen
- dosis
- doses
- gedurende
- dynamisch
- elk
- effect
- energie-niveau
- Geheel
- gelijk
- Evenwicht
- geschat
- Ether (ETH)
- uit te breiden
- Verklaart
- Nagegaan
- Verkennen
- blootgestelde
- Media
- SNELLE
- Velden
- bevindingen
- Voornaam*
- vijf
- flash
- stroom
- Focus
- volgend
- Voor
- formulier
- vier
- fractie
- oppompen van
- vol
- geheel
- verder
- Krijgen
- Groep
- Hebben
- he
- Hart
- hulp
- Hoge
- hoop
- Hoe
- Echter
- HTTPS
- menselijk
- beeld
- afbeeldingen
- 면역
- Immuunsysteem
- Impact
- verbeterd
- BELASTING
- in
- incident
- omvatten
- inclusief
- omvat
- meer
- individueel
- informatie
- inzichten
- in
- onderzoeken
- kwestie
- IT
- jpg
- doden
- leidend
- minst
- links
- Niveau
- langer
- max-width
- mechanisme
- geneeskunde
- methoden
- minimaliseren
- model
- modellering
- modellering
- meer
- meest
- mr
- Opmerkingen
- nu
- opgemerkt
- of
- on
- EEN
- open
- or
- onze
- uit
- over
- parameters
- bijzonder
- passief
- patiënten
- perifeer
- Fysica
- Natuurkunde wereld
- plan
- plannen
- Plato
- Plato gegevensintelligentie
- PlatoData
- arm
- bevolking
- potentieel
- mogelijk
- voortplanting
- proportie
- voorgestelde
- Bestraling
- radiotherapie
- tarief
- Tarieven
- realistisch
- ontvangen
- ontvangende
- verminderen
- Gereduceerd
- vermindert
- vermindering
- reflecteren
- relevante
- Rapportage
- onderzoekers
- respectievelijk
- antwoord
- verkregen
- Revealed
- rechts
- s
- zegt
- het scannen
- scenario's
- regelingen
- strengheid
- vertoonde
- aanzienlijk
- single
- begin
- stimuleren
- strategieën
- stream
- bestudeerd
- Studie
- dergelijk
- Stelt voor
- system
- vertelt
- neem contact
- dat
- De
- hun
- harte
- theorie
- Therapeutische
- therapie
- Deze
- ze
- dit
- drie
- drempel
- Door
- thumbnail
- niet de tijd of
- keer
- naar
- behandelen
- behandeling
- behandelingen
- waar
- tumor
- twee
- types
- begrijpelijk
- universiteit-
- gebruikt
- gebruik
- divers
- Vat
- schepen
- volume
- volumes
- was
- we
- waren
- wanneer
- of
- welke
- en
- wit
- Met
- binnen
- wereld
- geel
- nog
- zephyrnet