05 年 2023 月 XNUMX 日 (Nanowerkニュース) 金沢大学の研究者による報告 STARプロトコル (「ナノニードルプローブを備えた原子間力顕微鏡を使用した細胞内ナノスケール構造のライブイメージングのためのプロトコル」) 生細胞内のナノスケール構造の画像をキャプチャするためのナノ内視鏡検査-AFM の手順の詳細とヒント。 生きた細胞内のナノスケール構造の画像は、細胞の構造と機能を明らかにするための洞察を求める需要が高まっています。 これまでのところ、そのような画像をキャプチャするためのツールはさまざまな方法で制限されていましたが、金沢大学の福間武史氏と市川武彦氏率いる研究者らは、この画像を使用するための完全なプロトコルを考案し、報告しました。 原子間力顕微鏡 (AFM) 生きた細胞の内部を画像化します。
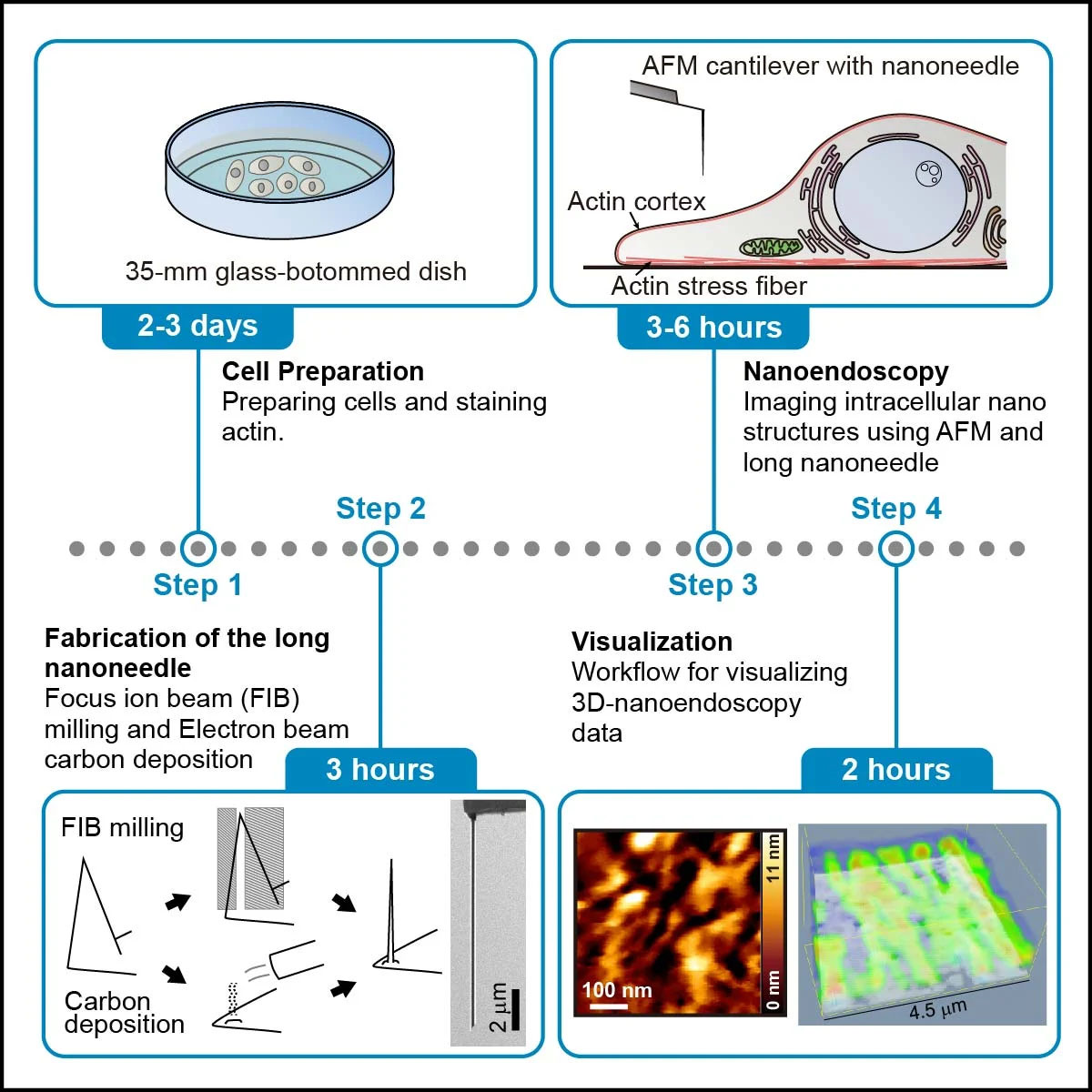 ナノ内視鏡 AFM を使用して生細胞内のアクチン繊維を観察する方法の概要。 (画像:Ikawa, et al.、STAR Protocols) AFM は 1980 年代に初めて開発され、サンプル表面とカンチレバーに取り付けられたナノスケールチップの間の力の変化を利用して表面を「感じ」、トポグラフィーの画像を生成します。ナノスケールの解像度。 この技術は、サンプルに関する情報を抽出するためにますます洗練されており、ツールがナノスケールでダイナミクスの動画をキャプチャするのに十分な速度になっています。 ただし、これまでのところ、それは表面に限定されています。 セル内部のビューを提供できる他の技術も存在しますが、制限があります。 たとえば、ナノスケール以下の詳細を分解できる電子顕微鏡がありますが、必要な動作条件は生細胞と互換性がありません。 あるいは、生細胞に対して蛍光顕微鏡法が定期的に使用されていますが、解像度を上げるための蛍光技術は存在しますが、ナノスケールでの蛍光イメージングを阻害する実際的な課題があります。 AFMにはどちらの制限もなく、細胞を貫通するためのナノニードルでツールを装飾することにより、福間氏、市川氏とその共同研究者らは最近、細胞内部をナノスケールで画像化できる能力を実証しており、これをナノ内視鏡AFMと呼んでいる。 研究者らはプロトコルの中で、ナノ内視鏡 AFM の方法を 4 つの段階に分けています。 最初の数ステップでは、細胞の準備と蛍光色素による染色、およびイメージング領域を迅速に特定するために使用される蛍光の確認を行います。 次はナノニードル自体の製造です。これには 2 つのオプションがあります。集束イオン ビームでナノニードル構造をエッチングするか、電子ビーム蒸着でナノニードル構造を構築するかのいずれかです。 次に、ナノ内視鏡検査の段階自体が始まり、研究者らは報告書の中で、3D と XNUMXD の両方のナノ内視鏡検査のアプローチについて説明しています。 ナノ内視鏡画像を取得した後、測定データを視覚化するために必要なデータ処理の概要を最終的に説明する前に、クリーンアップする最適な方法についても詳細が説明されています。 このメソッドには、各段階を正常に完了するためのヒントと、うまくいかない場合のトラブルシューティングのガイドが豊富に含まれています。 この技術は、ミトコンドリア、接着斑、小胞体、リソソーム、ゴルジ装置、オルガネラ結合、液液相分離構造など、無傷の細胞内構造の観察に適しているはずです。 彼らは、「このプロトコルは、ナノスケール構造を研究するための標準ツールになることが期待できる」と結論付けています。
ナノ内視鏡 AFM を使用して生細胞内のアクチン繊維を観察する方法の概要。 (画像:Ikawa, et al.、STAR Protocols) AFM は 1980 年代に初めて開発され、サンプル表面とカンチレバーに取り付けられたナノスケールチップの間の力の変化を利用して表面を「感じ」、トポグラフィーの画像を生成します。ナノスケールの解像度。 この技術は、サンプルに関する情報を抽出するためにますます洗練されており、ツールがナノスケールでダイナミクスの動画をキャプチャするのに十分な速度になっています。 ただし、これまでのところ、それは表面に限定されています。 セル内部のビューを提供できる他の技術も存在しますが、制限があります。 たとえば、ナノスケール以下の詳細を分解できる電子顕微鏡がありますが、必要な動作条件は生細胞と互換性がありません。 あるいは、生細胞に対して蛍光顕微鏡法が定期的に使用されていますが、解像度を上げるための蛍光技術は存在しますが、ナノスケールでの蛍光イメージングを阻害する実際的な課題があります。 AFMにはどちらの制限もなく、細胞を貫通するためのナノニードルでツールを装飾することにより、福間氏、市川氏とその共同研究者らは最近、細胞内部をナノスケールで画像化できる能力を実証しており、これをナノ内視鏡AFMと呼んでいる。 研究者らはプロトコルの中で、ナノ内視鏡 AFM の方法を 4 つの段階に分けています。 最初の数ステップでは、細胞の準備と蛍光色素による染色、およびイメージング領域を迅速に特定するために使用される蛍光の確認を行います。 次はナノニードル自体の製造です。これには 2 つのオプションがあります。集束イオン ビームでナノニードル構造をエッチングするか、電子ビーム蒸着でナノニードル構造を構築するかのいずれかです。 次に、ナノ内視鏡検査の段階自体が始まり、研究者らは報告書の中で、3D と XNUMXD の両方のナノ内視鏡検査のアプローチについて説明しています。 ナノ内視鏡画像を取得した後、測定データを視覚化するために必要なデータ処理の概要を最終的に説明する前に、クリーンアップする最適な方法についても詳細が説明されています。 このメソッドには、各段階を正常に完了するためのヒントと、うまくいかない場合のトラブルシューティングのガイドが豊富に含まれています。 この技術は、ミトコンドリア、接着斑、小胞体、リソソーム、ゴルジ装置、オルガネラ結合、液液相分離構造など、無傷の細胞内構造の観察に適しているはずです。 彼らは、「このプロトコルは、ナノスケール構造を研究するための標準ツールになることが期待できる」と結論付けています。
 ナノ内視鏡 AFM を使用して生細胞内のアクチン繊維を観察する方法の概要。 (画像:Ikawa, et al.、STAR Protocols) AFM は 1980 年代に初めて開発され、サンプル表面とカンチレバーに取り付けられたナノスケールチップの間の力の変化を利用して表面を「感じ」、トポグラフィーの画像を生成します。ナノスケールの解像度。 この技術は、サンプルに関する情報を抽出するためにますます洗練されており、ツールがナノスケールでダイナミクスの動画をキャプチャするのに十分な速度になっています。 ただし、これまでのところ、それは表面に限定されています。 セル内部のビューを提供できる他の技術も存在しますが、制限があります。 たとえば、ナノスケール以下の詳細を分解できる電子顕微鏡がありますが、必要な動作条件は生細胞と互換性がありません。 あるいは、生細胞に対して蛍光顕微鏡法が定期的に使用されていますが、解像度を上げるための蛍光技術は存在しますが、ナノスケールでの蛍光イメージングを阻害する実際的な課題があります。 AFMにはどちらの制限もなく、細胞を貫通するためのナノニードルでツールを装飾することにより、福間氏、市川氏とその共同研究者らは最近、細胞内部をナノスケールで画像化できる能力を実証しており、これをナノ内視鏡AFMと呼んでいる。 研究者らはプロトコルの中で、ナノ内視鏡 AFM の方法を 4 つの段階に分けています。 最初の数ステップでは、細胞の準備と蛍光色素による染色、およびイメージング領域を迅速に特定するために使用される蛍光の確認を行います。 次はナノニードル自体の製造です。これには 2 つのオプションがあります。集束イオン ビームでナノニードル構造をエッチングするか、電子ビーム蒸着でナノニードル構造を構築するかのいずれかです。 次に、ナノ内視鏡検査の段階自体が始まり、研究者らは報告書の中で、3D と XNUMXD の両方のナノ内視鏡検査のアプローチについて説明しています。 ナノ内視鏡画像を取得した後、測定データを視覚化するために必要なデータ処理の概要を最終的に説明する前に、クリーンアップする最適な方法についても詳細が説明されています。 このメソッドには、各段階を正常に完了するためのヒントと、うまくいかない場合のトラブルシューティングのガイドが豊富に含まれています。 この技術は、ミトコンドリア、接着斑、小胞体、リソソーム、ゴルジ装置、オルガネラ結合、液液相分離構造など、無傷の細胞内構造の観察に適しているはずです。 彼らは、「このプロトコルは、ナノスケール構造を研究するための標準ツールになることが期待できる」と結論付けています。
ナノ内視鏡 AFM を使用して生細胞内のアクチン繊維を観察する方法の概要。 (画像:Ikawa, et al.、STAR Protocols) AFM は 1980 年代に初めて開発され、サンプル表面とカンチレバーに取り付けられたナノスケールチップの間の力の変化を利用して表面を「感じ」、トポグラフィーの画像を生成します。ナノスケールの解像度。 この技術は、サンプルに関する情報を抽出するためにますます洗練されており、ツールがナノスケールでダイナミクスの動画をキャプチャするのに十分な速度になっています。 ただし、これまでのところ、それは表面に限定されています。 セル内部のビューを提供できる他の技術も存在しますが、制限があります。 たとえば、ナノスケール以下の詳細を分解できる電子顕微鏡がありますが、必要な動作条件は生細胞と互換性がありません。 あるいは、生細胞に対して蛍光顕微鏡法が定期的に使用されていますが、解像度を上げるための蛍光技術は存在しますが、ナノスケールでの蛍光イメージングを阻害する実際的な課題があります。 AFMにはどちらの制限もなく、細胞を貫通するためのナノニードルでツールを装飾することにより、福間氏、市川氏とその共同研究者らは最近、細胞内部をナノスケールで画像化できる能力を実証しており、これをナノ内視鏡AFMと呼んでいる。 研究者らはプロトコルの中で、ナノ内視鏡 AFM の方法を 4 つの段階に分けています。 最初の数ステップでは、細胞の準備と蛍光色素による染色、およびイメージング領域を迅速に特定するために使用される蛍光の確認を行います。 次はナノニードル自体の製造です。これには 2 つのオプションがあります。集束イオン ビームでナノニードル構造をエッチングするか、電子ビーム蒸着でナノニードル構造を構築するかのいずれかです。 次に、ナノ内視鏡検査の段階自体が始まり、研究者らは報告書の中で、3D と XNUMXD の両方のナノ内視鏡検査のアプローチについて説明しています。 ナノ内視鏡画像を取得した後、測定データを視覚化するために必要なデータ処理の概要を最終的に説明する前に、クリーンアップする最適な方法についても詳細が説明されています。 このメソッドには、各段階を正常に完了するためのヒントと、うまくいかない場合のトラブルシューティングのガイドが豊富に含まれています。 この技術は、ミトコンドリア、接着斑、小胞体、リソソーム、ゴルジ装置、オルガネラ結合、液液相分離構造など、無傷の細胞内構造の観察に適しているはずです。 彼らは、「このプロトコルは、ナノスケール構造を研究するための標準ツールになることが期待できる」と結論付けています。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 自動車/EV、 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- チャートプライム。 ChartPrime でトレーディング ゲームをレベルアップしましょう。 こちらからアクセスしてください。
- ブロックオフセット。 環境オフセット所有権の近代化。 こちらからアクセスしてください。
- 情報源: https://www.nanowerk.com/nanotechnology-news2/newsid=63582.php
- :持っている
- :は
- :not
- $UP
- 10
- 13
- 2023
- 2D
- 3d
- 7
- a
- 私たちについて
- 成し遂げる
- 後
- AL
- および
- アプローチ
- です
- AREA
- AS
- At
- 離れて
- BE
- ビーム
- になる
- き
- BEST
- の間に
- 両言語で
- ブレーク
- 建物
- 焙煎が極度に未発達や過発達のコーヒーにて、クロロゲン酸の味わいへの影響は強くなり、金属を思わせる味わいと乾いたマウスフィールを感じさせます。
- by
- 缶
- 機能
- できる
- キャプチャー
- 捕捉した
- キャプチャ
- セル
- 細胞
- 細胞の
- センター
- 課題
- 変更
- 点検
- comes
- 互換性のあります
- 結論
- 条件
- Connections
- データ
- データ処理
- 日付
- 定義します
- 需要
- 実証
- 説明する
- 細部
- 発展した
- ダウン
- ダイナミクス
- E&T
- 各
- どちら
- さらに
- 存在する
- 予想される
- 遠く
- 少数の
- 繊維
- 最後に
- 名
- 焦点
- 焦点を当て
- 強
- 軍隊
- から
- フル
- function
- 成長した
- ガイド
- 持ってる
- 高解像度の
- しかしながら
- HTTPS
- 識別する
- 画像
- 画像
- イメージング
- in
- 含めて
- 増える
- の増加
- ますます
- 情報
- 内部
- 洞察
- に
- 巻き込む
- IT
- 自体
- JPG
- ツェッペリン
- 制限
- 制限
- 限定的
- ライブ
- 生活
- 測定された
- 方法
- 顕微鏡検査
- 真ん中
- ミトコンドリア
- 移動する
- 必要とされる
- どちらでもありません
- 次の
- 今
- of
- on
- ONE
- オペレーティング
- オプション
- or
- その他
- でる
- 概説
- 概要
- PHP
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 実用的
- 準備
- 処理
- 作り出す
- プロトコル
- 提供します
- すぐに
- 最近
- 定期的に
- レポート
- 報告
- の提出が必要です
- 研究者
- 解像度
- 解決中
- 明らかにする
- すべき
- より小さい
- So
- これまでのところ
- 洗練された
- 速度
- ステージ
- ステージ
- 標準
- 星
- ステップ
- 構造
- 構造
- 勉強
- 首尾よく
- そのような
- 苦しみ
- 十分な
- 適当
- 表面
- テクニック
- それ
- アプリ環境に合わせて
- 自分自身
- その後
- そこ。
- 彼ら
- 物事
- この
- 先端
- ヒント
- 〜へ
- ツール
- 豊富なツール群
- 2
- 大学
- 中古
- 使用されます
- さまざまな
- 詳しく見る
- 視覚化する
- ました
- 仕方..
- 方法
- WELL
- いつ
- which
- while
- ワーキング
- 働く
- ゼファーネット