特に明記しない限り、すべての試薬は受け取ったままの状態で使用されました。カウンティングビーズ (CountBright Absolute Counting Beads、Invitrogen) を除き、すべての化学物質は Sigma Aldrich から購入しました。 ζ-電位は、Zetasizer NanoZS90 (Malvern Instruments) を使用して測定されました。粒子のサイズと形態は、元素分析を提供する統合 EDS を備えた JEOL JSM 7800F Prime 顕微鏡の SEM によって研究されました。粒子サイズは、50 個の独立した粒子を測定することによって決定されました。ラジオインスタント薄層クロマトグラフィー (ITLC) は、ケイ酸を含浸させた Agilent Technologies のガラス マイクロファイバー クロマトグラフィー紙で開発され、Laura ソフトウェアを使用する Lablogic Flow-count TLC スキャナーと BioScan B-FC-3200 光電子増倍管 (PMT) 検出器を使用して分析されました。特に明記しない限り、ITLC 移動相は 0.175 M クエン酸と 0.325 M クエン酸三ナトリウムの水溶液で構成されています。放射性サンプルは、Capintec CRC-25R (Capintec) または LKB Wallac 1282 Compugamma CS (PerkinElmer) を使用して測定し、データは EdenTerm ソフトウェアを使用して収集されました。フローサイトメトリー実験は、BD FACSChorus ソフトウェアを使用して BD FACSMelody セルソーターで実行されました。 PET/CT 画像は NanoPET/CT スキャナー (Mediso) を使用して取得し、Nucline v.0.21 ソフトウェアを使用して再構成し、VivoQuant ソフトウェア (バージョン 3.5、InviCRO) を使用して画像を分析しました。リストモード データは、Mediso によって開発された特定の MATLAB ソフトウェア ツールによって取得されました。オートラジオグラフィーは、GE Amersham タイフーン装置で実施されました。
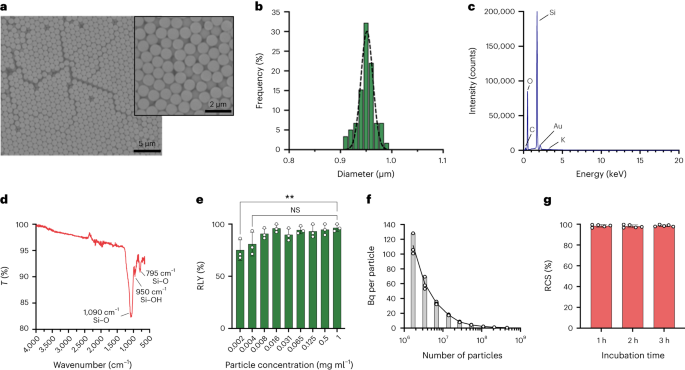
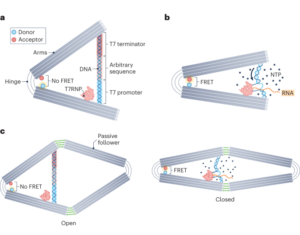
サブミクロンサイズのシリカ粒子の合成
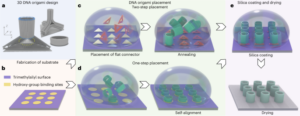
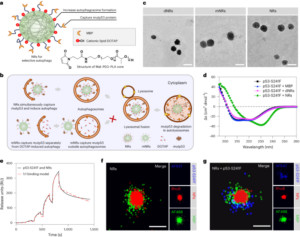
粒子はStöber法を使用して合成されました。この方法は、シリコン アルコキシドの加水分解と連続縮合に基づいて、単分散の球状シリカ粒子を生成します。27。オルトケイ酸テトラエチル (TEOS) をシリコン源として、アンモニアを塩基触媒として、塩化カリウムを電解質として使用しました。 TEOSのエタノール溶液を、触媒および電解質を含む溶液に連続的に添加した。試薬の開始量または添加速度を変更すると、以前に報告されているように粒子サイズに違いが生じます。28。ここでは、粒子の合成前に 1 つの溶液を調製しました: 19.0 ml の EtOH に 33.3 mmol の TEOS を含む溶液 2 と、0.23 ml のアンモニア、9 mlの EtOH、および 65 mlの H に 6.75 mmol の KCl を含む溶液 XNUMX2O. 合成のために、溶液 2 を 250 ml 丸底フラスコに入れ、50 rpm で 300 分間撹拌しながら 15 °C に加熱しました。次に、溶液 1 を溶液 2 に滴下しました (供給速度 0.2 ml min)-1)。溶液 1 を添加した後、得られた粒子を 18,300 で遠心分離して精製しました。g 3 分間洗浄し、EtOHでXNUMX回洗浄しました。最後に、SiO2 微粒子を真空下で乾燥させた。
サブマイクロメートルサイズの粒子とシラン-PEG のグラフト化5k
20 mg ml-1 シラン-PEG 溶液5k (Sigma Aldrich) EtOH 98% 溶液を smSiP 溶液に 5 mg ml で加えました-1 EtOH中98%およびアンモニア2.8%。混合物を室温で一晩撹拌し、粒子を18,300での遠心分離によって回収した。g 3分間最後に、粒子を蒸留水で3回洗浄し、真空下で一晩乾燥させた。洗浄溶液を一晩凍結乾燥し、結合していないシラン – PEG の量を測定しました。5k 反応収率計算のために重み付けされます。 A 0.05 mg ml-1 smSiP-PEGの溶液5k 蒸留水中の反応をさらなる放射性標識反応に使用した。
[68Ga]GaCl3
ガリウム 68 は [68Ga]GaCl3 エッケルトとツィグラーより 68Ge /68超高純度 HCl (4 ml、0.1 M) 中の Ga 発生器は、適正製造基準要件 (ABX) に従って製造されています。
[の濃度68Ga]GaCl3 陽イオン交換による溶出
溶出液の濃縮は、補足図に記載のセットアップを使用して実行されました。 1。まず、4 mlの[68Ga]GaCl3 溶出液をStrata-X-C 33uカートリッジ(Phenomenex)にロードし、溶出液を廃棄した。次に、カートリッジを 5 ml のアセトン/0.1 M HCl (80:20) 溶液で洗浄し、溶出液を廃棄しました。最後に、濃縮された [68Ga]GaCl3 700 µl のアセトン/0.05 M HCl (98:2) 溶液を加えて収集し、N 下で乾燥させました。2 ストリームに流し、50 µl の 0.5 M HEPES バッファー (pH 4.9) に再懸濁します。 Radio-TLC は品質管理のためにさまざまな段階で実行されました。このプロトコルには約 20 分かかり、回収率は 86.2 ± 8.5% になります。
さまざまな濃度でのシリカ粒子の放射性標識 68Ga
シリカ粒子をさまざまな濃度(1 ~ 0.002 mg ml)で再懸濁しました。-1) 0.5 M HEPES 緩衝液 (pH 4.9)。次に、この溶液 50 μl を反応チューブに加えた後、濃縮した [68Ga]GaCl3 50 µl の 0.5 M HEPES 緩衝液 (pH 4.9) で溶出。反応は90 °Cで30 分間行われ、放射化学収率を計算するためにラジオTLCが実行されました。
フローサイトメトリーによる粒子濃度の測定
粒子濃度は、メーカーの指示に従い、計数ビーズ (CountBright Absolute Counting Beads、Invitrogen) を使用したフローサイトメトリーによって計算されました。シリカ粒子は 0.05 mg ml で再懸濁されました-1、10 分間超音波処理し、カットオフサイズ10 μmのフィルター(KXシリンジフィルター、ナイロン、25 mm、10 μm)を通過させました。 CountBright Absolute Counting Beads を室温まで温め、30 秒間ボルテックスしました。次に、50 μlのビーズを300 μlのシリカ粒子に加え、混合物を30 分間ボルテックスして均一な溶液を得ました。サンプルをフローサイトメーターで実行し、線形 FSC 対線形側方散乱プロット上のビーズと粒子を含むように前方散乱線 (FSC) 閾値を設定しました。その後、蛍光検出器の電圧を計数ビーズに合わせて調整し、ゲート戦略を実行してシリカ粒子と計数ビーズ集団を分離しました。最後に、粒子上のゲートと絶対計数ビーズを描画し、各サンプルについて 1,000 個のビーズ イベントを記録しました。この戦略を使用すると、次の方程式を使用して溶液中の粒子の数が計算されます。
$$begin{array}{l}displaystyle{mathrm{絶対}},{mathrm{数}},left(frac{mathrm{粒子}}{{{upmu l}}}right)=displaystylefrac{({mathrm{粒子}},{mathrm{数}},回,{mathrm{数}},{mathrm{ビーズ}},{mathrm{体積}})}{({mathrm{数}},{mathrm{ビーズ}} ,{mathrm{数}},回,{mathrm{粒子}},{mathrm{体積}})} 回,{mathrm{数える}},{mathrm{ビーズ}},{mathrm{濃度}}左(frac) {{mathrm{ビーズ}}}{{{upmu l}}}右)端{配列}$$
500 smSiP の放射性標識
50 個の smSiP を XNUMX µl の濃縮 [68Ga]GaCl3 0.5 M HEPES バッファー pH 4.9 で溶出。次に、5.6 μlのポリソルベート80を加え、混合物をサーマルミキサー中で90 °C、30 rpmで900分間加熱しました。その後、未反応/コロイドを除去するために最終的な多段階精製プロトコルが設計されました。 68Ga. 10 マイクロリットルの 5 mM EDTA を加え、混合物を室温で 3 分間インキュベートしました。次に、粒子を18,300でXNUMX分間遠心分離しました。g、500 mM EDTA + 1% ポリソルベート 0.1 を含む 80 µl の PBS に再懸濁し、10 秒間穏やかにボルテックスします。粒子を再度遠心分離し、0.1 mM EDTA + 0.1% ポリソルベート 80 の PBS 溶液で洗浄し、10 秒間穏やかにボルテックスしました。最後に、粒子を遠心分離し、PBS + 0.1% ポリソルベート 80 でさらに 500 回洗浄し、XNUMX μl の PBS に再懸濁しました。放射性標識反応は、連続する反応ステップ中に放射性 TLC によってモニタリングされ、コロイド (適切に除去されないと粒子と混同される可能性があります) の存在、粒子の放射性標識、および最終生成物の純度を評価しました。 RLYは、洗浄ステップ後の粒子と上清中の放射能の量を比較することによって計算された。
分別
分画戦略の場合、0.5 µl ~ 20 µl の量の 68理論濃度 1 粒子 µl の Ga-smSiP-1 を異なるサンプルチューブに 1 μl ずつ (0.5、1、2、3…) ずつ加え、PBS を加えて最終容量を 50 μl にしました。次に、最初のチューブから 37.5 μl を 25 番目のサンプル チューブにピペットで移し、12.5 番目のチューブの 12.5 μl を 30 番目のチューブに、最後に XNUMX 番目のチューブの XNUMX μl を XNUMX 番目のチューブに移しました。この戦略では、サンプルあたり XNUMX つのチューブが提供され、チューブあたり最終容量は XNUMX µl になります。各チューブ内の放射能をガンマカウンターで測定し、さらなる比較と分析のために、検量線を使用して値をkBq単位で計算しました。 XNUMX つのチューブのみに大部分の放射能を含むサンプルを室温で XNUMX 秒間超音波処理し、XNUMX 番目の分別ステップに供しました。次に、すべての放射能が XNUMX つのチューブで検出された (他の XNUMX つのチューブでは活性が無視できる) サンプルを、さらなる in vivo/ex vivo 実験に使用しました。
PET/CTファントムイメージング
ファントムイメージング実験が 1 台で行われました。 68Ga-smSiP。カニューレを使用して粒子をサンプルチューブに送達し、投与中に単一の粒子がカニューレチューブ内に捕捉されたままになるかどうかを評価しました。簡単に説明すると、ファントム チューブを nanoPET/CT スキャナー内に配置し、カニューレ先端の端をチューブに取り付けました。 PET取得を開始した後、100 μlのPBSに再懸濁した粒子を、カニューレの先頭に取り付けたインスリン注射器で送達しました。次に、粒子がファントム チューブ内に確実に送られるように、カニューレを 50 µl の PBS で洗浄しました。 PET 取得は 2 時間実行され、その後標準的な CT スキャンが実行されました。
生体内 PET/CT イメージング
動物画像研究は倫理的に審査され、動物実験を管理する 1986 年動物 (科学的手順) 法 (ASPA) 英国内務省規則に従って実施されました。 in vivo イメージングは、健康な 8 週齢の BALB/c マウスで実施されました。動物はイソフルラン (酸素中 2 ~ 3%) で麻酔され、カニューレが挿入され、麻酔下でスキャナー ベッド上に置かれました。動物の体温を正常に保つために、ベッドは内部空気流によって 37 °C に加熱され、呼吸数はモニタリングされ、60 ~ 80 呼吸 min に維持されました。-1 スキャン全体を通して。予期せぬ体温の低下は血液中の粒子の速度の低下につながる可能性があるため、動物の体温の制御を維持することが重要です。 1つ 68Ga-smSiP (n = 4) または 68Ga-smSiP-PEG5k 粒子 (n = 2) を 100 μl の PBS に入れてカニューレを通して投与し、PET 取得開始後に 50 μl の PBS で洗浄しました (1:5 同時計数モード、5 ns の同時計数時間ウィンドウ)。 PETは2 時間記録され、その後、半円形のCTスキャンが実行されました。動物の体温と呼吸数はプロセス全体を通じて監視されました。動的 PET/CT 画像は、Tera-Tomo 3D 再構成 (400–600 keV エネルギーウィンドウ、1:5 一致モード、20 反復および 1 サブセット) を使用して、ボクセル サイズ 0.4 × 0.4 × 0.4 mm で再構成されました。3 減衰、散乱、減衰が補正されます。すべての PET/PEPT 取得のリストモード データは、 68Ga-smSiP 参照。 29 とのために 68Ga-smSiP-PEG5k 参照で。 30.
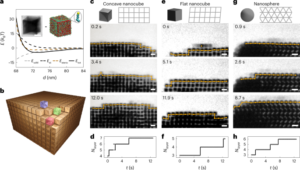
リアルタイム追跡
まず、データはリストモード形式 (つまり、検出された一致光子のタイムスタンプと結晶インデックスを含む形式) でスキャナーからエクスポートされました。幾何学的変換を適用して、結晶のインデックスから mm 単位の位置に変換しました。バーミンガム法では、すべての LoR のサブセットから MDP を繰り返し計算します。これは、MDP から設定された距離よりも遠い LoR を破棄することによって行われます。これは、これらの LoR は、散乱に起因する可能性のある LoR など、誤った LoR から発生する可能性が高いためです。 MDP は反復ごとに改良されます。反復回数は事実上、 f-factor であり、そのサブセット内の最終的な粒子位置を推定するために使用される LoR の総数に関連します (たとえば、 f-係数 0.5 は、サブセット内の LoR の 50% が残ったときに反復ループが終了することを意味します)。サブセットで使用される LoR の数を減らすと、位置の不確実性が増加しますが、時間的サンプリング (サブセットは重なりがなく時間的に連続します) が向上します (アルゴリズムの詳細については、Parker et al.5) バーミンガム法を使用して、PET スキャナーからのリストモード データを分析しました。マウス内の粒子を追跡するために、適応サンプル サイズが使用されました。サンプル サイズは、位置決め誤差を最小限に抑えながら、十分な時間的サンプリングのバランスを達成するように設定されました。スキャンの初期段階 (スキャン開始から <100 s) では、200 ~ 60 LoR のサンプル サイズが使用されました。 f = 0.1、約 1 ~ 5 秒の間隔になります。スキャン時間 > 60 s では、サンプル サイズは 1,000 ~ 2,000 の間で変化し、生体内実験に応じて 30 秒から 60 秒の間の時間間隔が得られました。 MDP (最終反復) の計算に使用されるカウント数は、サンプル サイズに次の値を乗算することで求められます。 f-係数値。これらのパラメータは以前の経験に基づいており、以前の出版物から情報を得たものです。1.
速度は次のように得られました (sqrt{{v}_{x}^{2}+{v}_{y}^{2}+{v}_{z}^{2}}) コラボレー ({v}_{m}^{2}) の速度です x, y および z 行き方。
体外臓器の取り込み
さまざまな臓器での取り込みをガンマ計数によって評価しました。インビボPET/CTイメージングの後、動物を頸椎脱臼により屠殺し、臓器を切除し、ガンマカウンター(LKB Wallac 1282 Compugamma CS)で放射能を計数するために重量を量った。データは、組織 1282 グラムあたりの注射用量 (臓器内の用量 / 注射された総用量) の割合 (%ID g) として表されました。-1).
オートラジオグラフィー
肺内の放射能を放射線検出器 (EP15 プローブ、モーガン) で追跡し、放射性シグナルを持つ組織の小部分が得られるまで肺をメスで小さな切片に切り分けました。組織は-80 °Cのイソプロパノール中で急速凍結されました。凍結直後、組織を最適切断温度媒体に埋め込み、クライオスタット内で 20 µm のスライスに切断しました。放射性スライスが見つかるまで、各スライスが検出器で調査されました。前の(バックグラウンドの下)、放射性スライス、および次の(バックグラウンドの下)のスライスをSuperfrost顕微鏡スライド(Epredia)上に配置した。残りの組織もバックグラウンドを下回りました。 25 つの切片を含む顕微鏡スライドを粘着フィルムで覆い、GE オートラジオグラフィー プレートと一晩対向させました。プレートは、解像度 4,000 µm、PMT 設定 1 の GE Amersham タイフーンを使用して分析されました。オートラジオグラフィー画像が組織の写真に重ねられ、放射性スライス内の 5 つの放射能スポットが示されました。定量化のために、さまざまな既知のアクティビティで標準を調製し、それぞれを 2.0 µl のクインテットとして紙にスポットしました。スポットは、定量化された単一粒子と同じストレージ蛍光スクリーン、GE の BAS-IP MS (多目的標準) 内でインキュベートされました。この画像は、コントロール ソフトウェア バージョン 100 を備えた Amersham タイフーン 4,000 を使用し、蛍光体モード、ピクセル サイズ 10.0 µm、感度 261 で取得されました。画像は、ゲル定量化ツールボックスを使用してソフトウェアImageQantTL vXNUMX-XNUMXで定量化されました。スポットは、スポットの直前または直後の領域を一定の背景として選択することによって補正されました。得られたスポットの体積を使用して、検量線に基づいて粒子内の Bq を計算しました。
統計と再現性
定量分析の場合、in vivo データを除いて、少なくとも 3 つの生物学的複製が分析されました。 68Ga-smSiP-PEG5k (n = 2)。データは、ダネットの多重比較検定とスチューデントの検定を使用した通常の一元配置分散分析 (ANOVA) によって分析されました。 t-テスト。あ P 値 <0.05 は統計的に有意であるとみなされます。
- SEO を活用したコンテンツと PR 配信。 今日増幅されます。
- PlatoData.Network 垂直生成 Ai。 自分自身に力を与えましょう。 こちらからアクセスしてください。
- プラトアイストリーム。 Web3 インテリジェンス。 知識増幅。 こちらからアクセスしてください。
- プラトンESG。 カーボン、 クリーンテック、 エネルギー、 環境、 太陽、 廃棄物管理。 こちらからアクセスしてください。
- プラトンヘルス。 バイオテクノロジーと臨床試験のインテリジェンス。 こちらからアクセスしてください。
- 情報源: https://www.nature.com/articles/s41565-023-01589-8
- :は
- :not
- :どこ
- ][p
- 000
- 1
- 10
- 100
- 12
- 視聴者の38%が
- 19
- 20
- 200
- 2016
- 2022
- 2023
- 23
- 25
- 250
- 26
- 27
- 28
- 29
- 30
- 300
- 33
- 3d
- 50
- 500
- 60
- 65
- 700
- 75
- 8
- 80
- 9
- 90
- 98
- a
- 絶対の
- 従う
- 達成する
- 取得
- 買収
- 買収
- 行為
- 活動
- アクティビティ
- 適応
- 追加されました
- 追加
- 添加
- 調整
- 投与
- 管理
- 進歩
- 後
- その後
- 再び
- 空気
- AL
- アルゴリズム
- すべて
- また
- アンモニア
- 量
- an
- 分析する
- 分析
- アンカー
- および
- 動物
- 動物
- 適用された
- 約
- です
- 発生します
- AS
- At
- b
- 背景
- ベース
- ベース
- 基礎
- BD
- BE
- 開始
- 以下
- の間に
- バーミンガム
- 血
- ボディ
- 簡潔に
- 持って来る
- バッファ
- by
- 計算する
- 計算された
- 計算する
- 計算
- 缶
- 実施
- 触媒
- セル
- 化学品
- 選択する
- クリック
- 一致
- 比較
- 比較
- 構成
- 濃縮
- 濃度
- 実施
- 混乱
- 連続した
- 見なさ
- 定数
- 連続的に
- コントロール
- 制御
- 変換
- 訂正さ
- 費用
- 可能性
- カウンター
- カウント
- カバー
- クリスタル
- cs
- 曲線
- カット
- 切断
- データ
- 配信する
- 配信
- 配達
- によっては
- 記載された
- 設計
- 細部
- 検出された
- 決定
- 発展した
- の違い
- 異なります
- 方向
- 転位
- 距離
- ありません
- 線量
- 描かれた
- Drop
- 間に
- ダイナミック
- e
- E&T
- 各
- 早い
- 効果的に
- 電解質
- 埋め込まれた
- エミッション
- 採用
- end
- エネルギー
- エンジニアリング
- 確保
- 装置
- エラー
- 推定
- エーテル(ETH)
- 評価する
- 評価
- イベント
- 例
- 除く
- 除外
- 体験
- 実験
- 実験
- 表現
- false
- イチジク
- 膜
- filter
- ファイナル
- 最後に
- 名
- 五
- フロー
- 続いて
- フォロー中
- 形式でアーカイブしたプロジェクトを保存します.
- フォワード
- 発見
- 4
- 第4
- 氷結
- から
- 凍結
- FSC
- さらに
- ゲイツ
- ge
- ジェネレータ
- ガラス
- 良い
- 統治
- グラム
- 成長性
- 健康
- こちら
- ホーム
- ホームオフィス
- HTTPS
- if
- 画像
- 画像
- イメージング
- 直ちに
- 重要
- 改善します
- in
- include
- の増加
- 培養
- 独立しました
- index
- 索引
- 情報に基づく
- インスタント
- 説明書
- 楽器
- 楽器
- 統合された
- インタフェース
- 内部
- に
- IT
- 繰り返し
- 繰り返し
- キープ
- 既知の
- Kx
- つながる
- 可能性が高い
- LINK
- 肺臓
- 保守
- 製造された
- 製造業
- 材料
- 五月..
- 手段
- 測定された
- 計測
- ミディアム
- 方法
- メソッド
- マウス
- ミクロン
- 顕微鏡
- 分
- 最小化
- 最小
- ミキサー
- 混合
- ML
- モバイル
- モード
- 監視対象
- 他には?
- モーガン
- 最も
- MS
- の試合に
- 掛け算
- ナノテクノロジー
- 自然
- 次の
- いいえ
- 通常の
- 数
- 入手する
- 得
- of
- Office
- on
- ONE
- の
- 反対した
- 最適な
- or
- 一般
- その他
- さもないと
- でる
- が
- 一晩
- 酸素
- 紙素材
- パラメータ
- 粒子
- 渡された
- PBS
- 以下のために
- 割合
- 実行
- ペット
- ファントム
- 相
- 光子
- 画像
- ピクセル
- 配置
- プラトン
- プラトンデータインテリジェンス
- プラトデータ
- 人口
- 部分
- 位置
- ポジショニング
- 陽電子
- 練習
- 準備
- プレゼンス
- 前
- 前に
- 素数
- 事前の
- プローブ
- 手続き
- プロセス
- 作り出す
- プロダクト
- 正しく
- 提供します
- は、大阪で
- 提供
- 購入した
- 品質
- 定量化
- 量
- R
- 放射線
- ラジオ
- 範囲
- レート
- 反応
- 反応
- への
- 受け
- 最近
- 記録された
- 回復
- 電話代などの費用を削減
- 削減
- 参照
- 洗練された
- 地域
- 規制
- 関係する
- 残る
- 残り
- 削除します
- 削除済み
- 複製
- 要件
- 解像度
- REST
- 結果として
- レビュー
- 日
- ルーム
- ラン
- s
- 同じ
- スキャン
- スキャニング
- スキャン
- SCI
- 科学的な
- 画面
- 二番
- 秒
- セクション
- SEM
- 感度
- セッションに
- 設定
- 表示
- シグマ
- シグナル
- 重要
- シリコン
- サイズ
- サイズ
- スライス
- スライド
- 小さい
- スナップ
- ソフトウェア
- 溶液
- ソリューション
- ソース
- 特定の
- Spot
- 斑
- ステージ
- 標準
- 規格
- start
- 起動
- 明記
- 統計的に
- 手順
- ステップ
- ストレージ利用料
- 戦略
- 流れ
- 研究
- 研究
- 勉強
- 十分な
- 供給
- 調査対象となりました
- 合成
- 取り
- 技術
- テクノロジー
- test
- より
- それ
- その後
- 理論的な
- サーマル
- ボーマン
- 三番
- この
- 三
- しきい値
- 介して
- 全体
- 時間
- <font style="vertical-align: inherit;">回数</font>
- タイムスタンプ
- 先端
- 〜へ
- ツール
- ツールボックス
- トータル
- 追跡する
- 追跡
- 変換
- 閉じ込められました
- 2
- Uk
- 不確実性
- 下
- 予期しない
- ユニット
- まで
- 中古
- 値
- 価値観
- 速度
- バージョン
- 対
- 生体
- 電圧
- ボリューム
- ボリューム
- ボクセル
- W
- ました
- 洗浄
- 水
- した
- いつ
- かどうか
- which
- while
- 全体
- 意志
- ウィンドウを使用して入力ファイルを追加します。
- 以内
- 産出
- 得られた
- 収穫
- ゼファーネット
- 〒